miR-125b靶向调节p53表达对生精细胞发育能力的影响*
谢 丽 彭凤兰
长沙卫生职业学院,湖南省宁乡县 410600
精子发生需要经历复杂而有序的一个过程,在发育阶段的特异性基因表达以及调控属于正常精子得以形成的分子基础[1]。目前,通过对不同基因修饰小鼠模型展开深入研究,已经鉴定出了400余个与精子发生异常具有一定关系的基因,表明多种基因在精子发生过程中会出现特异性表达,并且具有功能,但其具体调节机理尚需展开深入研究[2]。miR-125b是miR-125家族中的一员,已被证实在不同生物过程中起着重要的作用,分析和鉴定生精细胞中miR-125b中靶基因,对于研究miR-125b对生精细胞的影响有重要意义[3]。p53为凋亡基因中第一种,研究发现生精细胞中miR-125b的靶基因可能为p53[4]。但miR-125b在生精细胞发育过程中的作用及机制尚不明确,因此本课题通过对小鼠生精细胞培养模型,探究miR-125b靶向调节p53表达对生精细胞发育能力的影响及作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:选取出生7d的清洁级健康小鼠,购于北京实验动物中心,此次试验严格参照《中华人民共和国实验动物管理条例》中的规定流程展开,且符合伦理要求。
1.1.2 实验药品及器材:细胞培养基由Hyclone公司提供;磷酸缓冲盐溶液均购于武汉博士德生物工程有限公司;胶原酶Ⅳ以及胰酶均购于Sigma公司;四甲基偶氮唑盐由Beyotime Biotechnology 公司提供;二甲基亚砜由Ameresco公司提供。
1.2 方法
1.2.1 原代培养支持细胞:以颈椎脱臼法将小鼠处死,无菌取出睾丸,放入培养皿内,以磷酸缓冲盐溶液对睾丸表面附着的血液进行冲洗后,倒入新磷酸缓冲盐溶液,以镊子、剪刀对小鼠白膜进行去除,并剪碎睾丸,以2g/L胶原酶Ⅳ及2g/L胰酶依次对睾丸组织进行低温下消化。予以离心后,取上清液,再制备单细胞悬液,将其接种至培养瓶内,放置于二氧化碳培养箱中进行孵育,2h即可,当细胞贴壁后,对培养基进行置换,予以培养过夜,并对细胞状态进行定期观察,对细胞培养基及时更新,待细胞达到单层铺满状态后,以磷酸缓冲盐溶液进行3次清洗,予以胰酶消化,以计数板进行准确计数,并重新接种。
1.2.2 四甲基偶氮唑盐法测定细胞增殖:以四甲基偶氮唑盐法对96孔板中的细胞接种数量进行控制,维持1×105个/L,并于每组中均设置为5个重复,各孔的接种量控制为200μl。对96孔板进行轻柔晃动,于37℃环境中放置于二氧化碳培养箱内予以培养2d后取出,分别于每孔中加入20μl四甲基偶氮唑盐,摇匀后置于二氧化碳培养箱内再次予以4h培养,将上清液去除后,于每孔中加入150μl 二甲基亚砜,以酶联免疫检测仪对490nm处的吸光度进行测定。
1.2.3 免疫印迹试验:于6孔板中对250μl支持细胞进行接种,放入培养箱中进行培养2d,待胰酶消化,对细胞进行收集,以磷酸缓冲盐溶液进行清洗,并离心处理,取沉淀组织,对细胞进行低温裂解,经十二烷基硫酸钠—聚丙烯酰胺凝胶电泳。
1.2.4 实时荧光定量—聚合酶链式反应:于6孔板中对250μl支持细胞进行接种,放入培养箱中进行培养,当细胞贴壁达到单层覆盖后,提取RNA,予以反转录,并进行实时荧光定量—聚合酶链式反应,经十二烷基硫酸钠—聚丙烯酰胺凝胶电泳,对p53进行测定。
1.3 数据处理 以GraphPad Prism 5软件对四甲基偶氮唑盐法和实时荧光定量—聚合酶链式反应数据进行分析。
2 结果
2.1 miR-125b对支持细胞的影响 给予小鼠原代支持细胞组织相应对照、转染miR-125b inhibitor及miR-125b mimic后,予以实时荧光定量—聚合酶链式反应检测,发现miR-125b过表达且被敲低,见图1-①。经四甲基偶氮唑盐法与免疫印迹试验,显示转入miR-125b mimic后,小鼠的支持细胞增殖能力明显增加,见图1-②;而转入miR-125b inhibitor后,小鼠的支持细胞增殖能力明显衰退,见图1-③。
2.2 miR-125b对p53表达的影响 免疫印迹试验及实时荧光定量—聚合酶链式反应结果发现,miR-125b inhibitor对于p53表达起着促进作用,而miR-125b mimic对p53表达起着抑制作用,见图2。
2.3 p53表达对支持细胞的影响 于小鼠支持细胞中进行p53 小干扰RNA-1、2、3转染,并以实时荧光定量—聚合酶链式反应进行检测,结果发现小干扰RNA-2及小干扰RNA-3对于p53表达的沉默效果十分显著,见图3-①,再对小干扰RNA-3细胞组织进行四甲基偶氮唑盐试验,发现敲低p53后,小鼠的支持细胞增殖能力会明显升高,见图3-②。
3 讨论
近年来,随着社会化工业化程度的进一步提高,环境污染问题愈发严重,不孕不育发生率不断升高,已成为影响人类社会的常见病症[5]。研究[6]发现,育龄夫妇中,不孕不育的发生率已达到10%~15%,其中由男方因素所致不孕不育的占有比为50%,且大多患者的病因、发病机制并未明确。精子发生是一个十分高效的过程,正常情况下,健康男子平均每秒可产生数千颗精子,然而仅少数精子的形态正常,并且还呈现出逐年下降趋势[7]。世界卫生组织预测,男性不育问题愈加严重,即将发展为仅次于肿瘤及心脑血管病的第三大疾病,且会成为生殖健康领域工作研究中的重要项目[8]。

图1 miR-125b促进支持细胞组织增殖
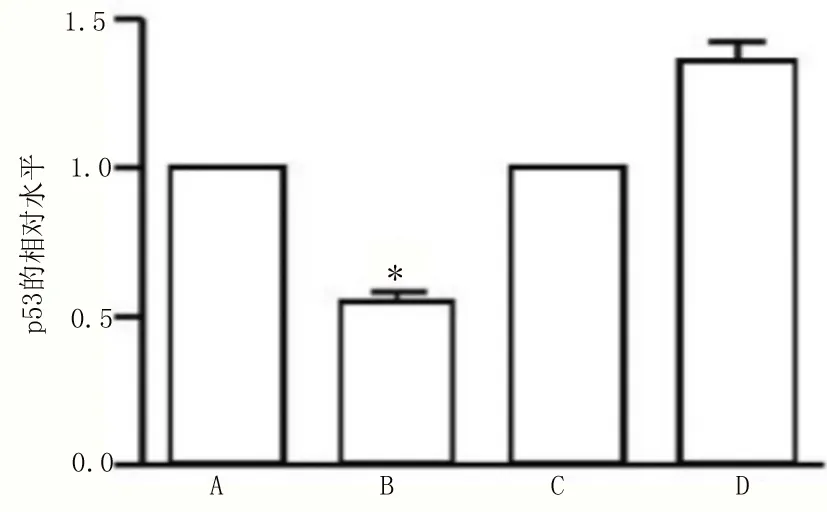
图2 miR-125b下调p53表达
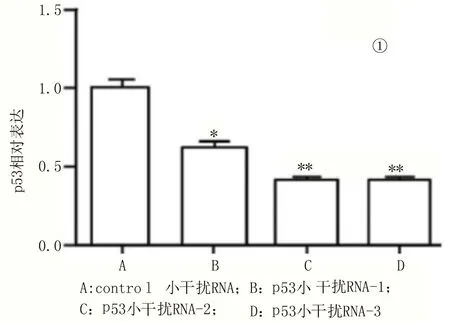
图3 p53促进支持细胞组织增殖
当前,随着以体外受精技术为代表的现代化新型辅助生殖技术的进一步发展与完善,不育症患者已获取到拥有自己后代的机会,尽管生殖医学新时代已经到来,但是各种辅助性受孕技术绕过了受精过程中对潜在具有遗传缺陷的异常精子的自然选择机制,因此可能使后代遗传缺陷[9]。鉴于此,对男性不育的发生因素以及分子机制展开深入分析,并根据分析结果提出切实可行的诊治措施显得尤其关键。microRNA(miRNA)是一类新发现的短片段,已逐渐成为生物学中的研究重点,miRNA可与靶基因mRNA产生相互作用,使靶基因mRNA的稳定性有效降低,在细胞增殖、发育及分化等过程中均起着关键性作用[10-11]。研究[12]表明,男性生精细胞组织内存在大量miRNAs表达,且对精原细胞组织分析及自我更新产生调节作用。miR-125b属于miR-125家族成员,有2个前体,即pre-miR-125b-1以及pre-miR-125b-2,其编码基因分别位于11号和21号染色体上[13]。本次研究通过创建小鼠模型,发现miR-125b可使p53表达下调,p53表达是miR-125b的靶基因。将p53的小干扰RNA转染支持细胞后,发现p53基因沉默可对支持细胞组织增殖产生促进作用。miR-125b能够下调BMF,而BMF属于Bcl-2属于促凋亡家族中的成员,当BMF下调后,对于细胞转移以及细胞增殖均可起到促进作用,因此miR-125b表达表现出组织器官差异性特征,通过对细胞增殖凋亡相关的p53基因表达进行调节,促使细胞的增殖及凋亡能力发生变化,提高生精细胞发育能力[14-15]。
综上所述,miR-125b通过靶向调节p53表达,从而促进生精细胞发育能力的提升。

