铂类抗癌药物的研究现状与进展*
王宇静,熊惠娟,吴莎莎,周学文,王小波
(湖北科技学院,湖北 咸宁 437100)
1965年Rosenberg首次发现顺铂(cisplatin)具有强抗肿瘤活性,关于铂类药物的研究由此而始[1]。铂类药物具有效率高、广谱、副作用小、作用机制独特等特点,与非铂类药物联用可减少耐药性,临床应用范围广泛。据统计,目前约40%~80%的肿瘤患者都接受了含有铂类药物的化疗[2]。其中,顺铂对睾丸癌的治愈率已超过95%[3]。在治疗晚期非小细胞肺癌(NSCLC)时,多选用含铂双药配伍方案进行化疗[4]。研究表明,紫杉醇、多西紫杉醇、吉西他滨、长春瑞滨、培美曲塞等药物均可与铂类药物联用,并已成为各种癌症的一线化疗方案[5-7]。
1 发展史
1.1 第一代铂类药物
1978年,顺铂作为第一代铂类抗肿瘤药物经美国食品与药品监督管理局(FDA)批准后上市,随即广泛用于各种恶性肿瘤的治疗,尤其对睾丸癌、肺癌、卵巢癌、头颈部肿瘤等疗效显著。顺铂的结构如图1所示,其作用机制通常被认为是进入细胞核后与DNA形成铂-DNA加合物,扰乱了DNA的正常双螺旋结构,严重影响DNA的复制、转录,最终导致足够的DNA损伤,引发细胞凋亡或死亡[8]。顺铂在癌症化疗领域取得了巨大成功,但是其缺点也日益突出,亟待改进。首先,使用顺铂若干次后,肿瘤组织产生耐药性,包括内源性耐药和获得性耐药。其次,对非肿瘤组织产生了较强的毒副作用,包括神经毒性、肾毒性等,病人常表现为恶心、脱发、呕吐和乏力等[9]。
顺铂在细胞内的积累与其毒性直接相关。研究表明,顺铂-DNA加合物的数量越多,对细胞毒性作用越大[10]。有时全身注射顺铂时可导致严重的副作用,轻则造成听力损失,严重情况下可能产生溶血。因此,提高抗耐药性和降低毒副作用刻不容缓,并成为优化铂类药物的指导原则。第二、三代铂类抗癌药物均是在此基础上优化、筛选而来。
1.2 第二代铂类药物
第二代铂类药物的典型代表是卡铂(carboplatin),在顺铂结构基础上保留了两个NH3,以双羧酸基团螯合配位取代了之前的两个Cl(结构见图1)。此举是基于包含顺铂在内的铂配合物的抗癌机制和离去基团水合速率的高低,而这两者都直接影响到铂类配合物的毒性强弱。卡铂于1989年在美国上市,其水合速率为10-8/S,相比顺铂的10-5/S大幅下降,对正常细胞的毒性也明显降低,最大使用剂量可达到300~450mg/m。同时,其剂量限制毒性也完全区别于顺铂[11]。
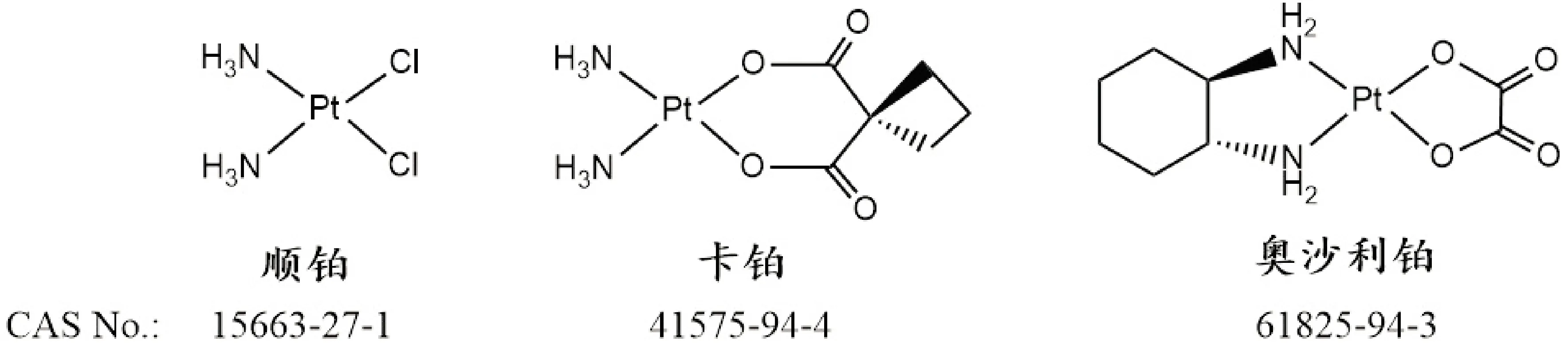
图1 顺铂、卡铂及奥沙利铂的结构与CAS号。
奈达铂(nedaplatin)是第二代铂类抗癌药物的另一个代表,它具有良好的水溶性(顺铂的10倍),另一突出优点是它对比顺铂和卡铂具有更小的肾毒性[12]。奈达铂于1995年成功在日本上市,临床主要用于非小细胞肺癌、小细胞肺癌、头颈部癌及食管癌等的化疗。
1.3 第三代铂类药物
第三代铂类药物以奥沙利铂作为代表,于1996年注册上市,临床主要用于胃肠道肿瘤。奥沙利铂相对于卡铂而言,保留了双羧酸螯合基团,进一步以双氨基配体(1R,2R)-二氨基环己烷进行修饰,抛弃了顺铂和卡铂独有的双NH3。奥沙利铂是第一个被批准用于治疗转移性结直肠癌的铂类药物,与氟尿嘧啶和亮氨酸联合使用。有研究通过探索奥沙利铂与质粒DNA的相互作用过程,认为其作用机制为奥沙利铂通过化学键合作用和静电作用使质粒DNA逐渐凝结为紧密的球状结构,此结构可对抗癌活性及疗效产生影响[13]。奥沙利铂通过核DNA加合物的形成干扰DNA复制和转录系统。尽管与其他铂化合物相比,奥沙利铂的耐受性更好,但它仍然存在一些毒副作用,如神经毒性、血液和胃肠道毒性、中性粒细胞减少、恶心和呕吐等,这些无疑限制了其可用剂量范围[14]。
第三代铂类抗癌药物另有乐铂(lobaplatin)和庚铂(heptaplatin),它们分别在中国(2003年)和韩国(1999年)上市。其中,乐铂的双氨基配体为S,S或R,R构型的1,2-二甲胺环丁烷,其肾毒性、神经毒性与耳毒性均较小,剂量限制毒性常现于血小板减少[15]。当前乐铂主要用于治疗慢性髓细胞白血病、转移性乳腺癌和小细胞肺癌等。庚铂的突出优势是它对于顺铂呈耐药性的细胞或组织仍有显著效果,同时其组织毒性却更低。剂量限制毒性见于肝毒性、肾毒性与骨髓抑制,目前主要用于治疗胃癌[16]。
1.4 其他铂类药物
2009年10月,日本住友制药株式会社研制并上市了一种主要用于治疗肝癌的脂溶性铂复合物新药——米铂(miriplatin);2010年1月,米铂及其专用混悬液同时上市销售。本品是溶于专用碘化罂粟子油脂肪酸乙酯、肝动脉内给药的抗癌药物,其与碘化罂粟子油脂肪酸乙酯的亲和性高,且肝动脉内给药后滞留于肿瘤部位。混悬液中的铂配合物可长时间缓慢释放进入血液或组织中,并与DNA结合,通过阻止DNA合成而抑制癌细胞增殖,提高了抗癌效果[17]。临床试验显示,不论是首次接受此项治疗肝细胞癌患者,还是一些接受过肝切除等其他治疗方法的复发患者,本品都表现出良好的抗癌效果,产生副作用与前述铂类药物相似。在精通此类疗法的医疗机构接受米铂化疗,副作用都可控制在耐受范围。
米铂本质上仍属第三代铂类抗癌新药。还有一些尚处于临床试验阶段的如PT-112[18](美国),BTP-114[19](美国),Dicycloplatin[20](中国)等,本文在此不一一展开细述。
2 作用机制
关于铂类药物的作用机制近年来有不同的观点,其中最主流的观点是铂类药物作用于DNA,造成DNA损伤,从而发挥治疗作用。基础研究发现,Pt复合物是导致细胞停滞的DNA结合剂。顺铂的抗肿瘤作用是由形成共价DNA加合物的能力决定的,包括链内1,2d(Gp-G)和1,3d(Gp-Xp-G)加合物和链间G-G交联。这些复合物扭曲DNA结构,从而抑制复制和转录,如果不修复,则通过凋亡途径导致细胞死亡[21]。另有房田田等[22]则认为铂类药物通过和体内的各种蛋白质如:铜蛋白、锌蛋白、血浆蛋白、线粒体蛋白质、锌指蛋白及与铂类药物吸收、转运、排泄过程有关的蛋白质相互作用才是影响其抗癌作用的机理。
3 研究开发现状
顺铂虽然临床应用广泛,但仍存在耐药性、组织毒性等缺点。第二代、第三代铂类抗肿瘤药物相比于顺铂已经弥补一部分缺陷。但是由于其作用机制相似,无法克服易产生耐药性和组织毒性等缺点。有研究认为铂类药物的主要耐药机制包括膜蛋白介导的肿瘤多药耐药性(MDR)基因过表达;DNA 修复功能增强、凋亡机制异常;细胞解毒功能增强;DNA拓扑异构酶过表达活性增强、肿瘤细胞内药物蓄积减少、细胞解毒能力增强、细胞凋亡功能受抑制或失活等[23-24]。因此,仅依靠对氨基配体、离去基团的简单修饰已无法满足临床需要,我们需要采取措施合成发现更多新型铂类药物。下面就当前研究较热的Pt(Ⅳ)配合物和Pt-M双金属配合物举例做简单介绍。
3.1 四价铂配合物
Pt(Ⅳ)配合物是一种潜在的抗癌药物,较Pt(Ⅱ)配合物而言具有更高的动力学上惰性,Jin等[25]设计了一种新的Pt(Ⅳ)配合物[Pt(NH3)2Cl2(C10H15N2O3S)(C2HO2Cl2)](DPB),并关于轴向配体对配合物的活性及对肿瘤细胞能量代谢的影响进行了探讨。目前正在开发几种以肿瘤细胞的独特特征为目标的Pt(Ⅳ)配合物,随着Pt(IV)配位化学的发展,将产生新的配合物,以测试被确定的分子靶点是否为癌细胞所特有。虽然与轴向配体共轭的潜力巨大,但开发合成化学能够为轴向位置提供新的供体,以允许更广泛的还原电位和反应活性。与Pt(Ⅱ)同系物相比,Pt(Ⅳ)前体药物具有治疗优势。与方形平面Pt(Ⅱ)配合物不同,低自旋d6 Pt(Ⅳ)中心采用八面体几何,因此是配位饱和的。因此,Pt(Ⅳ)前体药物比其Pt(Ⅱ)对应物更耐配体取代,降低了毒副作用[26]。
Gregory 等[27]报道了含有二茂铁(Fc)的新的Pt(Ⅳ)配合物,不同配合物之间的区别仅仅在于连接到Fc亚基官能团的性质(酯与酰胺)不同,一点细微结构变化(一个原子差异)就可能导致对肺癌细胞A549的溶解性、稳定性和抗增殖活性的明显差异。Huang等[28]设计并合成了一种新型的Pt(Ⅳ)配合物,包含单氨基磷酸酯部分,其不仅可以用作骨靶向基团,而且还能够抑制基质金属蛋白酶(MMPs)的活性。与顺铂和奥沙利铂相比,该化合物具有更强的抗肿瘤活性,而对人正常肝细胞的毒性则较低。
3.2 Pt-M双金属配合物
近年来,利用铂与其他金属形成复合配合物,从而得到具有双功能或多功能的新型铂类药物成为新兴的研究热点之一。有文章报道了一种新型异核Pt(Ⅳ)-Ru(Ⅱ)抗癌药物,该配合物在水相和PBS缓冲溶液中均表现出良好的稳定性。生物评价表明,该双功能Pt(Ⅳ)-Ru(Ⅱ)配合物利用了两个金属中心的优点,既具有细胞毒性,又具有抗转移特性。肿瘤-正常细胞共培养系统进一步证实了它对癌细胞的良好选择性[29]。Li等[30]制备了树枝单分散的硒或铂配位树枝状聚合物,其中硒是埋在里面的铂芯,树枝状大分子配位树状大分子在不加任何药物的情况下,表现出可控的抗癌活性,体内研究证实了它们的抗癌活性和对正常组织的低毒作用。Malgorzata 等[31]描述了新的Au(Ⅲ)和含亚胺磷酸酯配体的Pt(Ⅱ)络合物,进一步研究表明这些化合物致细胞死亡的主要机制是凋亡。
4 结语与展望
从结构和研究策略上看,铂配合物性质较稳定,可设计成前药,以减少对组织正常细胞的损害作用。另外,也可将铂与其他金属形成复合配合物,从而得到具有双功能或多功能的新型铂类药物,这些金属配合物表现出细胞毒性、良好的稳定性、选择性强等优点。这些新型铂类药物为癌症临床治疗提供了更多的可能性和选择性。
综上所述,铂类药物具有显著的抗肿瘤作用,临床应用广泛;与此同时,铂类药物也具有毒性、耐药性等缺点。近年来,研究者们设计各种新型铂类抗肿瘤药物,其中一系列铂配合物类在抗癌活性研究方面取得了突出成果,有几种药物已经进入临床试验阶段。由此可见,铂类药物将在抗癌领域继续发挥中流砥柱的作用,而新型铂类抗癌药物仍存在巨大的潜力等着我们去研究发现,也势必将成为下一代最具希望的抗癌先锋。

