IFN-γ-CXCL9/10-CXCR3信号轴与白癜风的研究进展
曹凯娜,陈 宁,朱 威
白癜风是一种较常见的由黑素细胞破坏引起的自身免疫性疾病。目前白癜风的发病机制尚未完全阐明,主流说法包括自身免疫、氧化应激、遗传易感和神经体液等,现普遍认为自身免疫是其重要的致病因素之一。越来越多的研究揭示了IFN-γ-CXCL-9/10-CXCR3 通路相关蛋白在表皮募集并介导CD8+T 淋巴细胞杀伤黑素细胞在白癜风病程进展中发挥着重要的作用。本文将阐述这条通路发挥效应的具体机制及其重要性,并介绍干扰素(IFN)-γ 信号通路在未来具有监测病情、早期预防和治疗的临床发展潜力。
1 IFN-γ-CXCL-9/10-CXCR3信号轴及其在白癜风病程中的作用
IFN-γ 属于Ⅱ型干扰素,主要由自然杀伤细胞和自然杀伤T 淋巴细胞分泌,在抗原特异性免疫过程中则由CD4+Th1 和CD8+细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)产生,其异常表达与自身炎症和自身免疫性疾病相关[1]。研究发现与健康皮肤相比,白癜风皮损处的T 淋巴细胞显著富集,并识别酪氨酸酶、GP100(premelanosome protein,PMEL,也称GP100)、T 淋巴细胞识别的黑素抗原-1(melanoma antigen recognised by T-cells 1,MART-1)等黑素细胞特异性抗原,并诱导黑素细胞的凋亡[2]。IFN-γ 可与细胞表面受体结合,并通过Janus 激酶信号转导和激活转录因子(Janus kinases signal transducer and activator of transcription proteins,JAK-STAT)途径启动信号级联调节免疫功能,促使表皮细胞分泌CXCL-9/10[3],CXCL-9/10 进一步通过其同源受体CXCR3 促进自身反应性CD8+T 淋巴细胞在表皮募集(图1),进一步加重炎症反应[4]。
1.1 IFN-γ
越来越多的研究显示IFN-γ 的皮肤角质形成细胞信号传导通路在白癜风的发生发展中有重要作用。在表皮及体外试验中均已证实白癜风发病机制与自身反应性黑素细胞特异性CD8+T 淋巴细胞在表皮浸润并介导细胞毒性作用有关[2,5]。Harris 等[6]以具有黑色皮肤和毛发的小鼠为宿主,通过向小鼠过继转移黑素细胞特异性CD8+T 淋巴细胞建立了白癜风疾病模型。该模型研究了IFN-γ 对于色素脱失过程的特异性作用,实时定量逆转录PCR 可检测到表皮浸润的黑素细胞特异性T 淋巴细胞在脱色素介导的第2 周直至整个病程较健康对照组IFN-γ 表达水平高,这些细胞来自皮肤引流淋巴结,而非表皮原位T 淋巴细胞;试验进一步向发生色素缺失的小鼠腹膜内注射IFN-γ中和性抗体,发现其脱色过程明显受到抑制,且表皮浸润的特异性T 淋巴细胞数量显著下降。其研究结果提示IFN-γ 及其下游细胞因子通过诱导外周循环T 淋巴细胞和表皮极化分布,对靶细胞产生细胞毒性效应,从而参与白癜风的发病过程。
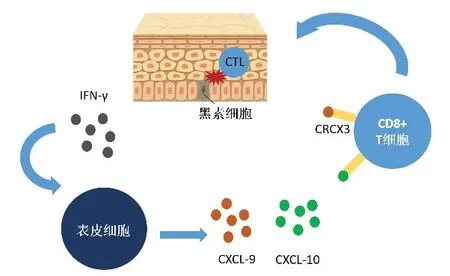
图1 IFN-γ-CXCL-9/10-CXCR3信号轴
1.2 CXCL-9、CXCL-10
CXCL-9、CXCL-10 同为IFN-γ 介导产生的趋化因子,两者共同的配体是广泛分布于免疫细胞、上皮细胞的CXCR3,CXCL-9、CXCL-10 通过与CXCR3结合来调节病损处T 淋巴细胞、单核细胞、自然杀伤细胞的免疫募集过程[7]。已有较多研究检测到白癜风进展期患者血清及组织中CXC-9、CXCL-10 水平较健康对照者及稳定期患者升高[8-13],其中CXCL-10的升高水平更显著,这一结果与其他文献报道的白癜风患者CXCR3+免疫细胞表达增强的结果是匹配的[9,11]。CXCL-9、CXCL-10 共同对黑素细胞特异性CD8+T淋巴细胞产生趋化作用,引起病损处免疫损伤,表明这两种细胞因子在白癜风病情变化中的关键作用[9,10]。外周血中高水平的CXCL-9/10 也是宿主Th1免疫应答的标志,IFN-γ 刺激多种细胞产生CXCL10募集Th1 淋巴细胞,同时Th1 淋巴细胞可继续增强IFN-γ的产生,从而对IFN-γ通路产生正向调节作用[8]。
还有研究发现CXCL-9、CXCL-10 在皮损病变处的时间、空间分布均有所不同,提示可调节T 淋巴细胞在白癜风的各个病程阶段发挥不同的效应。Richmond 等[14]培育了具有人黑素细胞的Krt14-Kitl 小鼠模型模拟并揭示了白癜风的初始效应阶段及发展过程。试验结果可观察到小鼠皮损边缘仅有CXCL-9 的表达,提示其可能与疾病始动阶段相关;而CXCL-10 更多地在表皮浅层聚集。进一步实验表明,CXCL-9 在皮损出现前即高度表达,而CXCL-10水平随病变发展达到高峰并稳定维持10 周。且这两种趋化因子大部分由表皮角质形成细胞及朗格汉斯细胞产生,表明角质形成细胞通过募集自身反应性T淋巴细胞来促进白癜风发展,CXCL-10-STAT1 信号传导通路是小鼠表皮GP100 特异性T 淋巴细胞浸润和脱色素所必需的。另有使用CXCL-9 和CXCL-10缺陷动物为模型的研究证明,CXCL-9 在白癜风初始阶段向皮肤募集大量T 淋巴细胞,而CXCL-10 对特异性T 淋巴细胞在表皮浸润并杀伤黑素细胞具有重要作用[10],CXCL-9/10 在时空上不同的分布有望成为监测病情、预测发展和治疗的重要指标。
2 CXCL-9/10可作为白癜风病情监测的生物标志物
白癜风稳定期与进展期的治疗策略有很大不同,因此动态检测患者的皮损发展状态尤为关键,目前已有较多种类的组织及循环标志物被报道可用作病情监测[15]。由于IFN-γ 水平在白癜风发病阶段短期内爆发性升高,因此不适宜做为病情检测的指标[16],近期有研究显示CXCL-9/10 作为IFN-γ 通路的下游信号扩增器,有望成为可靠的临床生物标志物。
Abdallah 等[13]比较了活动性、稳定性白癜风患者及健康对照受试者血清中包括IFN-γ、CXCL-10、IL-6在内的细胞因子水平,结果显示活动性患者体内所有被检测的细胞因子水平较健康对照组和病情稳定组均有升高,与CD8+细胞水平的升高具有一致性。进一步测量血清标志物特征曲线可发现CXCL-10 较其他细胞因子特异性最高,而IL-6 敏感性最高,IFN-γ 血清水平仅在活动性白癜风患者中显著提高(CXCL-10 >100 ng/L,灵敏度83.3%,特异性96.0%;IL-6 >0.025 ng/ml,灵敏度96.7%,特异性80.0%)。Wang 等[11]的研究结果发现了血清CXCL-10 水平与患者白癜风面积评分指数(vitiligo area scoring index,VASI)评分具有正相关性,同时CXCL-10 水平的降低与经治疗的活动性白癜风病情恢复具有一致性,以上结果均提示CXCL-10 可作为衡量白癜风病情活动性的非侵入性检测指标。Richmond 等[17]进一步比较了进展期与稳定期皮损CXCL-9 和CXCL-10 水平,发现两者均可作为疾病活动水平标志物,CXCL-10 较CXCL-9 更能反应疾病严重程度,这可能与两种细胞因子在白癜风病程中的不同时空作用相关:CXCL-9 在发病初期导致大量淋巴细胞募集,CXCL-10 高峰水平持续时间较长,承担后期调控作用。
在大型队列研究中,研究者检测到白癜风患者的血清趋化因子水平具有一定的趋势,但具体到个体水平可能有较大的变化而不能真实反应患者的病情活动[18],同时血清学水平可能受到其他炎症性疾病的影响,增加了测试结果的不稳定性。因而有研究者采用了损伤较小的皮肤吸疱技术寻找合适的标志物。Strassner 等[12]使用的改良皮肤吸疱技术通过负压诱导人工水疱,抽取的疱液可用来检测浸润细胞表型及细胞因子,这种方式损伤小且不易造成瘢痕。作者检测了患者皮损处与正常皮肤的疱液,发现CXCL-9升高水平较CXCL-10 显著,提示其可作为组织检测的病情标志物。CXCL-10 水平在部分健康对照受试者中也有升高,可能与吸疱造成的损伤有关,同时这可能是导致CXCL-10 的疱液水平与疾病活动度相关性不大的原因,而CXCL-11(其与CXCL-9/10 具有相同的配体CXCR3)及IFN-γ 水平未有明显提高,因此对于应用皮肤吸疱技术检测和监控白癜风,CXCL-9 是更合适的生物标志物。
3 IFN-γ-CXCL9/10-CXCR3信号轴可作为未来治疗的靶点
Harris 等[6]已通过小鼠模型初步肯定了特异性阻断IFN-γ 可抑制皮损发展,但IFN-γ 具有诱导清除病毒、细菌等病原体适应性免疫功能对于人体免疫防御功能具有重要意义,因此IFN-γ-CXCL9/10-CXCR3 信号轴的下游因子作为潜在治疗靶点更具有临床意义。
辛伐他汀是一种经食品药品管理局(FDA)批准使用的HMG-CoA 还原酶抑制剂类降脂药,已有研究和病例报道证实辛伐他汀在体外可抑制IFN-γ诱导的STAT1 活化过程[19,20]。Agarwal 等[20]发现使用辛伐他汀治疗小鼠可减轻色素脱失,减少表皮黑素细胞特异性T 淋巴细胞的浸润,其效应与剂量正相关而对表皮CXCL-10 表达无影响,提示辛伐他汀通过直接影响T 淋巴细胞的增殖来发挥效应。
还有试验探究了CXCR3作为治疗靶点的可能性。Richmond 等[17]在诱导脱色后的第2 周~第7 周向3组模型小鼠体内分别注射CXCR3 中和性抗体、消耗性抗体和强势消耗性抗体,且3 种抗体对于CXCR3均具有相似的亲和力,结果显示这些抗体均可预防白癜风的发生,同时伴随小鼠表皮黑素细胞特异性抗体GP100 表达减少,其中强势消耗性抗体作用最强。研究进一步观察并肯定了CXCR3 消耗性抗体对于稳定期小鼠色素脱失具有良好的逆转作用。但试验过程中可观察到消耗性抗体可导致CD8+细胞在外周血和脾脏的数量轻度减少,对粒细胞和CD4+细胞无不良影响,因此需要进一步探究CXCR3 对外周免疫系统功能有无不良影响。同时已有研究显示免疫抑制剂的使用会增加黑素瘤和非黑素瘤皮肤癌的风险,因而需要谨慎对待此类靶向药物,全面权衡患者可能的受益和风险,以此来确定其对白癜风治疗的临床实用价值[21-23]。
4 结语
尽管目前白癜风的发病机制研究不尽完善,但自身免疫在其中的主导作用是毋庸置疑的。目前已有很多研究证实了IFN-γ-CXCL9/10-CXCR3 信号轴在白癜风的发生发展起到关键的作用:IFN-γ 通过激活STAT1 促使靶细胞产生CXCL-9/10 等细胞因子来达到后续级联反应,CXCR3 作为CXCL-9/10 的共同配体,可诱导CXCR3+黑素细胞特异性T 淋巴细胞向表皮迁移,并发挥细胞毒性效应。因此观测此信号轴并对其关键作用环节进行特异性阻断,对白癜风的病情评估与治疗具有重要意义,为今后的研究提供了新的发展方向。

