基于功能化引物设计的荧光比色法检测牛肉品中鸭肉掺假成分
秦盼柱, 陆剑锋, 陈 伟
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
肉品掺假现象在世界范围内广泛存在。随着人们生活水平的提高,市场对牛肉等高价肉的需求量逐年增加,一些不法商家以次充好,用廉价肉冒充、掺假高价肉,谋取暴利。这类食品掺假行为不仅会给消费者造成经济损失,还会损害消费者健康,严重扰乱市场秩序,因此急需一种快速有效的检测手段。
目前的肉类掺假检测手段主要包括基于蛋白质的分析和基于DNA的分析两大类。早期的检测方法以蛋白质分析为主,包括质谱法[1]、电泳法[2]和酶联免疫吸附法[3]等,然而这些方法操作繁琐、过程复杂,而且易受加热等加工过程的影响,对于加工处理后产品的检测具有极大的局限性[4]。
与蛋白质不同,DNA具有高度的热稳定性,即使在经过高温高压处理之后依然可以进行检测,因此基于DNA的分析方法已成为食品成分鉴定的主要手段[5-7]。其中,聚合酶链式反应(polymerase chain reaction, PCR)技术由于其原理简单、操作方便和检测速度快等优点,在食品检测领域展现了极大的应用价值,并在此基础上发展出了多重PCR、RAPD-PCR和PCR-RFLP等方法[7-11]。然而这些方法通常需要复杂的PCR产物后处理和分析过程,因此增加了检测时间和检测成本。
荧光定量PCR技术检测速度快、灵敏度高、特异性好,能对目标物进行定量,已成为目前肉类掺假检测的主要手段[12-14]。然而,荧光定量PCR需要使用昂贵的仪器和特殊设计的水解探针,因此增加了检测的仪器和试剂成本,并对操作人员具有一定的要求。
本研究针对国内外肉类掺假研究现状,设计了一段两端分别被荧光基团和淬灭基团标记的发夹序列,通过使用一条5’末端标记了发夹序列的上游引物和一条未标记的普通下游引物,提出了一种检测牛肉中鸭肉成分的荧光比色方法。与现有方法相比,本方法灵敏度高,且不需要设计专门的水解探针,因此降低了检测成本,更适用于普遍检测的要求。
1 主要试剂与仪器
1.1 主要试剂
本试验所用肉样购于当地超市和菜市场。
PCR相关试剂(10×PCR buffer,MgCl2,dNTP 预混液,Taq DNA聚合酶)、5×TBE电泳缓冲液、10×PBS缓冲溶液、5×loading buffer、琼脂糖、DNA Marker和4S Red plus 核酸染料均购自上海生工生物工程股份有限公司。实验所用引物均为上海生工生物工程股份有限公司合成,详细引物序列见表1所列,表1中,BHQ1为淬灭基团;FAM为荧光基团。

表1 引物序列
1.2 主要仪器
FA1104B型分析天平(上海精天电子仪器有限公司);FRESCO 17型冷冻小型离心机(美国Thermo);NanoDrop 2000型超微量分光光度计(美国Thermo);S1000型热循环PCR仪(美国伯乐公司);DYY-6C型电泳仪(北京市六一仪器厂);LG 2080型凝胶成像分析仪(杭州朗基科学仪器有限公司);Varioscan Flash型全波长扫描酶标仪(赛默飞世尔科技有限公司)。
2 实验方法
2.1 样品制备
熟肉样品的制备。把新鲜的鸭肉和牛肉切成小块放入锅中,煮沸后维持1 h;把肉块取出并晾干水分,70 ℃烘干后机械研磨成粉末,-20 ℃保存。
纯肉匀浆的制备。精确称取2 g肉样粉末于离心管中,加入1×PBS混匀后补充至20 mL。
掺假肉样的制备。精确称取鸭肉和牛肉匀浆,得到鸭肉质量分数为30%、10%、5%、1%、0.5%、0.1%、0.05%、0.01%和0%的掺假牛肉样品。
2.2 DNA提取
实验所用DNA模板使用实验室自制的羧基修饰的磁性纳米粒子作为载体提取[15]。首先,称取50 mg匀浆至1.5 mL离心管中,加入700 μL 裂解液(0.5 mol/L Tris-HCl,0.5 mol/L NaCl,0.05 mol/L EDTA,2% SDS)和40 μL蛋白酶K(20 mg/mL)溶液,充分涡旋混匀,60 ℃水浴2 h。待离心管冷却至室温后,加入1/10体积的KAc溶液(3 mol/L,pH值为5.0),冰水浴5 min。12 000 r/min离心10 min,转移上清至新的1.5 mL离心管中,加入10 μL 羧基修饰的磁性纳米粒子,颠倒混匀后加入1/2体积的包被液(30% PEG,3 mol/L NaCl),室温静置5 min。磁性吸附,去上清,加入1 mL 70%乙醇洗涤2次,于37 ℃烘箱中烘干。加入100 μL TE分散磁珠,5 ℃水浴10 min,磁性吸附,取上清即为所提DNA,-20 ℃保存备用。以TE为空白,用超微量分光光度计对DNA的浓度和纯度进行检测,选取A260/A280在1.7~2.0之间的DNA用于进一步的检测。
2.3 荧光比色法检测鸭肉掺假
PCR反应体系(25 μL)为:1×PCR buffer,2.5 mmol/L MgCl2,0.2 mmol/L dNTP预混液,Taq DNA聚合酶1 U,上下游引物各0.08 μmol/L,DNA 模板1 μL,补水至25 μL。
扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。
电泳检测。取5 μL PCR产物,使用2%琼脂糖凝胶电泳进行表征。
荧光检测。使用全波长扫描酶标仪测量PCR产物在激发波长为492 nm时518 nm发射波长的荧光强度。
3 结果分析
3.1 检测原理
基于功能化引物的荧光比色法检测牛肉中鸭肉掺假的原理如图1所示。上游引物的5’末端标记了一段特殊设计的发夹序列,发夹序列两端分别标记了荧光基团FAM和淬灭基团BHQ1。当目标DNA不存在时,发夹序列自身形成互补结构,FAM和BHQ1相互靠近,FAM的荧光被BHQ1淬灭,因而检测不到荧光信号;当目标DNA存在时,在Taq DNA聚合酶的作用下,发夹结构被打开并成为双链PCR产物的一部分,此时FAM与BHQ1相互分离,荧光被释放出来,通过收集PCR产物的荧光信号即可对目标物进行检测。
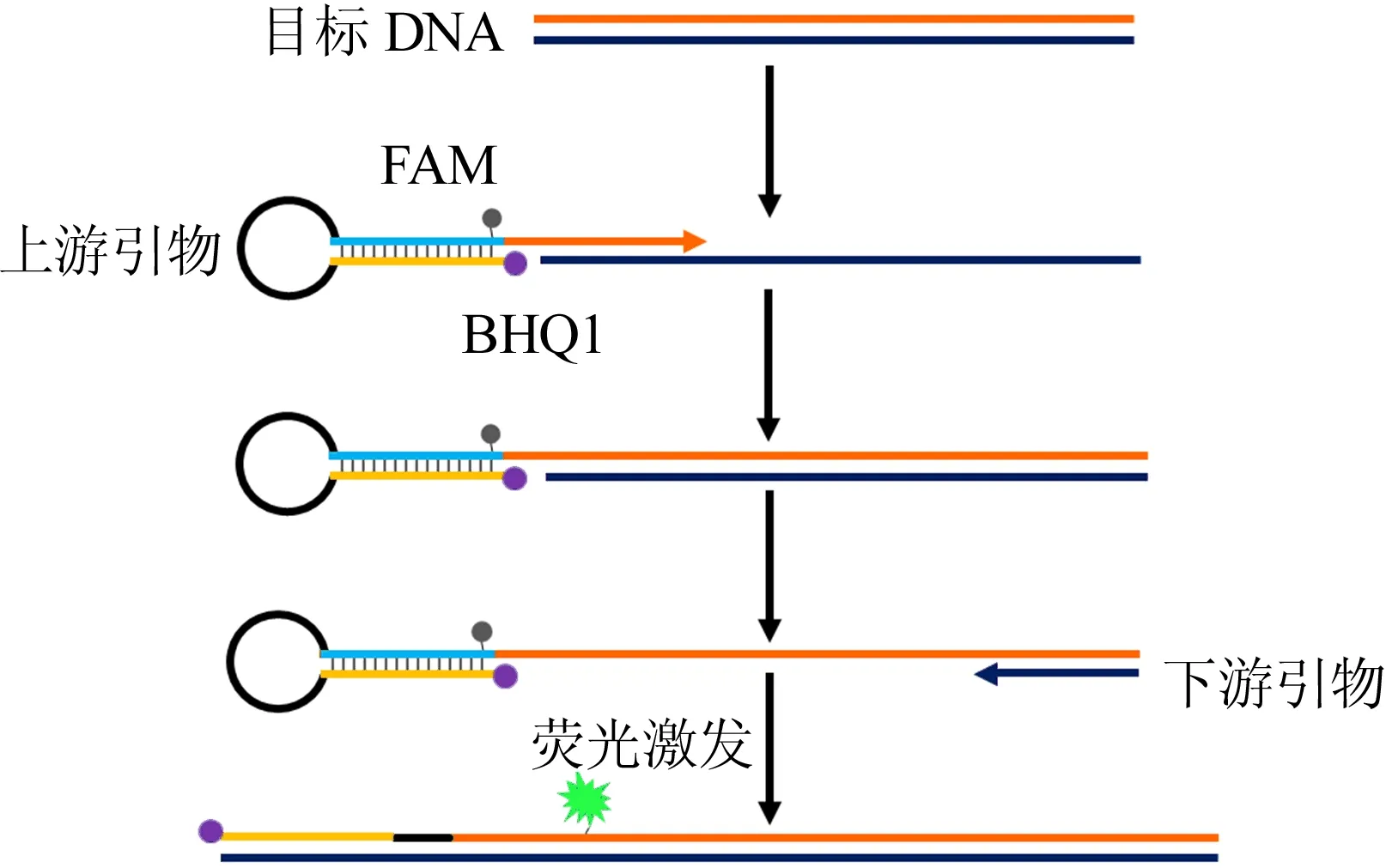
图1 检测原理图
3.2 可行性的验证
本文对提出的荧光比色方法的可行性进行了验证,结果如图2所示。图2中, M表示DNA Marker;1代表发夹序列功能化的引物(阳性);2代表发夹序列功能化的引物(阴性);3代表普通的引物(阳性);4代表普通的引物(阴性)。
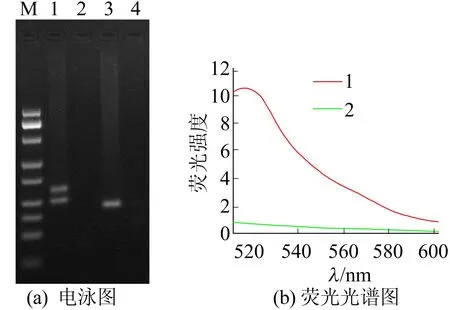
图2 可行性的验证
由图2a可知,对于发夹序列功能化的引物(泳道1)和普通的引物(泳道2),在目标DNA存在时都能很好地扩增。值得注意的是,泳道1的产物分子量要比泳道2的产物分子量大得多,这是由于引物末端发夹序列的存在增大了PCR产物的分子量。
本文分别测量了泳道1和泳道2在激发波为492 nm时的荧光光谱如图2b所示,由图2b可知,在没有目标DNA存在时几乎没有荧光,说明FAM的荧光被BHQ1淬灭;当目标DNA存在时,扩增产物出现很强的荧光信号,这是由于经过PCR过程,发夹序列被打开,荧光基团FAM和淬灭基团BHQ1相互分离,释放出荧光。所有结果都表明,使用本文设计的发夹序列标记的上游引物检测鸭肉成分,可以获得很好的扩增结果并产生明显的荧光信号变化。
3.3 条件的优化
在使用荧光比色法进行牛肉中鸭肉成分的鉴定之前,本文先对几个关键的条件进行了优化,并测量了PCR产物在518 nm处的荧光值,通过其信噪比的变化选择最佳实验条件。
退火温度是影响PCR效率的关键因素,不合适的退火温度很容易导致非特异性扩增或假阴性结果,因此,本文对退火温度进行了优化,结果如图3所示。由图3a可知,当退火温度较高时,信噪比很低,说明过高的退火温度不利于反应的进行;当退火温度降低到59.3 ℃时,信噪比开始增加,并在57.0 ℃时达到最佳;此时,继续增加退火温度,信噪比逐渐下降,这是由于较低的退火温度容易产生非特异性扩增,增加了背景荧光。综合考虑,选择57.0 ℃作为最佳的退火温度。
类似地,对Taq DNA聚合酶的量进行了优化。由图3b可知,当Taq DNA聚合酶的量较少时,信噪比很低;随着Taq DNA聚合酶的增加,信噪比逐渐变大,并在1.00 U时达到最大;此时,继续增加Taq DNA聚合酶的量,信噪比开始变小。因此,本文选择Taq DNA聚合酶的量为1.00 U。
荧光信号的产生依赖于发夹序列功能化的上游引物,为了保证最佳的检测效率,有必要对引物的浓度进行优化,结果如图3c所示。当引物浓度很低时,PCR效率很低,信噪比也很低;随着引物浓度的提高,信噪比逐渐变大,并在引物浓度为0.08 μmol/L时达到最大;此时,继续提高引物浓度,信噪比逐渐减小,这是由于引物浓度过高时背景信号也很高,从而导致信噪比降低。因此,选择最佳的引物浓度为0.08 μmol/L。
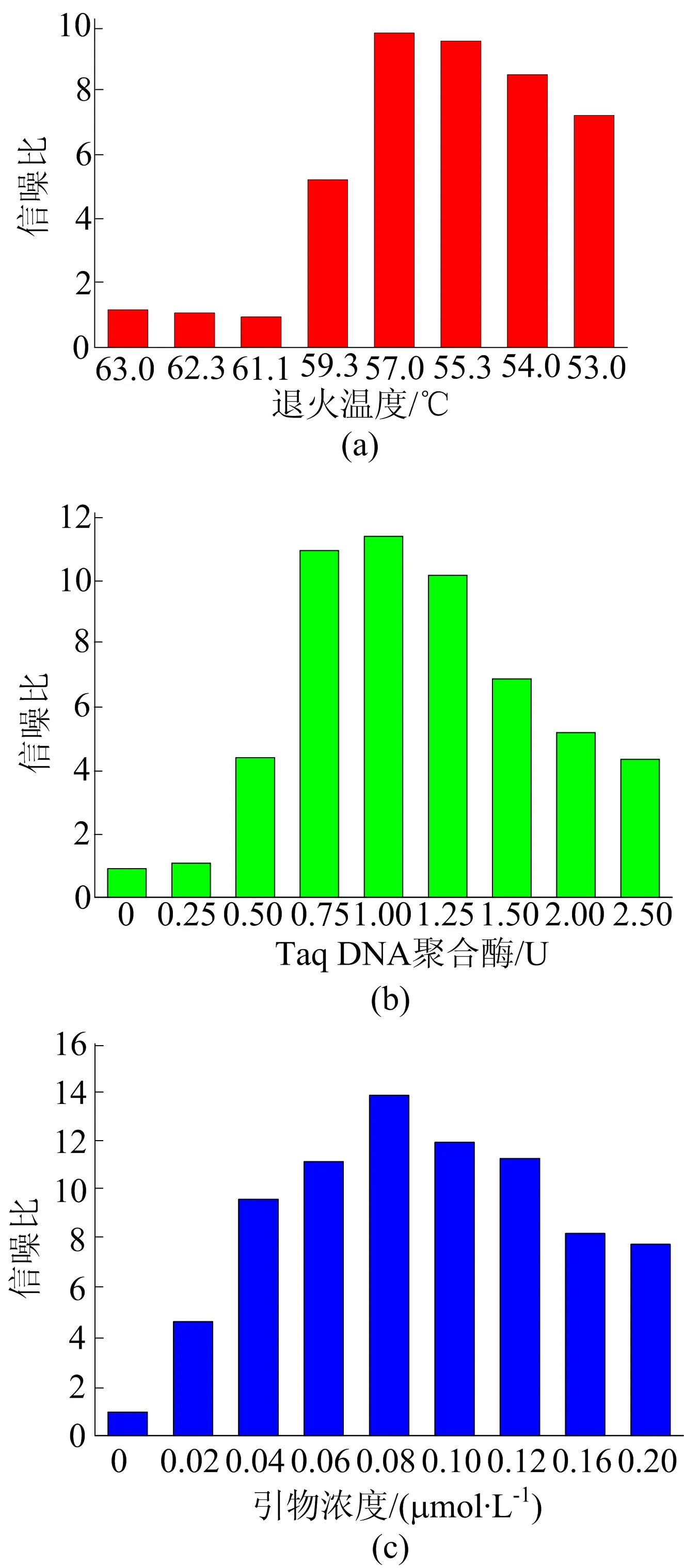
图3 条件的优化
3.4 灵敏度的检测
本文采取优化后的试验条件,使用本文建立的荧光比色方法对不同质量分数(100%、50%、10%、5%、1%、0.5%、0.1%、0.05%、0.01%、0%)鸭肉掺假的牛肉样品进行了检测。首先,通过琼脂糖凝胶电泳对PCR产物进行了表征,结果如图4a所示,由图4a可知,随着鸭肉质量分数的降低,条带亮度逐渐减弱,在质量分数为0.05%时完全消失,即琼脂糖凝胶电泳的检测灵敏度为0.1%。图4a中,M代表DNA Marker;1~10依次为100%、50%、10%、5%、1%、0.5%、0.1%、0.05%、0.01%和0%质量分数鸭肉掺假的牛肉样品;11代表空白对照。
本文测量了PCR产物在激发波为492 nm时的荧光光谱,结果如图4b所示,随着鸭肉质量分数的降低,PCR产物的荧光强度呈梯度下降,即使在鸭肉的质量比例为0.01%时仍有明显的荧光信号出现,说明本方法对鸭肉的检测具有较高的灵敏度。最后,本文以鸭肉的质量分数为横坐标,以PCR产物在518 nm处的荧光值为纵坐标绘制标准曲线,结果如图4c所示,在鸭肉的质量比例为0.01%~10%时,获得了良好的线性关系。
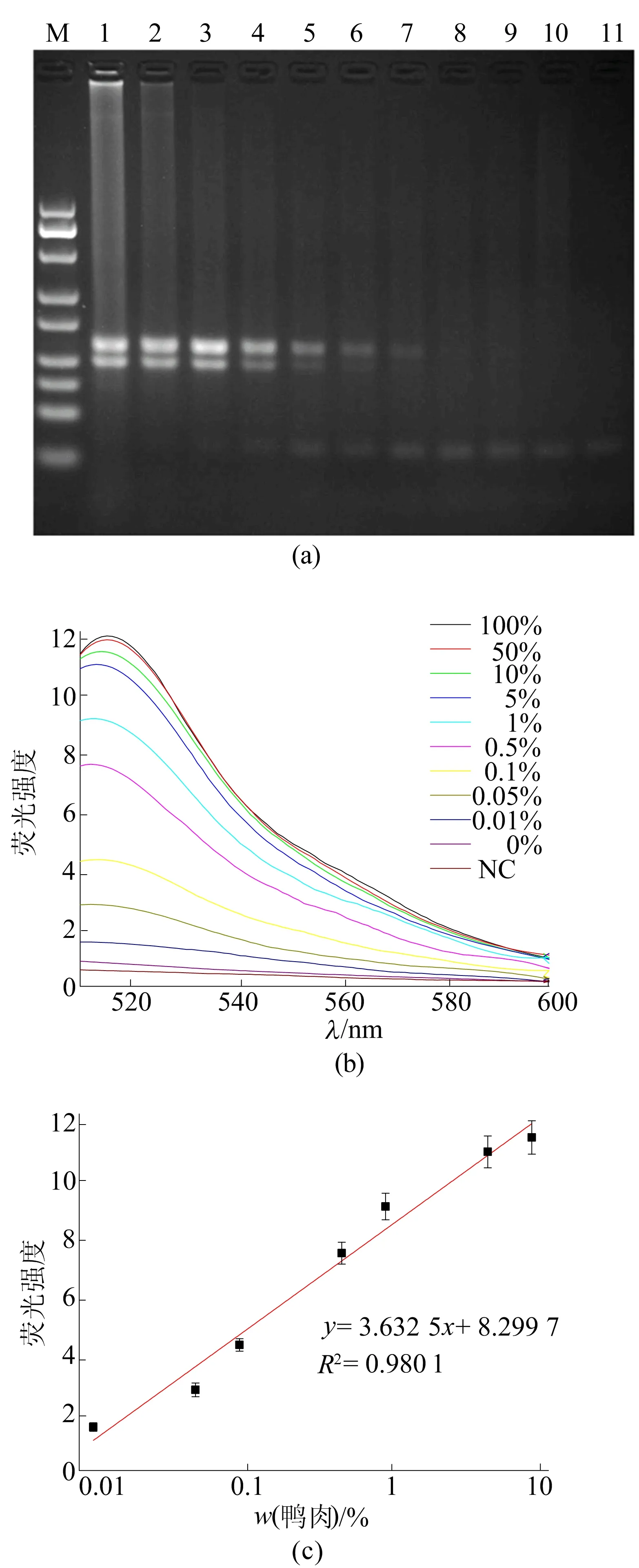
图4 灵敏度的检测
3.5 特异性的检测
为了验证本方法的特异性,本文提取了鸡肉、鸭肉、猪肉、牛肉、羊肉、马肉、大豆和水稻的DNA,以之为模板进行PCR扩增,并通过PCR产物荧光值的差异判断方法的特异性,如图5所示。由图5可知,对于8个物种的DNA,只有鸭肉DNA扩增的PCR产物能被检测到很强的荧光信号,而其他DNA扩增的产物只有很低的荧光背景,说明本方法对鸭肉的检测具有很好的特异性。
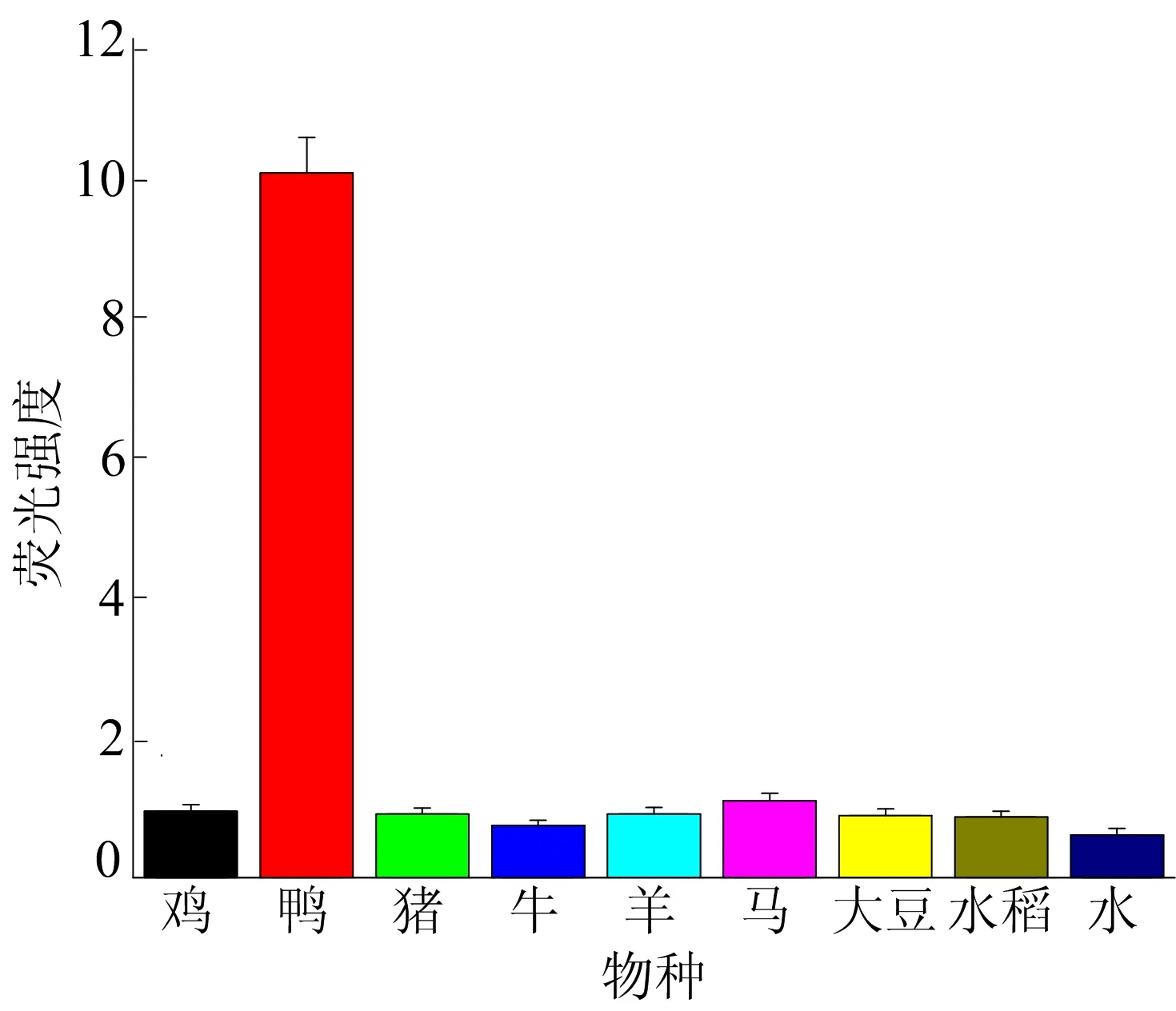
图5 特异性的检测
4 结 论
本文使用发夹序列功能化的上游引物和普通的下游引物,通过对退火温度、Taq DNA聚合酶的量和引物浓度等条件的优化,建立了一种检测牛肉中鸭肉成分的荧光比色方法。灵敏度的检测结果显示,琼脂糖凝胶电泳的检测灵敏度只有0.1%,而本方法在鸭肉的质量分数为0.01%时仍可以检测到明显的荧光信号,并且在鸭肉的质量分数为0.01%~10%时获得了良好的线性关系,特异性的检测结果显示,本方法具有良好的特异性。
本文提出的基于功能化引物设计的荧光比色方法避免了电泳和酶切等后处理分析过程,不需要设计专门的水解探针,只需要在普通引物的5’末端标记同样的发夹序列,即可实现对掺假成分的灵敏检测,相比于现有的检测方法,本方法更具优势。

