樱桃谷鸭PRKCA 基因多态性与蛋壳品质的关联性分析
谭光辉,张依裕,李杰章,覃媛钰,吴 磊
(贵州大学动物科学学院高原山地动物遗传育种与繁殖教育部重点实验室,贵州贵阳 550025)
蛋壳品质的提高一直是家禽生产中亟待解决的一个关键问题,高质量蛋壳不仅能够防止微生物的感染和机械破损,而且能够提高孵化率并解决运输中破损等问题。钙作为蛋壳不可或缺的营养因素,占蛋壳重量的40% 左右,钙沉积与蛋壳质量的好坏有直接联系。可见,钙在蛋壳形成的过程中非常重要。探究与Ca2+调控相关基因的多态性,进而通过选择培育来改善蛋壳品质是一个有效的途径。蛋白激酶Cα(Protein kinase C-alpha,PRKCA)是一类丝氨酸和苏氨酸特异性蛋白激酶,可被钙和第二信使二酰基甘油激活,属于蛋白激酶C(Protein kinase C,PKC)家族成员之一,其家族成员磷酸化多种蛋白靶点,参与多种信号通路的调控机制,包括钙离子信号通路调控[1-4]。近年来,众多关于人PRKCA基因生物功能的研究表明,PRKCA基因控制细胞内钙离子浓度,与肿瘤增殖、侵袭、药物抵抗性密切相关,在肿瘤的发生发展过程中发挥重要作用[5-6]。另外,蛋白激酶Cα在上皮组织中起着重要的作用,并且能够通过对Ca2+进行调控促进细胞的存活与增殖[7-8]。相反,在三阴性乳腺癌(Triple negative breast cancer,TNBC)细胞中,Ca2+能够介导PRKCA的活化来诱导细胞凋亡和抑制细胞的迁移[9-10]。因此,PRKCA基因与Ca2+能够通过相互调节来调控细胞的增殖与凋亡。此外,PRKCA基因在动物机体中也发挥重要作用,Pan 等[11]研究显示骨骼PRKCA基因表达增加可促进鸡骨骼钙素的沉积;Monteverde 等[12]研究发现利用小鼠胚胎成纤细胞(mef)致癌转化时,Ca2+信号调节能促进PRKCA海拉细胞的激活。当小鼠PRKCA基因敲除后,心肌细胞收缩能力发生改变,进一步研究揭示PRKCA基因可能是心肌细胞收缩力和Ca2+处理的基本调控因子[13]。综合前人研究可见,PRKCA基因在Ca2+的转运调控中有重要作用,因此PRKCA基因可能调控鸭蛋壳腺部位Ca2+的释放或调控相关组织细胞的增殖与凋亡,对蛋壳品质产生影响,但迄今为止,有关PRKCA基因在鸭上的生物功能研究尚未见相关报道。基于此,本实验以樱桃谷鸭为研究素材,检测PRKCA基因的遗传变异,探讨基因变异对鸭蛋壳品质的影响,旨在为提高鸭蛋壳品质提供科学依据。
1 材料与方法
1.1 实验材料 于贵州大学动物科学学院家禽研究所随机选择同一天孵化、健康无病樱桃谷鸭200 只,在相同的自由放养的环境长大,直到10 周龄时进行单体笼饲养,并且每只鸭静脉采血1~1.5 mL 用于鸭基因组DNA的提取。在45 周龄时,每只母鸭连续7 d 收集鸭蛋以测定蛋壳质量。鸭蛋重、蛋壳重、蛋壳强度和蛋壳厚度在收集鸡蛋后12 h 内测量。
1.2 蛋壳品质的测量 蛋重和蛋壳重:洗净鸭蛋上鸭粪等污染物后用电子天平(型号为BL-320H,购自日本岛津公司)称量;去除蛋黄和里面残留蛋液称量蛋壳重量。
蛋形指数:游标卡尺(购自武汉道简贸易有限公司)测量鸭蛋的长径和短径,精确到0.1 mm,蛋形指数等于长径/短径。
蛋壳厚度:蛋壳厚度测定仪(型号ETG-1061,购自北京天翔飞域仪器设备有限公司)分别测定锐端、钝端和侧面的蛋壳厚度,取3 个值的平均数得到蛋壳厚度,精确度0.01 mm。
蛋壳强度:蛋壳强度是蛋壳致密坚固性指标,指对蛋碰撞和挤压的承受能力。用蛋壳强度测定仪(型号为EFR-01,购自北京天翔飞域仪器设备有限公司)测定,单位为N/cm2。
1.3 血液基因DNA 的提取、引物设计 根据血液DNA提取试剂盒(购于天根生化科技有限公司)抽提血液中基因组DNA,琼脂糖凝胶电泳结合核酸浓度测定仪进行检测,并用Nanodrop 2000 检测提取DNA 的纯度和浓度,最终稀释成浓度100 ng/μL 备用。在Genbank数据库调取鸭PRKCA基因组外显子序列(登录号:NC_040064.1)运用在线版 Primer 3.0(http://primer3.ut.ee/)设计引物见表1,交由生工生物工程(上海)股份有限公司合成。
1.4 PCR 扩增程序 反应体系:PCR Master Mix 10.0 μL,RNase-Free Water 7.5 μL,10 pmol/L 正、反向引物各1.0 μL,模板DNA 0.5 μL。PCR 扩增程序:95℃预变性6 min;94℃变性30 s,退火(温度见表1)50 s,72℃延伸45 s,共35 个循环;72℃延伸5 min,10℃保存。以个体DNA为模板进行扩增,采用1.5%琼脂糖凝胶电泳检测PCR产物,检测有目的条带的产物送生工生物工程(上海)股份有限公司进行测序。
1.5 统计分析 测序结果采用DNA Star 软件中MegAlign程序筛查鉴定SNP 位点,运用SHEsis 网上在线软件(http://analysis.bio-x.cn/)计算SNP 位点的基因型频率、等位基因频率、单倍型频率、基因型分布卡方值(χ2)、连锁不平衡的D'值和γ2值、观察杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC);采用SPSS18.0 软件中的一般线性模型(GLM)分析SNP 位点基因型或双倍型与所测定性状指标的相关性,结果用平均值±标准误表示。
2 结果与分析
2.1PRKCA基因PCR 扩增 如图1 显示,经过PCR 扩增所获得的目的片段呈现单一、明亮的条带,且PCR扩增产物与预设片段大小相符,扩增产物可用于下一步的实验研究。

表1 鸭PRKCA 基因的引物信息
2.2 樱桃谷鸭PRKCA基因SNPs 筛查与鉴定 PCR 产物进行直接测序,利用DNAStar 软件和MegAlign 程序分析测序结果,将PRKCA基因原始序列和全部樱桃谷鸭引物扩增序列进行比对,查找单核苷酸多态位点,结果见图2,共发现2 个SNP 变异位点:分别是g.9583222C>T 和g.9583228G>A,都位于PRKCA基因第7 外显子,分别位于基因CDS 区第723 位和729 位,2 个突变位点均产生3 种基因型。
2.3 樱桃谷鸭PRKCA基因2 个SNPs 的遗传特性分析 对2 个SNP 进行遗传特性分析,结果见表2,g.9583222C>T 和g.9583228G>A 2 个位点的优势基因型分别为CC 和GG,频率分别为0.510 和0.385;优势等位基因分别是C 和G,频率分别是0.675 和0.563;2 个SNP 位点均属于中度多态(0.25<PIC<0.5),经χ2检验2 个SNP 位点的等位基因都极显著偏离Hardy-Weinberg 平衡(P<0.01)。
2.4 SNPs 连锁不平衡、单倍型和双倍型分析 对樱桃谷鸭检测的2 个SNP 位点g.9583222 C>T 和g.9583228 G>A 进行连锁不平衡分析,结果2 个SNP 位点之间的D'值等于1,大于0.800;γ2值等于0.385,大于0.330。根 据Ardlie 等[14]和Slatkin[15]的 报 道,当|D'|>0.8 和γ2>0.33 时认为SNPs 位点间存在强连锁不平衡。揭示了本研究发现的2 个SNP 位点间存在强连锁不平衡。
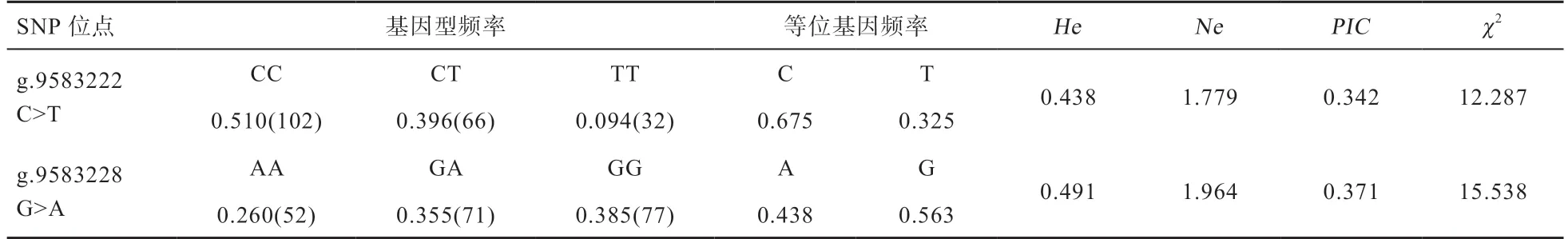
表2 樱桃谷鸭PRKCA 基因SNP 位点群体遗传参数
对2 个SNP 进行单倍型和双倍型分析,结果见表3。2 个SNP 位点在樱桃谷鸭群体中共检测到3 种单倍型和6 种双倍型,单倍型H1 的频率(0.513)最高,为优势单倍型;H3 的频率(0.163)为劣势单倍型;双倍型H1H1 频率(0.335)最高,为优势双倍型,H3H3 的频率(0.050)最低,为劣势双倍型。

表3 樱桃谷鸭PRKCA 基因2 个SNP 位点的单倍型和双倍型分析
2.5 樱桃谷鸭PRKCA基因2 个SNPs 与蛋壳品质的关联性分析 如表4 所示,g.9583222 C>T 突变位点与蛋壳强度有显著相关性,CT 基因型个体蛋壳强度显著高于TT 型,其他基因型无显著差异;g.9583228G>A 位点对樱桃谷鸭蛋壳品质指标的影响未能达到显著水平。
2.6 SNPs 双倍型与樱桃谷鸭蛋壳品质指标的关联性分析如表5 所示,双倍型H1H3 和H2H2 个体蛋重显著高于H3H3;H2H3、H3H3 双倍型个体蛋壳厚度显著高于H2H2;H3H3 蛋壳强度显著高于H2H2。其他双倍型与蛋壳品质没有产生显著差异。
3 讨 论
蛋壳质量是影响禽蛋生产效益的重要因素之一,尤其在大型养殖场,蛋壳品质极为重要。标记辅助选育是一种有效而简便的可行办法,找到性状基因座相关联的分子遗传标记,则是实现分子标记辅助选择的重要途径。Haug 等[16]研究发现,PRKCA基因需要甘油二酯(DAG)和磷脂酰丝氨酸(PS)和Ca2+辅因子的激活。PRKCA还能通过促进白三烯D4 升高细胞内Ca2+浓度从而激活丝裂原活化蛋白激酶(MAPK)[17]。另外,PRKCA 激活剂在不同Ca2+下增加了渗透性动脉的收缩程度,而动脉收缩需要通过依赖性Ca2+流入,证明PRKCA诱导大鼠动脉收缩与Ca2+的降低有关[18]。目前,关于PRKCA基因遗传变异对于鸭生产性能的效应研究未见报道。本实验对樱桃谷鸭PRKCA基因外显子1、外显子4 和外显子7 进行SNP 位点检测中,发现2 个同义突变位点,2 个SNP 位点的基因型分布均偏离Hardy-Weinberg 平衡。Hardy-Weinberg 平衡定律是一个基本的群体遗传学原理,该定律建立在许多假设的基础上,包括随机交配的有性繁殖、世代不重叠、可忽略的突变和迁移率、两性等位基因频率的平等、缺乏自然选择,同时,在任何有限的群体中,基因在配子中的随机分离和在合子里的随机重组都会导致一定的误差,引起基因频率的变化[19]。因此,从本研究结果来看,2 个SNP 基因型分布均偏离Hardy-Weinberg 平衡,可能受到突变、选择、遗传漂变等影响,或者与本实验樱桃谷鸭群体数量较少有关。
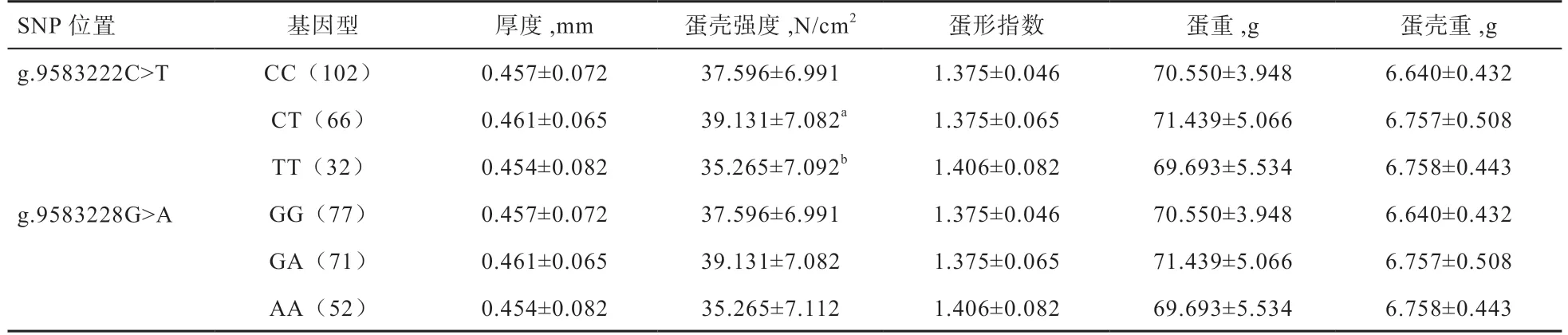
表4 樱桃谷鸭PRKCA 基因SNP 位点与蛋壳品质的关联性分析
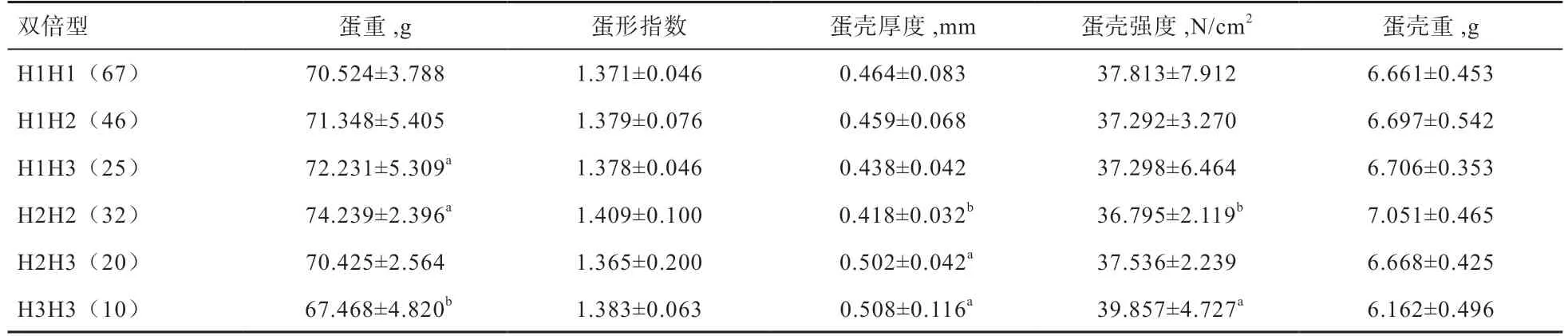
表5 PRKCA 基因2 个SNPs 位点双倍型与樱桃谷鸭蛋壳品质关联性分析
动物体基因组功能结构基因突变对其生产性能具有影响作用,其突变位点的连锁关系决定群体遗传结构的变化。本实验通过对2 个SNP 进行连锁不平衡分析,发现SNP 间不存在强连锁不平衡,发现3 种单倍型和6种双倍型。理论上应该有4 种单倍型、9 种双倍型,实际观测值与理论值之间存在差异,可能是由于人工的长期选育导致单倍型(CG)和双倍型TTGA、TTGG 和CTGG 个体被淘汰或者根本不存在该单倍型组合。本研究中,g.9583222C>T 位点CT 基因型蛋壳强度显著高于TT 基因型,该突变位点可以作为筛选较高蛋壳强度的分子标记。这种突变可能与PRKCA基因的功能等位基因有关,影响鸭子宫内Ca2+的沉积。2 个SNP 位点构建的双倍型对蛋重、蛋壳强度和蛋壳厚度有显著影响。双倍型H3H3 有利于提高蛋壳强度和蛋壳厚度。蛋壳强度是蛋壳破损率最直接的体现,高强度蛋壳有利于降低蛋的破损,带来可观的经济效益,因此H3H3 是提高蛋壳品质有利的双倍型。可见2 个SNP 组合基因型对蛋壳品质的影响效应明显大于单个SNP 的影响。前人研究表明,同义突变虽然不会造成对应氨基酸的改变,但可能会反复改变调控剪接的外显子基序,如果这些突变位点与剪接位点相邻可能导致剪接位点失活[20],而且单核苷酸的替换会改变mRNA 的剪切效率或准确性,对蛋白质的功能、构象和表达水平产生影响,进而调控机体钙离子释放,影响钙蛋壳的形成过程[21-23]。由此推测,本研究检测到的2 个SNP 共同联合引起基因结构变化强于单个SNP 对基因结构变化的影响,其对蛋壳品质的调控作用可能更有效。但在双倍型与蛋壳品质的关联分析中,双倍型H3H3 个体数还是相对较少,因此,统计分析结果还需要进一步增加测试样本,进一步确定本研究的结果。
4 结 论
本研究结果显示,鸭PRKCA基因在所研究群体中存在一定的遗传多样性,在其外显子7 发现2 个突变位点g.9583228 G > A 和g.9583222 C > T。关联性分析表明,单个SNP 位点(g.9583222C>T)与樱桃谷鸭蛋壳品质有显著相关性,其中CT 基因型能显著提高蛋壳强度。2 个SNP 位点组合基因型与蛋壳品质有显著相关性,组合基因型CCAA 认为是提高蛋壳品质有利的组合基因型。

