一株高效解磷菌的筛选及其解磷效果验证
唐岷宸 李文静 宋天顺 谢婧婧
(南京工业大学生物与制药工程学院,南京 211816)
土壤中磷元素的存在主要表现为两种形式,无机磷和有机磷,且无机磷含量较多[1],其可以被植物直接吸收利用,而有机磷则需要通过转化才能被吸收,植物生长代谢都离不开磷元素。可溶性磷肥被施于土壤中时,一般当季利用率在10%-25%左右[2],残余的磷元素在酸性土壤中,易被土壤中存在的Fe、Al元素螯合固定形成不溶于水的Fe-P、Al-P;而在碱性土壤中,土壤中的Ca、Mg元素也可以螯合磷,形成不溶于水的Ca-P、Mg-P,使植物难以吸收利用[3-4]。解磷微生物的作用,就是将土壤中被固定的磷酸盐通过溶解释放,以利于植物的吸收,此外其还可以分泌一些植物生长激素,促进植物生长代谢。
随着现代化农业的发展,许多生产者追求产量,盲目施用化肥,且多重氮轻磷少钾,长期施用化肥会导致土壤板结退化、微生态破坏、保水力下降等环境问题和农产品品质下降,硝酸盐含量高等食品问题,而微生物能够通过自身在植物根际土壤中的生长代谢来改善土壤环境,促进农作物生长,所以将包含解磷微生物的菌肥向土壤中播撒,是土壤磷元素转化的一个安全环保高效的方式,不仅能够促进植物生长发育,还能够帮植物逐渐适应酸化、碱化及缺磷土壤等不良环境[5-7]。解磷菌肥是现代农业所需的安全、可持续发展的新型高效肥料。因此,筛选新型高效解磷菌株,拓展解磷菌的种类,以进一步提高菌肥的作用,帮助农作物在不良环境中生存,成为解决我国缺磷问题的一条有效途径。
本研究采用无机磷筛选培养基,从农田土壤中筛选出新型高效解磷菌株,定量分析其解磷能力,初步探究其解磷机理,并通过黑叶葵扇白菜盆栽试验,评估筛选得到的解磷菌对农作物的促生作用。
1 材料与方法
1.1 材料
筛选培养基(g/L):Glucose 10.0 g,KCl 1.7 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,Ca3(PO4)25.0 g,FeCl30.005 g,CaCO30.1 g,pH 7.5-8.0。
种子液培养基(g/L):Glucose 5.0 g,K2HPO4·3H2O 2.0 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,FeCl30.005 g,CaCO30.1 g。
LB培养基(g/L):Peptone10.0 g,NaCl 10.0 g,Yeast Extract 5.0 g。
1.2 方法
1.2.1 解磷菌株的分离筛选 土壤样品取样点为安徽省马鞍山市农田地区。称取5 g新鲜土样,加入250 mL锥形瓶中(含100 mL无菌水)20℃,160 r/min振荡1 h,取10 mL菌悬液于灭菌的试管中,用无菌水进行梯度稀释,稀释至10-6。取各梯度土壤悬液0.2 mL,涂布于固体筛选培养基平板上。将平板放入20℃恒温培养箱培养96 h后,挑取平板上外观不同,且有较大溶磷圈的单菌落X-P4、X-P9、X-P18和X-P27,进行纯化划线,划线4-5次后将其接入LB液体培养基中,待其OD600值为0.6-0.8时进行甘油保菌,暂存于-20℃冰箱中。
将X-P4、X-P9、X-P18和X-P27甘油菌于种子液培养基中活化,测定其生长曲线,待菌株生长至对数生长期时,按2%的接种量(菌液离心去上清液,用等量无菌水重悬)接种于解磷菌筛选培养基中,30℃恒温培养48 h后,在0、24和48 h取样,将溶液10 000 r/min离心15 min,通过测定上清液中可溶性磷含量,选取解磷效果最优的菌株。
1.2.2 菌株鉴定
1.2.2.1 形态学鉴定分析 在LB固体培养基上,将筛选出的菌株30℃培养24 h,观察其外观形态。参照《伯杰细菌鉴定手册》[8-9]对菌株进行生理生化检验。
1.2.2.2 16S rDNA测序及分析 采用试剂盒(TaKaRa细菌基因组提取试剂盒)提取菌株的DNA并进行纯化扩增,PCR产物由苏州金唯智公司进行测序。
1.2.3 解磷菌发酵培养条件优化
1.2.3.1 最适培养条件优化 设置筛选培养基中种子液接种量为1%、2%、3%、4%和5%(菌液浓度为108-109CFU/mL)[10],摇床温度为30℃,转速为160 r/min,培养48 h,测定培养后溶液中磷含量,以确定最优接种量。
使用最优接种量,其他条件保持不变,灭菌后利用无菌酸碱溶液调节培养基初始pH值为5.0、6.0、7.0、8.0和9.0,以确定最优pH值。
使用最优接种量与pH值,其他条件保持不变,设置摇床温度为20、25、30、35和40℃,以确定最优溶磷温度。
1.2.3.2 碳、氮源优化 以等质量(0.5 g/L)的硫酸铵、氯化铵、尿素、蛋白胨和牛肉膏5种氮源替换解磷筛选培养基中的氮源,以确定最优氮源;使用最优氮源,以等质量(10.0 g/L)的葡萄糖、蔗糖、果糖、甘露糖和半乳糖5种碳源替换磷筛选培养基中的碳源,以确定最优碳源。
1.2.4 解磷菌分泌有机酸分析 将菌株按方法1.2.1接入筛选培养基中,在30℃,160 r/min摇床中培养48 h。将培养好的溶液10 000 r/min离心15 min,吸取1.0 mL上清液,用0.22 μm水系滤膜过滤,将滤液进行液相色谱分析。
1.2.5 黑叶葵扇白菜盆栽试验 将保存的解磷菌接种于15 mL种子液培养基中,培养12 h。按1%的接种量在种子液培养基中扩大培养,30℃培养7 h后得菌液。将菌液6 000 r/min离心15 min后用无菌水重复离心冲洗2次。然后用无菌水稀释得到的菌体,使菌液中菌体数量为108CFU/mL。
去除表层土壤,取用耕层3-30 cm的土壤(pH 6.76,有效磷6.9 mg/kg,速效钾56.3 mg/kg碱解氮86.1 mg/kg,有机质17.4 mg/kg),将土壤风干砸碎至合适大小后,填入花盆中(口径140 mm,高115 mm),每盆装入土壤650 g,共12盆。将12盆盆栽随机分成4组:处理1(CK),施用氮肥+钾肥+Ca3(PO4)2;处理2(P1),施用氮肥+钾肥+Ca3(PO4)2+ 解磷菌剂 2×109CFU/盆;处理 3(P2),施用氮肥+钾肥+Ca3(PO4)2+解磷菌剂4×109CFU/盆;处理 4(P3),施用氮肥 + 钾肥 +Ca3(PO4)2+解磷菌剂6×109CFU/盆。所用氮肥为尿素(用量为 320.0 mg/kg),钾肥选用氯化钾(277.0 mg/kg),磷肥选用 Ca3(PO4)2(用量为 1 500.0 mg/kg)。土壤与肥料混合均匀后装盆,适当浇水,向每盆中播撒大小相似的白菜种子6颗,待4 d发芽后间苗至2颗,待其过两叶期(10 d)后,再向苗根部播撒菌液。黑叶葵扇白菜生长周期为30 d,待其生长成熟后测定小白菜的理化性质。
1.2.6 测定与数据分析 筛选培养基溶液中有效磷含量通过钼锑抗比色法[11]测定。
采用试剂盒(TaKaRa细菌基因组提取试剂盒)提取菌株的DNA并进行纯化扩增,用0.8%的琼脂糖凝胶电泳对扩增的DNA进行纯度和浓度检测[12]。PCR产物由苏州金唯智有限公司完成测序和序列分析。通过GenBank的核酸数据库序列与Blast程序进行联配,用测出的16S rDNA基因序列在NCBI[13]上进行Blast比对,搜索相关性序列同所测序列用MEGA 7.0软件构建系统发育树进行分析。
测定IAA含量液相条件[14-16]:色谱柱采用ZORBAX SB-Aq(5 μm,250 mm×4.6 mm), 柱 温37℃,流动相采用98%盐溶液和甲醇,流速1.0 mL/min,检测波长210 nm,进样量20 μL。流动相使用前将其用0.22 μm孔径的滤膜进行过滤。
小白菜处理:生长30 d后,先收割小白菜的地上部,然后收割小白菜,将小白菜上泥点洗净,测定株高与鲜重,再放入烘干箱105℃杀青30 min,80℃烘干至恒重,磨碎后放入自封袋中备用,通过H2SO4-H2O2消煮法[17]处理小白菜叶片,然后通过钼锑抗比色法[11]测定叶片磷含量。
用Prism5.0软件进行统计分析及差异显著性检验,然后用origin 8.5作图。
2 结果
2.1 高效解磷菌的筛选与鉴定
2.1.1 高效解磷菌的筛选 在含有Ca3(PO4)2的固体平板上,解磷菌株周围能形成一圈透明圈(图1-A),根据透明圈直径大小可以初步判断解磷菌菌株解磷能力的强弱。因此,本研究从固体平板上选出4株具有较大溶磷圈的菌株(命名为X-P4、X-P9、X-P18和X-P27)。通过对初筛得到的4株解磷菌进行解磷能力的测定,48 h后与空白对照组相比,解磷能力分别达到了331.1 mg/L、323.7 mg/L、495.4mg/L和166.8 mg/L(图1-B)。研究发现相较于其他3株菌,X-P18菌株的解磷能力最强,故选取X-P18菌株作为后续研究对象。
2.1.2 高效解磷菌的鉴定
2.1.2.1 X-P18菌株的形态学和生理生化特征 从土壤中分离筛选得到1株高效解磷菌株X-P18,将其接种于LB固体培养基上培养后,观察发现其菌落呈圆形、乳白色、表面光滑、边缘整齐、黏稠、中间凸起、不透明。从表1可知,该菌株温度生长范围在15-50℃,pH范围在4.5-11.0,能够消耗甘露醇、木糖、纤维二糖、麦芽糖和乳糖产酸,使得pH呈酸性,还能够产吲哚乙酸(Indole-3-acetic acid,IAA),发酵24 h后X-P18菌株产生IAA的浓度为11.7 mg/L。而吲哚乙酸是生产调节植物生长素的信号物质,大多集中在植物生长旺盛的部位,通过不同信号传导途径激发生理效应,促进植物的生长发育,说明X-P18具有一定的促植物生长作用。
通过生理生化分析发现,X-P18菌株能够产IAA、耐高的pH、适宜生长温度范围广的特性,为它真正能够作为微生物肥料应用于不同环境的土壤增添优势。
2.1.2.2 X-P18菌株的16S rDNA序列测定 采用通用引物(27F与1492R)对解磷菌X-P18的基因组DNA进行PCR反应得到988 bp大小的扩增片段,通过纯化测序,并在GenBank中进行比对、使用MEGA 7.0构建系统发育树(图2)比对发现,X-P18菌株与Bacillusvelezensis达到98%同源。根据菌株形态和生理生化特征,所以初步确定其贝莱斯芽孢杆菌(Bacillusvelezensis)。
2.2 解磷发酵培养条件优化
2.2.1 不同接种量对X-P18菌株溶磷效果的影响 本试验设置1%、2%、3%、4%和5%这5个接种量,研究接种量对解磷效果的影响。结果如图3所示,对于不同接种量,X-P18菌株溶磷效果相差不大,接种量为1%和5%时,溶液中可溶性磷含量最高,分别为501.3 mg/L和491.7 mg/L,推测接种适量的菌液于培养基中虽然能够缩短生长周期,充分使用养分,但是菌株生长繁殖时产生的一些对菌株生长抑制作用的物质会抑制菌株生长代谢,所以菌株初始接种量与溶液中磷含量的增加无必然联系。所以选择1%的接种量为最优接种量。
2.2.2 不同初始pH对X-P18菌株溶磷效果的影响 培养基选择合适的初始pH值有利于菌的生长与所需代谢产物的合成。本试验设置培养基初始pH值为5.0、6.0、7.0、8.0和9.0。由图4可知,不同的初始pH值下X-P18菌株都能够分解磷酸三钙,当菌株在pH 5.0、6.0和8.0时,溶液中有效磷含量较高。但由于pH为 5.0、6.0的空白培养基中可溶性磷含量增加量较多,推测当培养基用稀酸调节pH值为5.0、6.0时,稀酸能够帮助溶解磷酸三钙,增加了溶液中的磷含量,给菌株创造了一个适宜的生长环境,利于菌株生长代谢,而当pH为8.0时,基本不需要添加酸碱液调节,更趋近于菌株原始生长环境,且溶液中磷含量达到最高,为518.0 mg/L。因此X-P18菌株最优初始pH为8.0。
2.2.3 不同氮源对溶磷效果的影响 将X-P18菌株接种于含有等质量不同氮源的培养基中,探究氮源对X-P18菌株解磷能力的影响。如图5所示,X-P18菌株以硫酸铵为氮源时,溶液中有效磷含量最高,为550.9 mg/L,而以尿素为氮源时,有效磷含量最低,未达硫酸铵的1/10。因此,硫酸铵为X-P18菌株的最优氮源。
2.2.4 不同碳源X-P18菌株对溶磷效果的影响 将X-P18菌株接种于含有等质量不同碳源的培养基中,碳源分别为葡萄糖、蔗糖、果糖、甘露糖、半乳糖时,探究碳源对X-P18菌株解磷能力的影响。图6可以看出以甘露糖为碳源时,有效磷含量为591.8 mg/L,而以半乳糖为碳源时,溶液中有效磷含量仅为甘露糖的1/2。表明该菌株能够在甘露糖为碳源的环境下,更有效地溶解磷酸三钙,因此甘露糖为X-P18菌株的最优碳源。
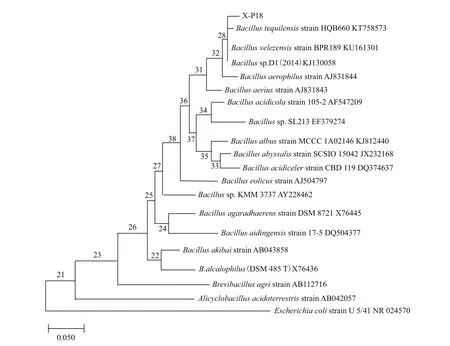
图2 X-P18菌株的系统发育树
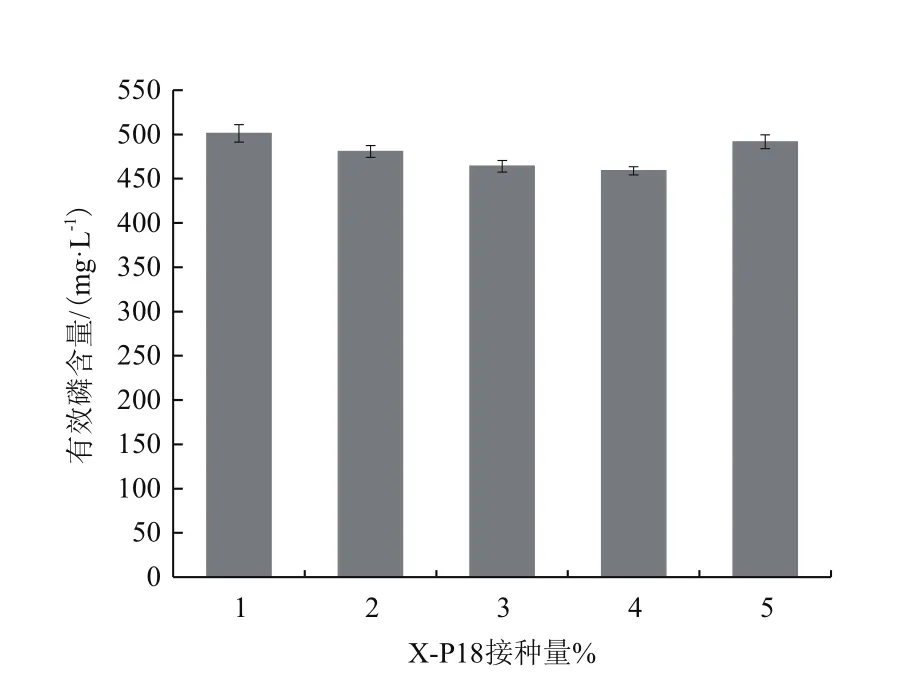
图3 不同接种量对X-P18菌株溶磷能力的影响
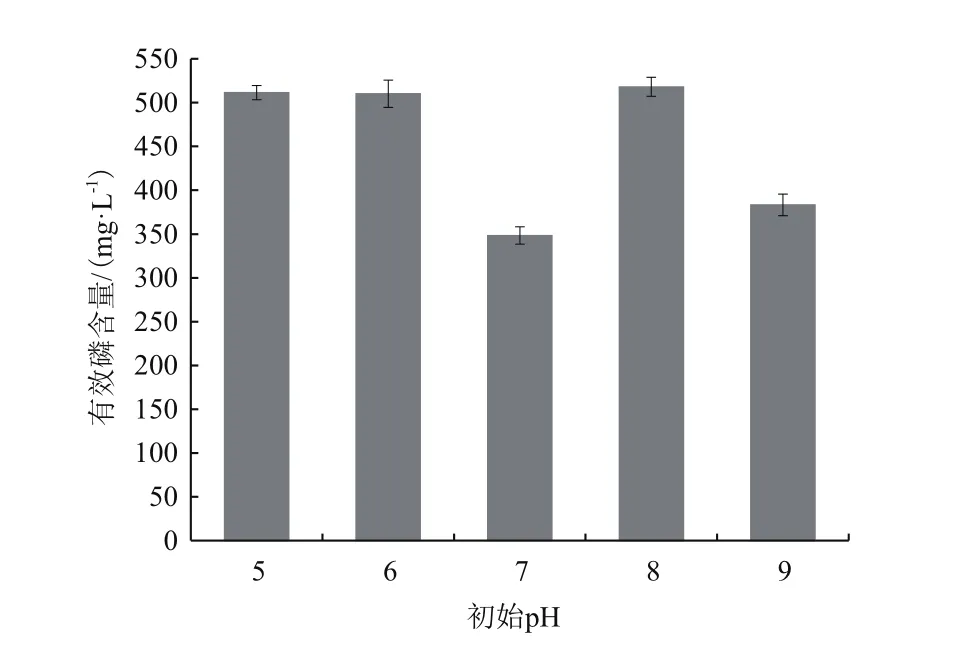
图4 不同pH对X-P18菌株溶磷能力的影响
2.2.5 不同温度对X-P18菌株溶磷效果的影响 温度能够影响微生物体内进行的许多生化反应,从而影响微生物的代谢活动。本试验设置5个温度梯度:20、25、30、35和40℃,研究温度对菌株解磷能力的影响,如图7所示,X-P18菌株在20-30℃有效磷含量相近,在30℃时最高,为582.4 mg/L。因此,确定该菌株最优溶磷温度区间为20-30℃。
2.3 X-P18菌株发酵液中有机酸分析
由图8可知,通过液相色谱分析发现X-P18菌株在发酵过程中产生多种小分子有机酸,且在3.9
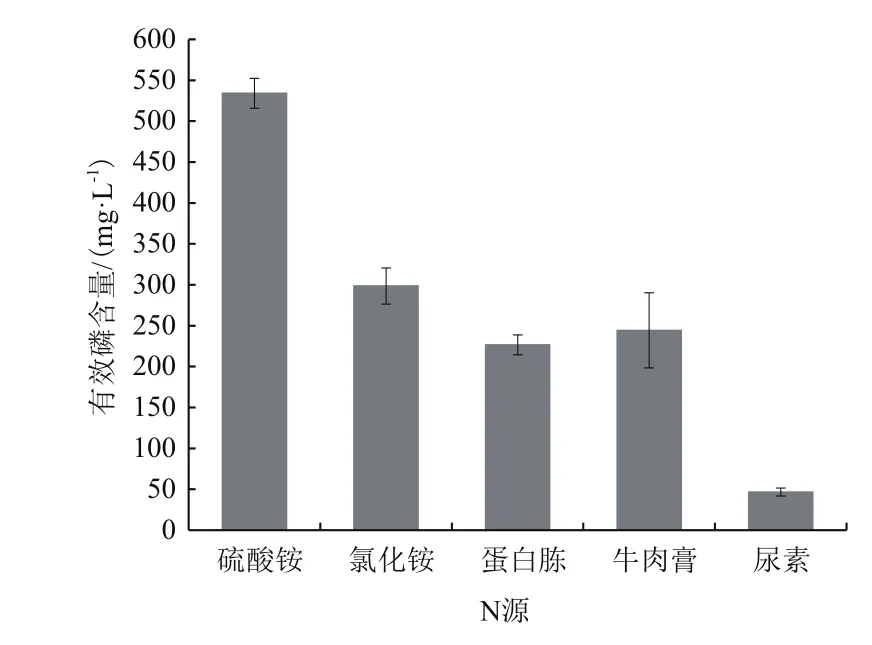
图5 不同氮源对X-P18菌株溶磷能力的影响
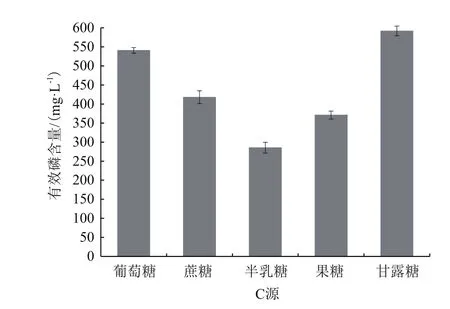
图6 不同碳源对X-P18菌株溶磷能力的影响
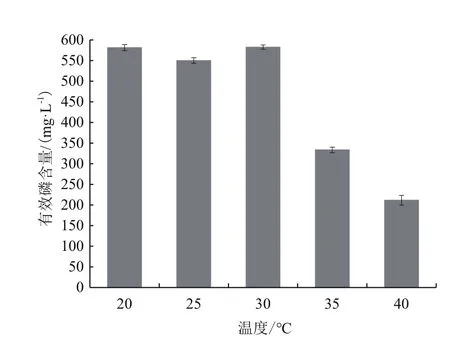
图7 不同温度对X-P18菌株溶磷能力的影响
2.4 X-P18菌剂对小白菜生长及土壤理化性质的影响
在黑叶葵扇白菜盆栽试验中,添加X-P18解磷菌菌剂明显促进了小白菜的生长,提高了鲜重、叶片磷含量。由表2可知,试验组P1、P2、P3株高分别高出对照组CK 8.0%、3.3%和4.5%,推测因为小白菜株高生长限制,所以株高差异未达到显著差异水平(P<0.05)。试验组鲜重分别高出对照组65.5%、22.7%和37.1%,叶片全磷含量分别高出对照组46.9%、29.7%、26.6%,对比空白组都达到了显著差异水平(P<0.05),其中菌剂添加量为2×109CFU/盆时对小白菜产量促进作用最高,结果表明X-P18菌株能够促进作物生长,并且适量的菌液更能在与土著微生物的竞争中取得优势,使其更好的通过解磷作用,促进对小白菜的生长。min出现的峰为乙酸峰远远大于其他小分子有机酸的峰面积,推测菌株在分泌有机酸溶解难溶性磷时,其中起主要作用的是乙酸。
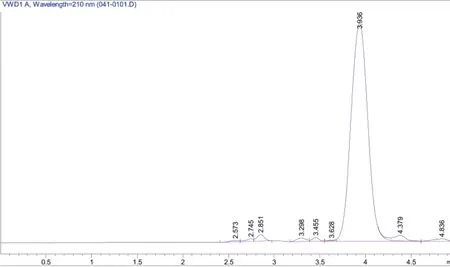
图8 X-P18菌株发酵液中有机酸测定结果

图9 X-P18菌株对小白菜的促生效果
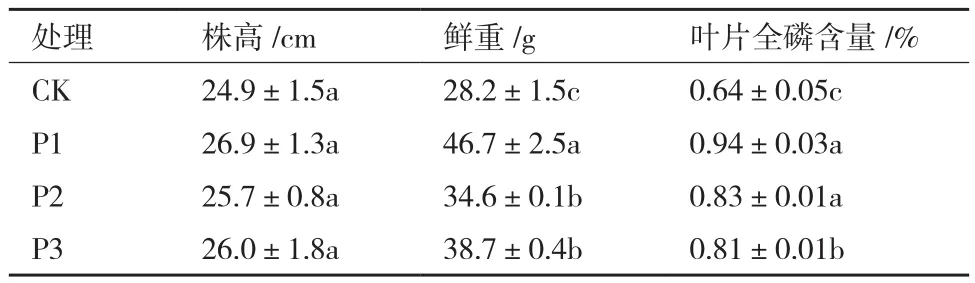
表2 小白菜盆栽试验中不同处理条件下小白菜的生长情况
3 讨论
土壤中有很多具有解磷能力的根际微生物,主要有肠杆菌属(Enterobacter)、芽孢杆菌属(Bacillus)、固氮菌属(Azotobacter)、节杆菌属(Arthrobacter)、假单胞菌属(Pseudolnonas)等[18]。解磷的芽孢杆菌属中,主要是枯草芽孢杆菌、巨大芽孢杆菌、阿氏芽孢杆菌、地衣芽孢杆菌等,而本研究筛选出的X-P18菌株为贝莱斯芽孢杆菌,其解磷量为495.4 mg/L,属于芽孢杆菌,但鲜有报导其解磷功能,且相比于国内外报道的其他解磷菌在相同解磷条件下较高。例如,万兵兵等[19]从烟区土壤筛选的1株弯曲芽孢杆菌,溶磷量为286.3 mg/L;邢芳芳等[20]从大麦根际筛选的1株枯草芽孢杆菌,溶磷量为449.1 mg/L。此外该菌还可以分泌IAA,具有一定的促生长作用。因此,本研究筛选的X-P18菌株是一株新型高效解磷菌,为解磷微生物的研究提供新的思路。
解磷菌的解磷能力与培养基中接种量、氮源、碳源、初始pH值及培养温度都有密切关系,这些因素都能够影响菌株的生长与代谢[21-23]。如陈言柳等[10]从油茶根际筛选出1株阿氏芽孢杆菌进行发酵培养条件优化得最佳培养条件为:碳源为葡萄糖,氮源为硫酸铵,温度28℃、初始pH7.5,溶磷量586.73 mg/L。本研究通过单因素优化试验发现,X-P18菌株最佳解磷条件为温度30℃,初始pH为8.0,接种量为1%、碳源为甘露糖,氮源为硫酸铵,经优化后的培养基的有效磷含量为582.4 mg/L,比优化前(495.4 mg/L)高出17.8%,其最适温度培养条件(20-30℃)更为广泛,pH(5.0、6.0和8.0)适应能力更强,增加了实际应用的广泛性。
目前,多数学者认为解磷菌通过分泌小分子有机酸,来溶解不溶性磷酸盐是其解磷的主要机制。在缺磷环境下,解磷微生物通过代谢产生一些有机酸,如乙酸、草酸和葡萄糖酸等,与土壤中不溶性磷酸盐螯合,从而释放土壤中被固定的磷素,其溶磷效果不仅与有机酸的种类和数量有关,还与机制的缓冲性及能与磷酸根离子螯合的离子数量,尤其是土壤中的 Ca2+数量有关[24];Rodriguez等[25]研究认为解磷芽孢杆菌是依靠分泌乙酸、乳酸、葡萄糖酸等来降解无机磷的;赵小蓉等[26]研究发现发酵液中溶磷量与有机酸种类与含量之间并无明显的关联。本实验通过测定发酵液中的小分子有机酸,发现X-P18菌株主要生产乙酸,和文献报道的作用机理一致。
本研究通过黑叶葵扇白菜盆栽试验结果表明,缺磷土壤施用解磷菌X-P18菌肥,不仅能够活化土壤中难溶性磷物质,还能分泌促生因子,提高农作物对养分的吸收利用,使农作物大量增产。因此,为X-P18菌株在解磷微生物肥料中的应用提供了重要的依据。
4 结论
本研究从农田筛选出的1株高效解磷菌株X-P18,经鉴定其为贝莱斯芽孢杆菌。该菌株最适生长条件为:接种量1%、pH8.0、碳源为甘露糖、氮源为硫酸铵、培养温度为30℃,在此条件下,其溶磷量为582.4 mg/L。该菌株可以分泌大量乙酸,这可能是其解磷的一种机制。该菌株液体菌剂后在缺磷土壤中促进黑叶葵扇白菜生长方面效果显著,可以通过微生物途径改善土壤中磷素供应。

