普伐他汀对老年男性骨质疏松合并冠心病病人骨代谢的影响
赵海红
骨质疏松是一种以骨量下降,骨微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性骨病[1]。随着年龄的增长,患病风险增加。他汀类药物为竞争性3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,为心脑血管疾病基础预防用药。早在10余年前已有确凿证据证明HMG-CoA还原酶抑制剂可以降低大约50%的骨折危险性[2]。普伐他汀为水溶性非CYP450酶代谢药物,避免与其他药物竞争代谢,经过肝肾双途径代谢,可减少肝、肾损害,为老年人他汀类首选药物之一。本研究旨在探讨普伐他汀对老年骨质疏松合并冠心病病人骨代谢的影响。现报道如下。
1 资料与方法
1.1 临床资料 选取2015年5月—2018年12月在我院住院的老年男性骨质疏松合并冠心病病人80例(年龄≥65岁)。其中合并冠心病病人39例为研究组,给予普伐他汀钠片,每日40 mg;非冠心病病人41例为对照组,给予安慰剂治疗。两组年龄、身高及体重比较差异均无统计学意义(P>0.05)。详见表1。排除标准:①有肝、肾功能异常者;②有甲状腺、甲状旁腺及肾上腺等内分泌疾病;③有结缔组织疾病,半年内曾服用糖皮质激素及影响骨代谢药物者。
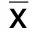

组别例数年龄(岁)身高(cm)体重(kg)对照组4176.6±1.4170.62±1.0369.82±1.33研究组3976.7±1.5172.24±1.2570.32±1.30
注:两组各项比较,P>0.05。
1.2 诊断标准 骨质疏松诊断标准参照1994年世界卫生组织(WHO)推荐的诊断方法[1],测得的骨密度与同性别峰值骨密度相比,其骨密度下降标准差,如有一个或一个以上部位T值≤-2.5 SD为骨质疏松(本研究选用腰椎总T值及股骨Neck T值)。
1.3 方法
1.3.1 一般资料收集 记录研究对象年龄、身高、体重及血压等情况,录入数据库。
1.3.2 双能X线骨密度检测 所有研究对象于治疗前、治疗后6个月采用美国Norland公司生产的XR-46双光能X线骨密度检测仪,测定腰椎L2~L4和股骨近端(Neck)骨密度。
1.3.3 骨代谢标志物检测 所有研究对象治疗前、治疗后6个月于清晨空腹抽取静脉血,采用酶联免疫吸附法测定血清碱性磷酸酶(ALP)、Ⅰ型胶原降解产物(CTX)、骨钙素(OC),仪器为雷伯RT6000酶标仪、美国Thermo公司酶标仪。
2 结 果
2.1 两组治疗前后腰椎及股骨颈骨密度比较 对照组治疗前后腰椎及股骨颈骨密度比较,差异无统计学意义(P>0.05);研究组治疗后6个月腰椎及股骨颈骨密度高于治疗前,差异有统计学意义(P<0.05)。详见表2。
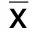

组别例数 腰椎总T值 治疗前治疗后6个月 股骨NeckT值 治疗前治疗后6个月对照组41-3.053±0.167-3.168±0.109-3.149±0.086-3.264±0.075研究组39-3.236±0.126-3.045±0.118①-3.198±0.114-2.921±0.109①
与本组治疗前比较,①P<0.05。
2.2 两组治疗前后骨代谢标志物水平比较 对照组治疗6个月后,CTX高于治疗前,OC与ALP低于治疗前,但差异无明显统计学意义(P>0.05);研究组治疗6个月后,CTX低于治疗前,差异无统计学意义(P>0.05);OC和ALP高于治疗前,差异有统计学意义(P<0.05)。详见表3。
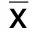

组别例数 ALP(μg/mL) 治疗前 治疗后6个月 CTX(ng/mL) 治疗前治疗后6个月 OC(ng/mL) 治疗前 治疗后6个月对照组4119.887±0.50817.814±0.8010.518±0.0190.573±0.03215.712±0.62113.929±0.981研究组3916.323±0.72319.223±0.542①0.568±0.1210.557±0.02716.223±0.68919.326±0.976①
与本组治疗前比较,①P<0.05。
3 讨 论
随着老龄化社会来临,骨质疏松骨折发生率增高,骨质疏松的药物治疗越来越受到重视,包括双磷酸盐、降钙素、甲状旁腺激素、雌激素及雌激素受体调节剂等药物。由于各种药物应用的局限性,他汀类药物作为心脑血管疾病基础预防用药,其在骨质疏松治疗方面的作用值得研究。1999年,Mundy等[3]首次发现辛伐他汀可以促进成骨,后相继有研究表明,他汀类药物在调脂稳定斑块的同时可促进成骨细胞、抑制破骨细胞[4-5],改善骨质疏松,为抗骨质疏松治疗提供了新的方向。
他汀类药物抗骨质疏松治疗作用机制尚不明确。目前认为其作用机制包括:促进成骨细胞分化、抑制破骨细胞形成。Yamashita等[6]认为辛伐他汀可通过拮抗肿瘤坏死因子-α(TNF-α)和Ras/Rho通路以及促进骨形态发生蛋白(BMP)-Smad信号通路,从而促进BMP表达,诱导成骨细胞分化;Takenaka等[7]则认为,辛伐他汀通过刺激血管内皮生长因子(VEGF)在骨组织内的表达促进成骨细胞分化。骨保护素(OPG)/核因子κB受体活化因子配体(RANKL)/核因子κB受体活化因子(RANK)系统是调节破骨细胞形成的最终递质,并且在破骨细胞增殖和分化过程中起重要作用[8]。回顾国内外文献,他汀类药物抗骨质疏松作用基本明确,作用机制尚在探讨过程中,但多数为辛伐他汀的临床研究、体外细胞实验或体内动物实验。他汀根据其亲脂亲水性和化学结果差异,分为亲水性和亲脂性,导致其药物作用机制不尽相同。辛伐他汀为亲脂性他汀,而普伐他汀为亲水性他汀,需要一定的载体才能进入细胞膜,且国内外对其抗骨质疏松疗效的研究甚少。
因骨密度的改变比较缓慢,骨临床中常常采用骨转化标志物评价抗骨质疏松治疗疗效。骨转化标志物包括骨吸收和骨形成标志物,其中CTX为骨吸收标志物,代表着破骨细胞的生物活性,ALP和OC为骨形成标志物,代表着成骨细胞的活性。本研究旨在探讨普伐他汀抗骨质疏松的疗效及可能机制。对照组治疗后6个月骨密度下降,差异无统计学意义(P>0.05),骨吸收标志物CTX较治疗前升高,差异无统计学意义(P>0.05),提示对照组的骨破坏在进行性进展。研究组治疗后6个月骨密度升高,骨吸收标志物ALP、OC明显升高(P<0.05)。提示普伐他汀可能是通过促骨形成而提高骨密度,改善骨质疏松,这与大多数研究结果一致,但其具体作用机制需要进一步研究。
综上所述,老年人疾病复杂,普伐他汀因其不竞争CYP450酶代谢,且为肝肾双通道代谢的特色,是老年骨质疏松合并冠心病病人首选他汀类药物,为抗骨质疏松治疗提供新的方向,减少病人经济负担,提高病人服药依从性,防治骨质疏松及骨质疏松骨折的发生。

