球等鞭金藻中岩藻黄素的提取及其纯化工艺研究
陈建楠 陈由强 薛婷
摘 要:以球等鞭金藻藻粉为原料,研究了球等鞭金藻中的岩藻黄素有机溶剂提取条件工艺优化、硅胶层析柱分离纯化和超高效液相色谱串联质谱联用仪定性分析。主要通过单因素试验法和正交优化法确定了提取条件的工艺优化参数,硅胶层析柱分离纯化岩藻黄素,并通过超高效液相色谱(UPLC)定量检测和LCQ Fleet 离子阱液质联用仪定性分析岩藻黄素。试验结果表明,最佳提取工艺为提取温度35℃、料液比1∶30(g/mL)、提取时间15 min、提取次数2次,岩藻黄素的提取率达到12.03 mg·g-1。硅胶层析柱分离纯化后最佳回收率为86.35%,纯度为29.78%,LCQ Fleet 离子阱液质联用仪定性分析质量分数为659.0902。本研究结果为工业化快速提取球等鞭金藻中的岩藻黄素活性物质提供了理论基础。
关键词:球等鞭金藻;岩藻黄素;提取工艺;纯化
中图分类号:S963 文献标志码:A 文章编号:0253-2301(2020)04-0028-10
DOI: 10.13651/j.cnki.fjnykj.2020.04.005
Study on the Extraction and Purification Process of Fucoxanthin in Isochrysis Galbana
CHEN Jian Nan1,2, CHEN You qiang1,2, XUE Ting1,2*
(1.College of Life Sciences, Fujian Normal University, Fuzhou, Fujian 350117, China;
2.Southern Institute of Oceanography, Fujian Normal University, Fuzhou, Fujian 350117, China)
Abstract: By taking Isochrysis galbana powder as the raw material, the process optimization of extraction conditions with the organic solvent of fucoxanthin in Isochrysis galbana, the separation and purification by silica column chromatography, and the qualitative analysis by UPLC GC MS were studied in this paper. The process optimization parameters of extraction conditions were determined mainly by the methods of single factor test and orthogonal optimization, and then the fucoxanthin was separated and purified by silica column chromatography. Last, the fucoxanthin was quantitatively detected by UPLC and qualitatively analyzed by LCQ Fleet. The results showed that the optimum extraction process was as follows: the extraction temperature was 35℃, the solid liquid ratio was 1∶30(g/mL), the extraction time was 15 min, and the extraction times were twice. Under these conditions, the extraction rate of fucoxanthin reached 12.03 mg·g-1, the optimal recovery rate was 86.35% and the purity was 29.78% after the separation and purification by silica column chromatography, and the mass fraction qualitatively analyzed by LCQ Fleet was 659.0902. The results of this study provided a theoretical basis for the rapid industrial extraction of the active substance of fucoxanthin from Isochrysis galbana.
Key words: Isochrysis galbana; Fucoxanthin; Extraction process; Purification
球等鞭金藻Isochrysis galbana[1-3]是一種富含岩藻黄素的海洋单细胞微藻,没有细胞壁,藻体形态为椭圆形或球形,具有两根等长的鞭毛。岩藻黄素(fucoxanthin)[4-5]分子式为C42H58O6,相对分子质量为658.91,密度为(1.1±0.1)g·cm-3,熔点在166~168℃范围间,沸点在(786.5±60.0)℃ ,紫外可见光光谱在447~450 nm,其主要通过液相色谱法和紫外分光光度法检测。岩藻黄素是一种红褐色无气无味的粉末结晶状物质,主要来源于海洋大型海藻褐藻和海洋微藻[5-6]。岩藻黄素分子结构式中含有1个多烯烃骨架-丙二烯型类胡萝卜素,5,6
单环氧基,9共轭双键,还含有有羰基和羟基[4]。岩藻黄素分子结构式中含有共轭双键,所以可能存在其他的同分异构现象,ZHANG等[7]从褐藻植物中分离纯化到3种同分异构体的岩藻黄素,9′Z、13Z和13′Z不同類型的岩藻黄素异构体。岩藻黄素具有抗氧化活性和清除自由基能力[7-8],XIA等[9]从海洋硅藻中提取出岩藻黄素,通过测定抗氧化活性来研究岩藻黄素对DPPH 和ABTS自由基团具有很强的清除能力。NISHINO等[10]通过岩藻黄素对DPPH、12-DS和NB-L各自由基团清除能力的电子信号强度,发现清除DPPH自由基能力要比清除12-DS和NB-L自由基的强。岩藻黄素具有抗血管新生和多种保护预防活性,SUGAWARA等[11]通过岩藻黄素对人体静脉内皮细胞的研究,发现岩藻黄素具有抑制内皮组细胞分化生成新的内皮细胞,从而达到抗血管新生作用。岩藻黄素具有抗肥胖和抗肿瘤活性,HOSOKAWA等[12]通过岩藻黄素培养结肠癌细胞试验发现了岩藻黄素具有诱导癌细胞的DNA断裂,从而导致癌细胞死亡,降低癌细胞增殖生长的功能。
岩藻黄素是脂溶性色素,易溶于有机溶剂,如甲醇、乙醇、二甲基亚砜、丙酮、正己烷、石油醚和乙酸乙酯等[5-6]。岩藻黄素提取的主要方法有机溶剂浸提法、CO2超临界萃取技术、微波萃取法和超声波提取法等[5]。有机溶剂提取微藻中的岩藻黄素,其主要利用有机溶剂甲醇、乙醇、丙酮或者混合有机溶剂甲醇∶丙酮(2∶1)等对藻体中色素的进行溶解萃取,其方法简单效果好,在国内外被广泛使用。Kim等[13]通过对三角褐指藻中提取岩藻黄素,得到了最佳的提取条件为有机溶剂乙醇为最佳提取溶剂,提取温度为40℃,料液比为1∶6,提取时间为12 h。Wang等[14]通过二甲基亚砜浸泡海带,再用含有硫酸铵的乙酸乙酯对岩藻黄素进行萃取。尹尚军等[15]通过甲醇乙醇的混合溶剂对羊栖菜进行岩藻黄素提取,其料液比在1∶40,温度在65℃下水浴振荡提取2次,提取率可达1.067 mg·g-1。Roh等[16]通过超临界CO2萃取技术将岩藻黄素从裙带菜中提取出来,其得到最佳提取工艺为3%乙醇为夹带剂,压力为20 MPa,温度为49.85℃。XIAO等[17]通过微波萃取技术在褐藻海带中提取岩藻黄素,并且对各提取条件进行了优化,得到了最优的微波提取条件。陈文佳[18]通过超声波辅助对海带中的岩藻黄素进行提取条件的工艺优化,得出了最佳的提取工艺参数:加入1%的坏血酸、料液比为1∶45、提取温度为60℃、超声波处理30 min提取2次,提出率为0.4417 mg·g-1。岩藻黄素的分离纯化方法主要是通过硅胶柱层析技术、制备型高效液相色谱法、薄层层析色谱法、离心分配色谱技术[19]和高速逆流色谱法等。薄层层析色谱法分离岩藻黄素是探究层析液对岩藻黄素的分离效果,从而选定为接下来的柱层析分离[20-21]。硅胶柱层析的原理是通过不同物质在硅胶颗粒上吸附力的不同而得到分离[5,19]。SUDHAKAR等[22]通过硅胶柱层析将褐藻海带中的岩藻黄素进行分离纯化,洗脱液为正己烷∶丙酮(7∶3)混合液。周卫松等[5]通过硅胶柱层析分离纯化海带中的岩藻黄素,分离纯化得到的纯度为24.2%,回收率可达90.9%。HOSOKAWAM等[23]通过硅胶柱分离纯化裙带菜粗提物里的岩藻黄素,其洗脱液为正己烷∶丙酮(6∶4)进行洗脱。
本研究主要通过有机溶剂浸提法对球等鞭金藻中岩藻黄素的提取工艺进行优化,以及硅胶柱层析技术分离纯化岩藻黄素,进一步采用高效液相色谱串联质谱联用仪定性分析岩藻黄素,为后续工业化快速提取球等鞭金藻中的岩藻黄素活性物质提供理论和技术基础。
1 材料与方法
1.1 主要试剂材料
1.1.1 藻粉来源 球等鞭金藻藻粉:实验室光生物反应器通气培养,离心冻干收集。
1.1.2 试验试剂 无水乙醇、甲醇、丙酮、二甲基亚砜等试剂均为国药分析纯。色谱纯乙腈、色谱纯甲醇购于德国默克,色谱纯甲酸购于阿拉丁。岩藻黄素标准品购于Sigma Aldrich。硅胶板、硅胶柱、硅胶粉200~300目等。
1.1.3 试验仪器 光生物反应器(上海光语生物科技有限公司),超纯水机(美国密理博Milli Q Academic),旋转蒸发仪RE52A(上海亚荣生化仪器厂),高速冷冻离心机[赛默飞世尔科技(中国)有限公司],超高效液相色谱(ACQUITY UPLCTM新加坡沃特斯公司),冻干机[赛默飞世尔科技(中国)有限公司],液相质谱Thermo ScientificTM LCQ FleetTM[赛默飞世尔科技(中国)有限公司]等。
1.2 试验方法
1.2.1 原料来源的预处理 将球等鞭金藻培养在50 L的光生物反应器至指数生长期后期,8000 r·min-1冷冻离心收集藻泥,用蒸馏水洗涤3次,放置-80℃冰箱预冷24 h,转至冷冻干机48 h冻干。冻干后将球等鞭金藻碾成粉末状,称重分装。
1.2.2 超高效液相色谱UPLC检测条件 检测条件:PDA Detector光电二极管矩阵检测器。色谱柱:ACQUITY UPLC BEH C18 1.7 μm 2.1×50 mm色谱柱以及配套保护柱。流动相:A2色谱纯乙腈(0.05%甲酸)和B1超纯水(0.05%甲酸)梯度洗脱:0~4 min A2(65%~100%)B1(0~35%),4~7 min A2(100%),7~8 min A2(65%)B1(35%),8~12 min A2(65%)B1(35%)。吸光度:447 nm(岩藻黄素标品先经过UPLC 的PDA Detector光电二极管矩阵检测器400~600 nm全波段扫描,波长在447 nm处对岩藻黄素标品有最大吸收峰值)。流动相流速:0.25 mL·min-1。色谱柱温度:40℃。样品室温度:25℃,进样量:2 μL,进样时间12 min。
1.2.3 岩藻黄素的提取条件优化 (1)不同有机溶剂对球等鞭金藻岩藻黄素提取率的影响。准确称取球等鞭金藻藻粉20 mg分装于棕色2 mLEP管中,分别加入1 mL的有机溶剂甲醇、無水乙醇、丙酮、氯仿、石油醚、乙酸乙酯、二甲基亚砜、甲醇∶丙酮(1∶1)8种有机溶剂,每种溶剂各设置3个平行,盖上盖子,放置在暗光里浸提1 h。浸提期间把EP管上下颠倒摇匀3次,以便溶剂浸提色素更充分。浸提完成,用高速冷冻离心机12000 r·min-1离心10 min,收集上清液,通过一次性注射器吸取,过0.22 μm有机滤膜装于棕色液相进样瓶中,再通过UPLC检测其岩藻黄素含量。(2)提取温度对球等鞭金藻岩藻黄素提取率的影响。准确称取球等鞭金藻藻粉20 mg分装于棕色2 mLEP管中,加入1 mL的有机溶剂甲醇(由不同有机溶剂提取球等鞭金藻岩藻黄素筛选出),分别置于预先设好冰浴上,分别为20℃、25℃、30℃、35℃、40℃(温度不宜设置太高,岩藻黄素对温度和光敏感)水浴锅上,每组3个平行,盖上锅盖子避光浸提1 h。浸提期间快速拿出来上下颠倒摇匀3次。浸提完成,用高速冷冻离心机12000 r·min-1离心10 min,收集上清液,通过一次性注射器吸取,过0.22 μm有机滤膜装于棕色液相进样瓶中,再通过UPLC检测其岩藻黄素含量。(3)料液比对球等鞭金藻岩藻黄素提取率的影响。准确称取球等鞭金藻藻粉50 mg分装于棕色2 mLEP管中,分别加入1∶10、1∶15、1∶20、1∶
25、1
∶30、1∶35(g/mL)的料液比有机溶剂甲醇,每组3个平行试验,盖上盖子避光浸提1 h,提取温度为35℃。浸提期间快速拿出来上下颠倒摇匀3次。浸提完成,用高速冷冻离心机12000 r·min-1离心10 min,收集上清液,通过一次性注射器吸取,过0.22 μm有机滤膜装于棕色液相进样瓶中,再通过UPLC检测其岩藻黄素含量。(4)提取时间对球等鞭金藻岩藻黄素提取率的影响。准确称取球等鞭金藻藻粉20 mg分装于棕色2 mLEP管中,加入料液比为1∶30(g/mL),有机溶剂甲醇,分别设置浸提时间为15、30、60、90、120 min,每组试验3个平行,提取温度为35℃。浸提期间快速拿出来上下颠倒摇匀3次。浸提完成,用高速冷冻离心机12000 r·min-1离心10 min,收集上清液,通过一次性注射器吸取,过0.22 μm有机滤膜装于棕色液相进样瓶中,再通过UPLC检测其岩藻黄素含量。(5)提取次数对球等鞭金藻岩藻黄素提取率的影响。准确称取球等鞭金藻藻粉20 mg分装于棕色2 mL EP管中,加入料液比为1∶30(g/mL),有机溶剂甲醇,分别设置提取次数为1、2、3次[提取完再加入料液比为1∶30(g/mL)有机溶剂甲醇]。每组试验3个平行,提取时间为1 h,提取温度为35℃。浸提期间快速拿出来上下颠倒摇匀3次。浸提完成,12000 r·min-1离心10 min,合并收集上清液,通过一次性注射器吸取,过0.22 μm有机滤膜装于棕色液相进样瓶中,再通过UPLC检测其岩藻黄素含量。
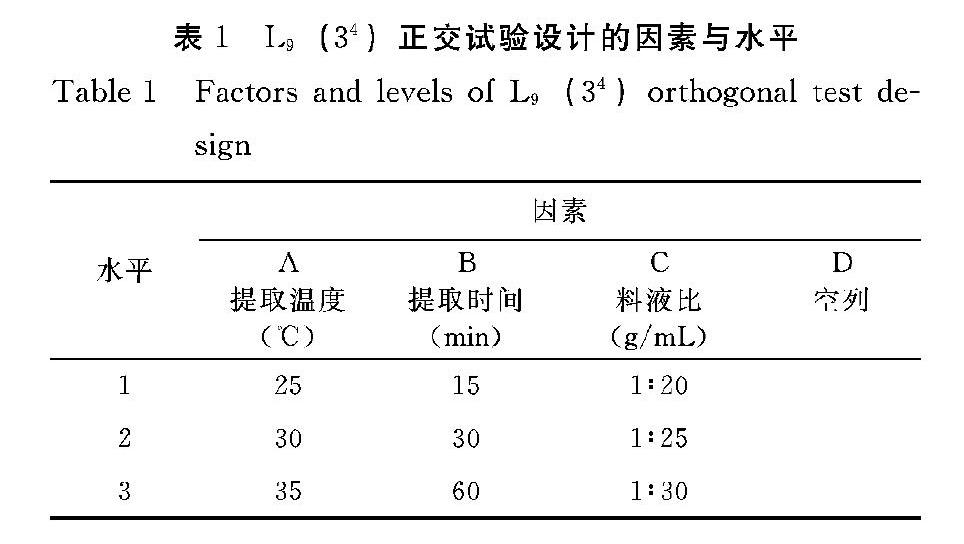
1.2.4 岩藻黄素提取工艺正交优化试验 通过对球等鞭金藻有机溶剂提取岩藻黄素的各提取条件进行单因素试验,选取岩藻黄素的主要提取因子:提取温度、提取时间、料液比,进行四因素三水平的正交优化试验(为了减少误差设置了一列空列D),表1为L9(34)正交试验设计的各因素与水平,表2为L9(34)正交试验设计表。
1.2.5 岩藻黄素分离纯化试验 (1)硅胶板薄层层析定性分析。硅胶薄层层析板定性分析(TLC):先将300目硅胶薄层层析板放置在100℃烘箱里烘干,烘干后取出硅胶板放置在水平台面上,冷却至室温。在硅胶板底端1 cm处用铅笔划上一条横线,并在线上左右各标上2个点,方便点样。吸取3 μL球等鞭金藻岩藻黄素提取液点样于线上的右点处,左侧点点样岩藻黄素标品3 μL,标品和提取液浓度不能太高。待有机溶剂挥发干后,放入预先配好的层析液层析缸中,进行跑样。由于球等鞭金藻提取液是提取的总色素,自带颜色,很好观察,无需喷显色剂。本研究主要参考国内外发表的一些文献,分离纯化岩藻黄素的层析液,初步选定乙酸乙酯∶丙酮∶甲醇(3∶2∶1)、正己烷∶甲醇(3
∶2)、正己烷∶乙酸乙酯∶甲醇(3∶2∶1)、正己烷∶丙酮(3
∶2)作为层析液进行跑样,再根据跑样的效果进行浓度梯度适当变化。(2)硅胶柱层析分离纯化岩藻黄素。准确称取球等鞭金藻藻粉1 g重新放入50 mL的离心管中,离心管外用锡箔纸包起来,加入30 mL甲醇,再加入1‰左右的MgCO3粉末防止氧化,在35℃水浴下避光浸提15 min,期间拿出来上下颠倒混匀3次,浸提2次。浸提完成,12000 r·min-1离心10 min合并收集上清液,取100 μL稀释,通过UPLC液相色谱检测含量。然后用旋转蒸发浓缩至5 mL左右的总色素和加入硅胶粉吸附浓缩得到总色素粉末。
硅胶柱准备阶段:先将200~300目大小的硅胶粉在100℃烘箱里过夜烘干,架起直径为5 cm长度为60 cm的带砂底的层析柱,将烘干的硅胶粉均匀地往层析柱里装,一次性装到层析柱的2/3处,装柱期间不能停,要一次性装好柱,防止硅胶粉断层。再加入洗脱液正己烷∶乙酸乙酯∶甲醇(9∶2∶1)高于柱子里的硅胶层,让洗脱液充满硅胶柱里的硅胶粉,再用洗脱液进行洗脱8 h或者过夜洗脱,洗脱液洗脱后液面要刚好留在硅胶层析柱里的硅胶粉层,分别加入球等鞭金藻提取浓缩液总色素和硅胶粉末浓缩吸附的总色素,加入后再盖上一层2~3 cm的硅胶粉。通过洗脱液正己烷∶乙酸乙酯∶甲醇(9∶2∶1)进行室内避光洗脱。洗脱后,收集最后出来橙褐色的岩藻黄素层,分装在棕色瓶子里。再通过40℃水浴旋转蒸发仪浓缩至岩藻黄素粉末,再称重,甲醇溶解,取微量再稀释适宜浓度通过UPLC检测其浓度,再计算含量和分离纯化的纯度。
1.2.6 高效液相色谱串联质谱联用仪定性分析 将球等鞭金藻岩藻黄素经过硅胶层析柱分离纯化后的样品和溶解于色谱纯甲醇中岩藻黄素标准品,通过一次性注射器吸取,过0.22 μm有机滤膜装于棕色液相進样瓶中,再通过美国Thermo ScientificTM LCQ FleetTM LCMS质谱仪检测鉴定分析。
2 结果与分析
2.1 岩藻黄素的提取条件优化结果分析
2.1.1 不同有机溶剂对球等鞭金藻岩藻黄素提取率的影响 通过不同有机溶剂甲醇、无水乙醇、丙酮、氯仿、石油醚、乙酸乙酯、二甲基亚砜、甲
醇∶丙酮(1∶1)8种有机溶剂对球等鞭金藻岩藻黄素提取率的影响试验,不同溶剂的提取率如图1所示,发现有机溶剂丙酮对球等鞭金藻的提取率最高,其次是甲醇,两者相差不大,氯仿和石油醚提取率最低,不适合作为岩藻黄素提取溶剂。考虑到丙酮属于易制毒易制爆危险品,毒性大,易致癌,易挥发,对人体危害大,不适合作为工厂化提取球等鞭金藻岩藻黄素的有机溶剂,所以选用了甲醇作为最适提取溶剂。
2.1.2 提取温度对球等鞭金藻岩藻黄素提取率的影响 通过不同提取温度对岩藻黄素提取率的影响试验,发现提取温度逐渐升高其岩藻黄素的提取率也逐渐升高,提取温度在35℃和40℃时,提取率变化不大,如图2所示,考虑到温度对岩藻黄素的敏感性,温度越高岩藻黄素越容易变性,所以选择35℃作为后续试验中岩藻黄素提取最适温度。
2.1.3 料液比对球等鞭金藻岩藻黄素提取率的影响 通过不同料液比对球等鞭金藻岩藻黄素提取率的影响试验,发现了随着料液比率的升高,球等鞭金藻岩藻黄素的提取率越高,如图3所示,料液比1∶30时,岩藻黄素的提取率达到最高,所以在后续试验中选择料液比 1∶30(g/mL)作为球等鞭金藻岩藻黄素提取的料液比。
2.1.4 提取时间比对球等鞭金藻岩藻黄素提取率的影响 通过不同提取时间对岩藻黄素提取率的影响试验,发现了球等鞭金藻岩藻黄素的提取率在提取时间60 min时和90 min、120 min的提取率基本相同,如图4所示。所以在后续试验里选择60 min作为最适提取时间。
2.1.5 提取次数比对球等鞭金藻岩藻黄素提取率的影响 通过不同提取次数对岩藻黄素提取率的影响试验,发现浸提2次基本能够把球等鞭金藻中的岩藻黄素提取出来,浸提2次与浸提3次的提取率基本相同。如图5所示,所以选择浸提次数为2次为最佳的提取次数。
2.2 岩藻黄素提取工艺正交优化结果分析
经过对球等鞭金藻有机溶剂提取岩藻黄素的各提取条件的单因素试验后,选取岩藻黄素的主要提取因子进行四因素三水平的正交优化试验,其正交试验结果如图表3所示,从表中极差R值可得四因素对球等鞭金藻岩藻黄素提取率的影响大小顺序:C>B>D>A;根据各个因素的均值K可以得出最佳工艺提取优化组合为C3B1A3,即料液比1∶30(g/mL)、时间15 min、温度35℃、浸提次数为2次。通过再次提取验证,球等金藻岩藻黄素的提取率为12.03 mg·g-1。
2.3 岩藻黄素分离纯化结果分析
2.3.1 硅胶板薄层层析定性分析结果 通过薄层层析定性分析球等鞭金藻提取的岩藻黄素分离度,结果显示层析液正己烷∶乙酸乙酯∶甲醇(3∶2∶1)对色素的分离度最好,能够比较清晰地看出分离出3个条带。所以选择正己烷∶乙酸乙酯∶甲醇(3∶2∶1)混合液作为层析液。同时再进一步调整正己烷、乙酸乙酯和甲醇的混合比率,来分离岩藻黄素。其结果显示分离效果最好的混合比率是正己烷∶乙酸乙酯∶甲醇(9∶2∶1)。正己烷∶乙酸乙酯∶甲醇(9∶2∶1)混合液层析分离效果好,能够清楚地把球等鞭金藻提取的总色素里的胡萝卜素、叶黄素、叶绿素a、叶绿素c和岩藻黄素区分开来。所以选用层析液正己烷∶乙酸乙酯∶甲醇(9∶2∶1)作为进一步硅胶柱层析分离纯化岩藻黄素的洗脱液。
2.3.2 硅胶柱分离纯化岩藻黄素结果 硅胶柱层析分离纯化后收集的岩藻黄素溶液,再经过40℃水浴旋转蒸发仪浓缩至岩藻黄素粉末,再称重,甲醇溶解,取微量并稀释适宜浓度通过UPLC检测其浓度,再计算其含量和分离纯化的纯度。经旋转蒸发仪浓缩得到的总色素以浓缩至硅胶粉末的方法过柱纯化后的回收率为67.03%,UPLC检测计算其纯度为23.94%,以浓缩液形式过柱分离纯化后得到的回收率为86.35%,UPLC检测计算纯度为29.78%。通过这2种岩藻黄素浓缩方式过柱的回收率可以看出,岩藻黄素浓缩至硅胶粉末里岩藻黄素的损失比较大,以浓缩液方式过柱分离纯化岩藻黄素损失较小,而且纯度比较大。再将硅胶柱分离纯化后的岩藻黄素经硅胶薄层层析板定性分析,硅胶薄层层析板上只有单一的岩藻黄素条带,说明岩藻黄素纯度还是比较高的。
2.4 岩藻黄素的LCMS定性结果分析
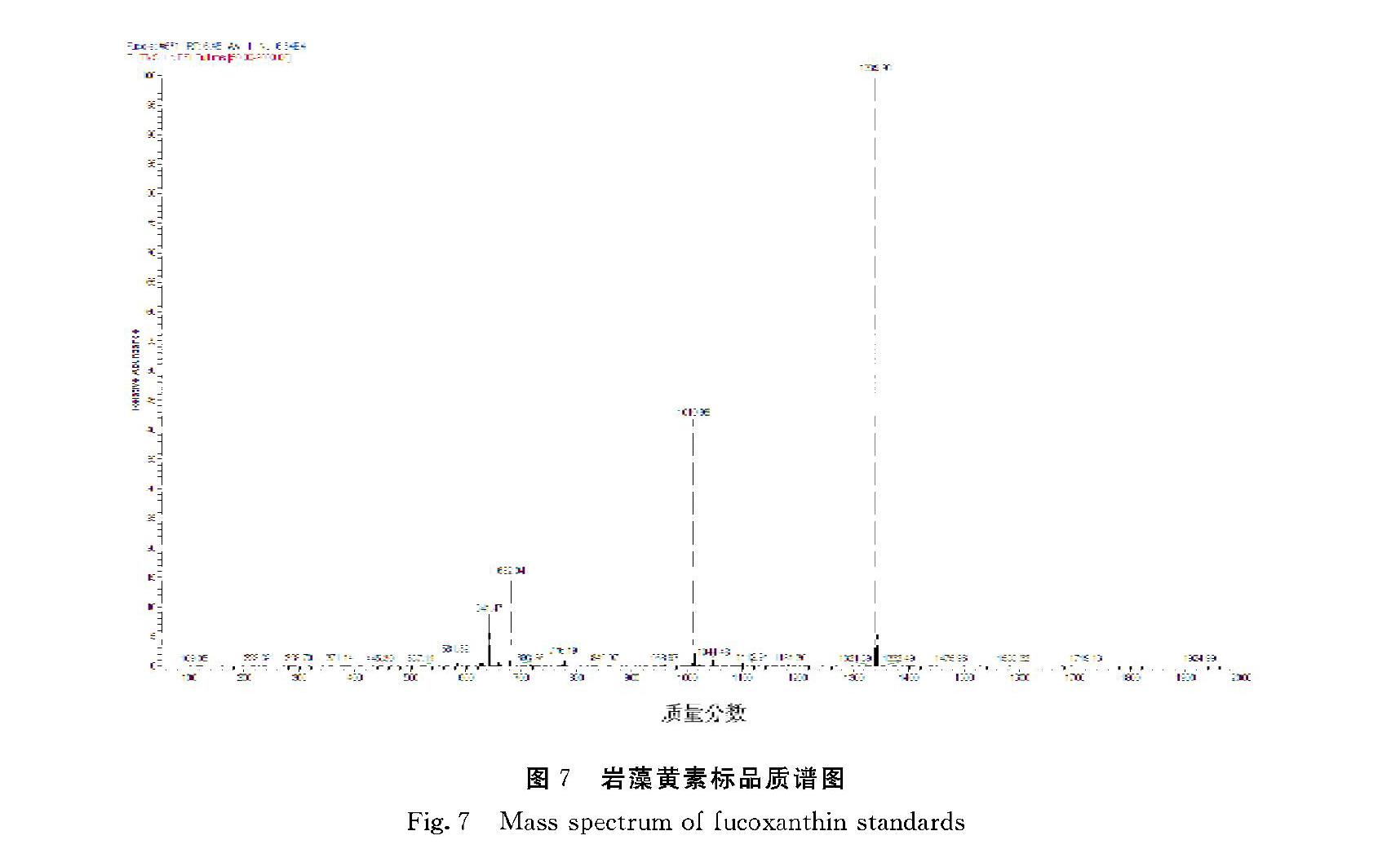
通过Thermo ScientificTM LCQ FleetTM LCMS质谱仪检测鉴定,检测的岩藻黄素标准品如图6所示,出峰时间基本一致,没有较大的杂峰,说明岩藻黄素标品纯度高。岩藻黄素标品质谱图如图7所示,第一个大峰的峰面积是682.04,它是一个岩藻黄素分子量加上一个Na的分子量之和。岩藻黄素分子量为658.91,分子式为C42H58O6 ,Na的分子量为22.9898。计算可得岩藻黄素标准品的相对分子量为659.0502,与文献报道相符。
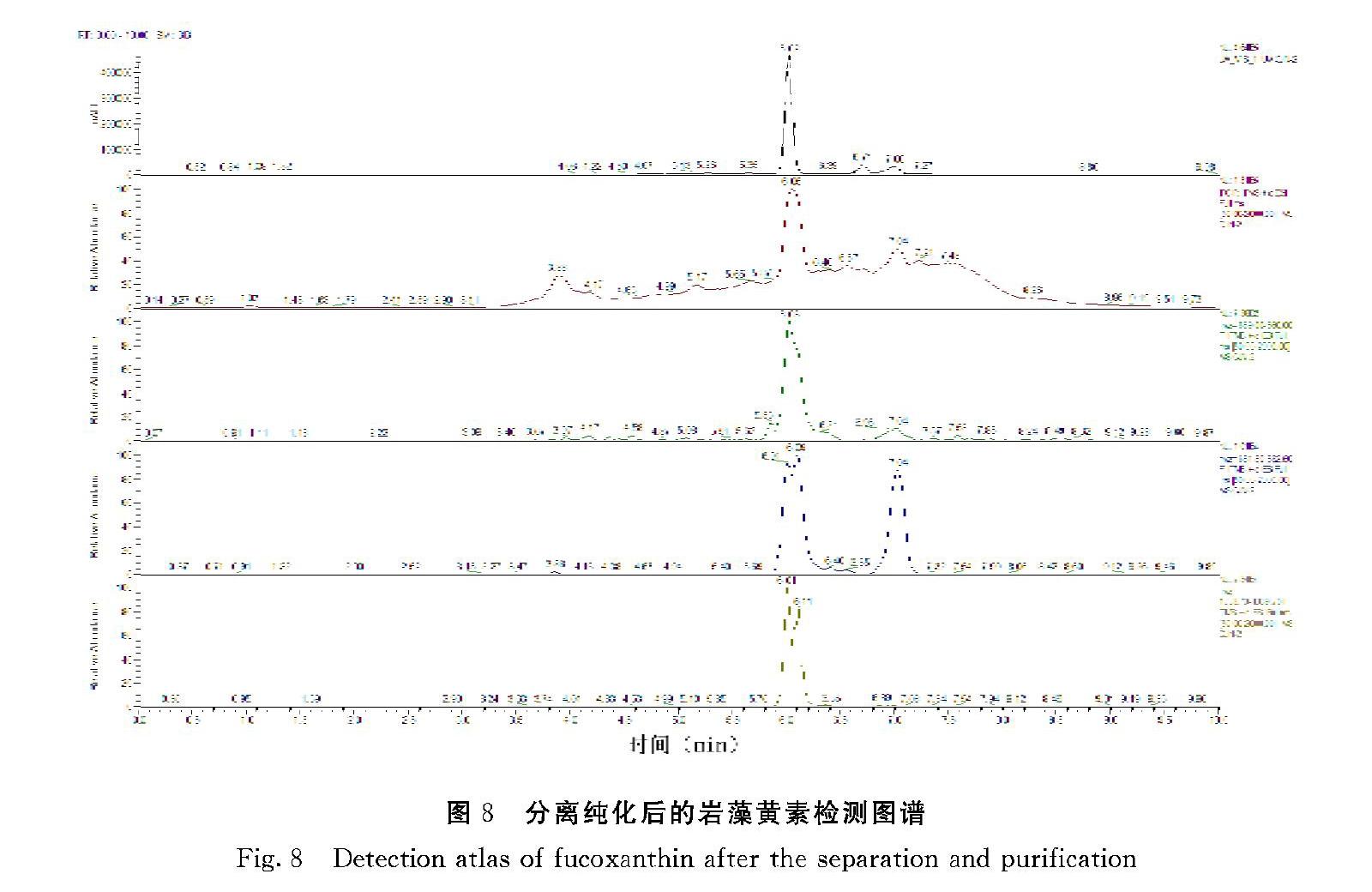
经过硅胶柱层析分离纯化后的岩藻黄素检测结果如图8、9所示,出峰时间基本一致,没有较多杂峰,说明硅胶柱分离纯化的结果较好,纯度相对比较高。其质谱图显示的分子量大小于岩藻黄素标品一致,第一个大峰的峰面积是682.08,是一个岩藻黄素分子量加上一个Na的分子量之和。计算可得球等鞭金藻岩藻黄素纯化后的质量分数大小为659.0902,与岩藻黄素标准品检测的质量分数基本一致,与文献报道的相符。
3 结论与讨论
本研究以球等鞭金藻藻粉为原料,研究了球等鞭金藻中岩藻黄素有机溶剂提取的最佳工艺参数和硅胶层析柱分离纯化。通过不同有机溶剂提取球等鞭金藻岩藻黄素的提取率试验研究中,發现了有机溶剂丙酮对球等鞭金藻岩藻黄素的提取率最高,其次是甲醇。考虑到丙酮属于易制毒易制爆危险品,毒性大,易致癌,易挥发,对人体危害大,不适合作为工厂化提取球等鞭金藻岩藻黄素的有机溶剂,所以选用了甲醇作为最适提取溶剂。对球等鞭金藻岩藻黄素提取温度、料液比、提取时间、提取次数的提取率进行研究,发现了提高提取温度、料液比、提取时间、提取次数,其提取率就越高。有机溶剂浸提球等鞭金藻岩藻黄素作为工厂化应用的发展方向,对3个主要提取条件进行了正交工艺优化,其结果显示提取温度在35℃、提取的料液比为1∶30、提取时间在15 min、提取次数在2次为最佳的提取工艺组合,通过再次提取验证,球等鞭金藻岩藻黄素的提取率为12.03 mg·g-1。
将球等鞭金藻提取的岩藻黄素经过硅胶板薄层层析定性分析,选定层析液正己烷:乙酸乙酯:甲醇(9∶2∶1)作为硅胶柱进一步分离纯化的洗脱液,经过硅胶柱分离纯化得到了以总色素浓缩至硅胶粉末的方法过柱纯化的回收率为67.03%,纯度为23.94%;以浓缩液的形式过柱分离纯化得到的回收率为86.35%,纯度29.78%。通过这两种岩藻黄素浓缩方式过柱的回收率可以看出,岩藻黄素浓缩至硅胶粉末里岩藻黄素的损失比较大,以浓缩液方式过柱分离纯化岩藻黄素损失较小,而且纯度比较大,硅胶柱分离纯化后的岩藻黄素经硅胶薄层层析板定性分析,硅胶薄层层析板上只有单一的岩藻黄素条带,说明岩藻黄素纯度比较高。再通过Thermo ScientificTM LCQ FleetTM LCMS质谱仪对岩藻黄素的定性检测分析,球等鞭金藻里确实存在岩藻黄素,其岩藻黄素的质量分数大小为659.0902,与文献报道的相符。
本研究主要通过有机溶剂浸提法对球等鞭金藻中岩藻黄素的提取工艺进行优化和硅胶柱层析技术分离纯化,为后续工业化快速提取球等鞭金藻中的岩藻黄素活性物质提供理论和技术基础。但还存在很多不足,如:在提取过程可以引入超声波辅助提取,在纯化过程可以一级纯化二级纯化,可能纯化实验的结果会更加的理想。
参考文献:
[1]臧正蓉.富含岩藻黄素的微藻藻种的筛选及其中试培养[D].北京:中国科学院研究生院(海洋研究所),2014.
[2]刘春凤,吴雪,高悦勉.两种等鞭金藻外部形态与超微结构的观察比较[J].大连水产学院学报,2008(4):273-277.
[3]王帅.富油微藻筛选及球等鞭金藻(Isochrysis galbana)脂肪酸去饱和酶基因的克隆与功能研究[D].青岛:中国海洋大学,2015.
[4]汪曙晖,薛长湖.岩藻黄素的结构、性质和功能[J].食品工业科技,2010,31(6):408-410,407.
[5]张文源,高保燕,雷学青,等.岩藻黄素的理化与生物学特性、制备技术及其生理活性研究进展[J].中国海洋药物,2015,34(3):81-95.
[6]周卫松.裙带菜中岩藻黄质、岩藻多糖的综合提取纯化研究[D].杭州:浙江大学,2014.
[7]ZHANG Y P,FANG H,XIE Q L,et al.Comparative Evaluation of the Radical Scavenging Activities of Fucoxanthin and Its Stereoisomers[J].Molecules,2014,19:2100-2113.
[8]汪曙晖.海藻中岩藻黄素的分离鉴定及抗肿瘤活性研究[D].青岛:中国海洋大学,2010.
[9]XIA S,WANG K,WAN L,et al.Production, Characterization, and Antioxidant Activity of Fucoxanthin from the Marine Diatom Odontella aurita[J].Marine Drugs,2013,11(7):2667.
[10]NISHINO H.Cancer prevention by carotenoids[J].Archives of Biochemistry & Biophysics,1998,402(1-2):159-163.
[11]SUGAWARA T,BASKARAN V W,NAGAO A.Brown algae fucoxanthin is hydrolyzed to fucoxanthinol during absorption by Caco 2 human intestinal cells and mice[J].Journal of Nutrition,2002,132(5):946-951.
[12]HOSOKAWA M,KUDO M,MAEDA H,et al.Fucoxanthin induces apoptosis and enhances the antiproliferative effect of the PPARγ ligand,troglitazone,on colon cancer cells[J].Biochimica Et Biophysica Acta General Subjects,2004,1675(3):113-119.
[13]KIM J C.Solvent Extraction of Fucoxanthin from Phaeodactylum tricornutum[J].Separation Science & Technology,2014,49(3):410-415.
[14]WANG W J,WANG G C,ZHANG M,et al.Isolation of Fucoxanthin from the Rhizoid of Laminaria japonica Aresch[J].Journal of Integrative,2005,47(8):1009-1015.
[15]尹尚军,徐涛,刘丽平,等.羊栖菜岩藻黄质的提取工艺研究[J].食品工业科技,2011(4):272-275.
[16]ROH M K,CHUN U B S.Extraction of fucoxanthin and polyphenol from Undaria pinnatifida using supercritical carbon dioxide with co solvent[J].Biotechnology & Bioprocess Engineering,2008,13(6):724-729.
[17]XIAO X,SI X,YUAN Z,et al.Isolation of fucoxanthin from edible brown algae by microwave assisted extraction coupled with high speed countercurrent chromatography[J].Journal of Separation Science,2012,35(17):2313-2317.
[18]陳文佳.海带中岩藻黄素提取工艺优化及性质研究[D].济南:山东轻工业学院,2012.
[19]MARCHAL L,LEGRAND J,FOUCAULT A.Centrifugal partition chromatography:A survey of its history,and our recent advances in the field[J].Chemical Record,2003,3(3):133-143.
[20]PIOVAN A,FILIPPINI R,DE P M,et al.TLC densitometric method for the preliminary evaluation of fucoxanthin based products[J].Natural Product Research,2014,28(14):1111-1115.
[21]RAJAURIA G,ABU GHANNAM N.Isolation and Partial Characterization of Bioactive Fucoxanthin from Himanthalia elongata Brown Seaweed:A TLC Based Approach[J].International Journal of Analytical Chemistry,2013,2013(1):4518-4519.
[22]SUDHAKAR M P.Extraction, purification and study on antioxidant properties of fucoxanthin from brown seaweeds[J].Journal of Chemical & Pharmaceutical Research,2013,5(7):169-175.
[23]HOSOKAWA M,WANEZAKI S,MIYAUCHI K,et al.Apoptosis Inducing Effect of Fucoxanthin on Human Leukemia Cell Line HL60[J].Food Science & Technology Research,2006,5(3):243-246.
(责任编辑:柯文辉)

