丙烯酰胺和2,5-己二酮对大鼠薄束核病理改变的差异性影响*
侯 维 李银花 贾云格 张天翼 白 璐 谭会兵,2△
(1 锦州医科大学基础医学院解剖学教研室,2 辽宁省神经退行性病变重点实验室,锦州 121000)
丙烯酰胺(acrylamide,AA)和2,5-己二酮(2,5-hexanedione,2,5-HD)对机体均可产生神经毒作用,它们对机体产生的病理改变和作用机制可能不同。AA 是一种水溶性不饱和酰胺,AA有机合成类职业暴露人群流行病学研究确定的症状是中枢和周围神经损伤[1-2],包括共济失调、步态异常、后肢麻木和骨骼肌变弱等[3]。2,5-HD 是正己烷在机体的代谢产物,研究表明神经系统是 2,5-HD 的主要靶标,早期接触出现手脚麻木和刺痛,接着会出现虚弱和反射消失,更严重的会引起步态异常[4-5]。研究表明AA 等毒素暴露下大鼠神经轴突出现转运障碍,神经纤维丝聚集,这种病变主要累及较长的轴突如坐骨神经,而这种轴突肿胀在薄束核也被观察到[6]。烟酰胺腺嘌呤二核苷酸磷酸黄递酶(NADPH-d)组织化学常被用来显示一氧化氮合酶(NOS)阳性神经元,在老年鼠和鸽子延髓节段均发现有年龄相关性NADPH-d 染色的阳性改变[7],全身并且局部坐骨神经给予2,5-HD 的正常Zucker lean 大鼠,在薄束核NADPH-d 染色神经元和轴突增加[8]。但是对于亚急性毒素暴露后大鼠薄束核的病理改变及其机制目前还未见报道,本实验旨在探究AA 和2,5-HD 对薄束核的病理改变的差异性影响及其可能的机制。
1 材料和方法
1.1 实验动物
6 周龄的SPF 级雄性SD 大鼠48 只(均购自锦州医科大学实验动物中心)。饲养于明/暗12 h/12 h 循环的动物房,湿度适宜,动物可自由取食水。
1.2 主要试剂和仪器
AA、2,5-HD、β-NADPH-d、氯化硝基四氮唑蓝(nitro blue tetrazolium,NBT)、胶质纤维酸性蛋白(GFAP)和降钙素基因相关肽(CGRP)均为Sigma;胎牛血清(北京索莱宝);ABC 试剂盒(ABC kit,美国Vector);DAB 试剂盒(北京中山金桥)。CM1950 冰冻切片机(德国Leica);BX53 荧光显微镜(日本Olympus);旷场系统设备(安徽正华生物)。
1.3 动物模型制备与分组
将48 只雄性SD 大鼠随机分为对照组、AA 组和2,5-HD 组,每组16只。AA和2,5-HD以生理盐水为溶剂进行配置,AA 组和2,5-HD 组每次给药剂量分别为AA(25 mg/kg)和2,5-己二酮(300 mg/kg),以腹腔注射方式,每周周一至周五17 点给药,每天给药1 次,连续给药10 周以建立亚急性中毒模型,对照组给予等容积的生理盐水。每周周末记录体质量,根据体质量变化调整下周给药剂量。
1.4 步态评分
将大鼠置于黑色背景的宽阔平台上,放松后使其自由活动,观察3 min,拍照、录像并进行步态评分。观测分值在1~4 之间,1 分=正常步态;2分=轻度异常步态(轻微共济失调,步态比较吃力,出现足外展);3 分=中度异常步态(有明显的共济失调,足部伸展,行走时肢体外展);4 分=重度异常步态(出现足外展,整个身体无力支撑,腹部着地)[9]。
1.5 旷场实验
运动活跃度观察采用旷场实验测试。正式实验之前,先将待测动物移入实验箱内,使其适应测试环境2 d。实验过程为:将大鼠分别置于黑色有机玻璃测试装置(50 cm×50 cm×40 cm)中,记录5 min,记录参数包括总路程、平均速度,活跃度等参数[10]。
1.6 组织取材及切片制备
实验用戊巴比妥钠(50 mg/kg)腹腔麻醉动物,打开胸腔,经左心室插管入升主动脉,先用300 mL 室温的生理盐水心内灌流,然后用4℃的含有4%多聚甲醛的0.1 mol/L 磷酸盐缓冲液(PBS,pH 7.4)进行灌流固定。在冰盒上迅速取出脑干,置于含有4%多聚甲醛的0.1 mol/L PBS 中固定8 h,然后移至25%的蔗糖溶液中24 h。对脑干做连续冠状切片(40 μm),收集在盛有PBS 的12 孔板的3个孔中,连续循环收集组织切片,薄束核切片进行NADPH-d 组织化学显色,GFAP 和CGRP 免疫组织化学显色。
1.7 NADPH-d 组织化学显色及半定量分析
每组动物随机选8 只用于NADPH-d 组织化学实验,用上述收集到的某一孔的全部薄束核节段的冠状切片于24 孔板中,用含有0.3% Triton X-100的PBS 溶液漂洗3 次,在冰上操作。切片放在含有0.3%Triton X-100,1 mg/mL NADPH-d,1 mg/mL NBT 的溶液中37℃孵育1.5~2.5 h。显微镜下观察控制染色深度,用PBS 溶液洗涤切片,适时终止反应[11]。染色后切片贴于明胶载玻片上,进行常规脱水、透明、中性树胶封片。每只大鼠随机挑选4 张具有典型薄束核结构的切片,在光学显微镜下观察,统计薄束核区域全部的NADPH-d 的阳性神经元个数和NADPH-d 阳性小体个数,并做测量和拍照。
1.8 GFAP 和CGRP 免疫组织化学显色
每只动物取4 张薄束核节段切片,用PBS 溶液漂洗3 遍,经3%过氧化氢灭活、3%胎牛血清封闭 2 h,加入小鼠源性GFAP 一 抗(1∶1 500)和CGRP 一抗(1∶200),另取少部分切片用3%胎牛血清替代一抗作阴性对照,4℃过夜。吸出一抗,PBS 溶液漂洗3 遍后加入生物素化羊抗小鼠IgG(1∶200),室温孵育45 min。吸出孵育液,PBS 溶液漂洗3 遍,加入ABC 复合物(1∶100,提前30 min 配制)室温孵育1 h,用PBS 溶液漂洗终止反应。加入DAB 显色液,反应3~5 min,显微镜下观察并适时用双蒸水终止反应,贴片、脱水、透明、封片。在20 倍物镜下,每张切片在薄束核中间区域选取4个视野,用Image J 软件测量阳性反应面积,计算均值,将均值作为该切片的阳性反应面积,并拍照。
1.9 统计学处理
采用Prism 8.0 软件进行统计学分析。Image J软件分析免疫组织化学结果,用阳性反应面积率表示。所有实验数据均以±s表示,各组计量资料与对照组比较均用t检验。
2 结果
2.1 毒素对大鼠体质量及行为学的影响
AA 组大鼠的体质量从给药3 周后增长变缓,5 周后与对照组相比体质量下降明显(P<0.01)。2,5-HD 组大鼠体质量2 周后开始增长变缓,3 周后体质量下降(P<0.05),5 周后体质量明显低于对照组(P<0.01)(图1)。实验过程中,2,5-HD 组的个别鼠在第5 周出现极度消瘦直至死亡的现象,根据以往文献报道,本实验药物剂量能引起大鼠代谢异常甚至死亡。步态评分结果显示,AA 组大鼠从4 周开始出现步态评分异常(P<0.01),给药8周后出现重度步态异常(P<0.01),双足外翻,腹部着地。而2,5-HD 大鼠在第3 周开始出现步态异常,4 周后出现重度步态异常(P<0.01),5 周后全部出现重度步态异常,双足间距增宽,后脚掌外翻,腹部着地拖行(图1)。大鼠暴露于AA 和 2,5-HD 后,均出现了严重的运动功能损伤,旷场实验结果显示,与对照组相比,AA 组大鼠5 min总路程明显偏短(P<0.01),活跃度减低(P<0.01)。2,5-HD 组大鼠5 分钟总路程与对照组比较也明显缩短(P<0.01),活跃度降低(P<0.01),有些甚至完全失去行走能力(图1)。
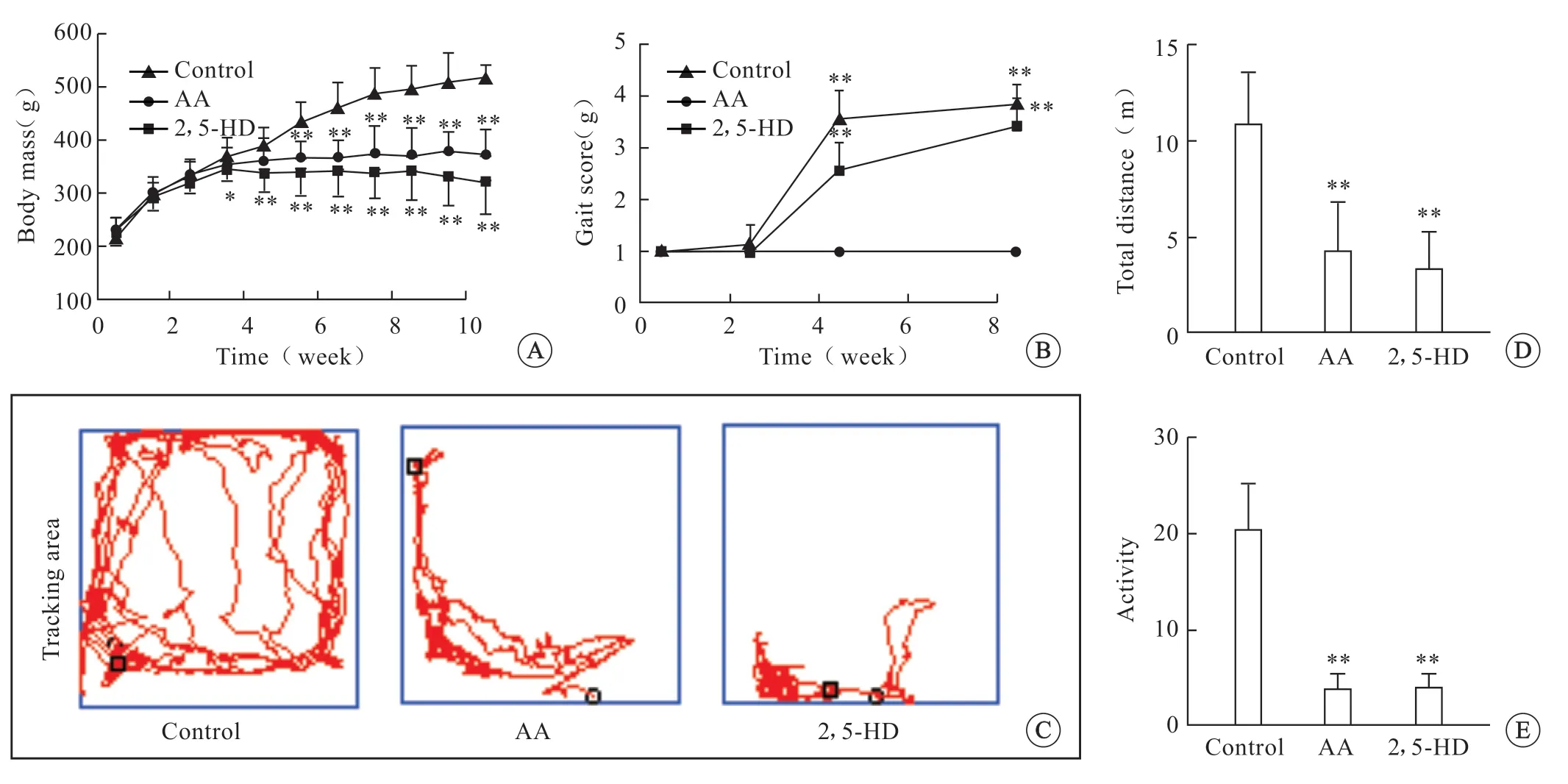
图1 体质量与行为学测量Fig1 Measurement of body mass and behavior after AA and 2,5-HD intraperitonealy injection.
2.2 毒素对大鼠薄束核区NADPH-d 组织化学反应的影响
大鼠薄束核NADPH-d 组织化学显色结果表明,与对照组相比,AA 组薄束核区NADPH-d 阳性神经元明显增加(P<0.01),NADPH-d 阳性星形胶质细胞增多,背景染色较深。另外,在AA 组,异常的NADPH-d 阳性体与对照组相比也明显增多(P<0.05)。2,5-HD 组与对照组相比,染色背景较深,NADPH-d 阳性神经元数目与对照组相比差异无统计学意义。此外,与对照组和AA 组相比,2,5-HD 组出现明显的异常NADPH-d 阳性体结构,类圆球形,染色较深,异常阳性体数目显著增加(P<0.01,图2)。
2.3 毒素对薄束核区GFAP 和CGRP 表达的影响
GFAP 是星形胶质细胞的特异性标志物。GFAP 免疫组织化学显示,对照组薄束核只有极少的星形胶质细胞,染色较浅,突起少而纤细,较多的分布在三叉神经束和延髓网状束(图中未显示)。与对照组相比,AA 组薄束核区星形胶质细胞计数增多,胞体增大而染色加深,突起增多,变粗大,呈网状,明显处于活化状态,阳性反应面积与对照组相比显著增加(P<0.01)。2,5-HD 组与AA 组类似,星形胶质细胞数明显增多(P<0.01),细胞密集,染色深,胞体较大,突起多,星形胶质细胞也处于活化状态。CGRP 免疫组织化学显示阳性染色主要存在于三叉神经束(图中未显示),各实验组与对照组在薄束核区均没有明显的阳性反应,差异无统计学意义(P>0.05,图3)。

图2 薄束核NADPH-d 组织化学染色。Fig2 NADPH-d histochemical staining of gracilis nucleus.

图3 薄束核GFAP 和CGRP 免疫组织化学显色。Fig3 Immunohistochemical staining of GFAP and CGRP in the gracile nucleus.
3 讨论
薄束核是接收来自下肢初级感觉神经元上行纤维传入的核团。大鼠注射2 种毒素后均出现后肢运动障碍,这可能与感觉神经传导通路受损有关,本研究结果显示,这2 种毒素对薄束核产生的病理改变不同。
AA组和2,5-HD组GFAP表达均明显增多,AA组中GFAP增多比2,5-HD组更加明显,GFAP是星形胶质细胞的特异性标志物,它的增多表明星形胶质细胞被活化,活化的星形胶质细胞可作为神经损伤标志[12]。本实验中AA组NADPH-d阳性神经元增加,NADPH-d组织化学被用于标记NOS阳性神经元,它与NOS阳性神经元有广泛的共定位[13]。在大鼠后肢急性疼痛模型中,后足注射福尔马林,大鼠薄束核区NOS表达增加[14]。过多的NO会导致氧化应激,胶质细胞接触过氧化物又会产生大量的NO,这样形成恶性循环,加速组织损伤[15]。从GFAP和NOS表达情况可知AA组薄束核区存在严重炎性反应。本实验中,2,5-HD组薄束核区出现明显的异常NADPH-d阳性结构。Tan等[16]研究表明在老年大鼠腰骶脊髓灰质背角、背联合核、后索会出现年龄相关性NADPHP-d阳性体,这些异常退变结构随着年龄增加而增加,并认为其可作为神经退行性变的标志;李银花[17]报道在老年狗和猴的腰骶背侧脊髓存在年龄相关性的NADPH-d阳性硕变神经纤维,这些硕变纤维也是随着年龄增大而增多增粗;贾云格[7]报道在老年鸽子和老年鼠的延髓有年龄相关性NADPH-d阳性小体,认为小体可能是神经轴突崩解形成。2,5-HD作用于大鼠出现的薄束核的这一病理改变,与以往自然衰老情况下的NADPH-d形态相似,但阳性体密度较自然衰老的稍低。
以往研究表明2,5-HD引起神经轴突运输障碍[18],使神经轴突出现肿胀和功能紊乱,轴突代谢异常,进而引起轴突发生退行性变。推测2,5-HD 可能加速了神经损伤,使神经细胞代谢紊乱引起NOS 异常聚集,使薄束核区出现年龄相关性退行性变。CGRP 是一种神经肽,主要分布于延髓、三叉神经束等,研究表明在三叉神经系统CGRP 与NO 相互作用可以调节痛敏[19];动物实验表明NO 供体可以促进三叉神经释放CGRP,并能增加三叉神经脊束核NOS 阳性神经元和CGRP 阳性神经元[20]。本实验化学毒素损伤引起的NOS 表达增多并未使薄束核区CGRP 表达出现明显变化,这可能是与其局部神经代谢有关。总之,AA 和2,5-HD 对薄束核的病理影响不同,AA 主要引起薄束核胶质细胞增生,有害性神经递质增多,产生炎症反应而损伤神经。2,5-HD 则可能使薄束核产生严重代谢障碍,从而引起神经轴突和神经元损伤,加速薄束核出现神经退行性变。
这2 种毒素对薄束核产生的病理改变具体机制还有待进一步研究。

