MALDI-TOF-MS和RT-qPCR对于SLCO1B1和ApoE多态性检测的比较
叶阿里,邹雨桐,张海燕,吴 洁,张 睿,张晓峰,马庆伟
(1.中国医学科学院 北京协和医学院 北京协和医院 检验科, 北京 100730; 2.北京毅新博创生物科技有限公司, 北京 102206)
他汀类药物(statins)是临床常用的调脂药物之一,也是预防心血管疾病风险的首选用药[1]。然而,他汀类药物的治疗效果和临床适用性存在明显的个体差异,他汀相关性肌病(statin-associated muscle symptoms,SAMS)是最普遍的他汀药物不良反应[2]。SLCO1B1编码有机阴离子转运多肽(OATP1B1),主要定位于人类肝细胞膜上,介导他汀类药物的转运[3],研究表明SLCO1B1单核苷酸多态性位点(single nucleotide polymorphism,SNP),rs2306283(388A>G)和rs4149056(521T>C) 与SAMS密切相关[4]。另一个与他汀药物疗效相关的基因是ApoE,其表达产物载脂蛋白E通过与LDL受体结合,调控胆固醇和其他脂质的转运。ApoE的SNP位点rs429358(388T>C)和rs7412 (526C>T),可构成ε3(388T-526C), ε2(388T-526T)和ε4(388C-526C) 3种单倍体,及6种基因型:ε2ε2、ε2ε3、ε2ε4、ε3ε3、ε3ε4、ε4ε4。实时荧光定量PCR(RT-qPCR)是目前临床实验室最常用的检测SLCO1B1和ApoE多态性的技术,然而该方法仅适用于个别SNP位点的检测。近年来,核酸质谱技术在基因组学领域得到了飞速发展,基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption ionization time of flight mass spectrometry, MALDI-TOF-MS)因其可同时完成多个SNP位点的检测,准确性高、成本较低等优势已逐渐成为SNP分析的新方法。本研究通过对MALDI-TOF-MS和RT-qPCR两种技术进行方法学比对,评价MALDI-TOF-MS是否能应用于临床脂质和药物代谢相关基因的检测,从而指导临床他汀类药物的使用。
1 材料与方法
1.1 材料
1.1.1 病例:选取2018年7月至2018年9月在北京协和医院就诊,临床诊断为高脂血症、高血压或动脉粥样硬化的患者71例,其中男性32例,女性39例。收取其常规检测后剩余无污染的EDTA抗凝外周血标本,用于后续基因组DNA提取和基因多态性检测。纳入者的基本信息和生化检测结果由北京协和医院临床实验室信息管理系统获取,整个分析过程进行隐私化处理。此研究经中国医学科学院北京协和医院伦理委员会批准(批准文号:S-K1108),并免除知情同意。
1.1.2 试剂及试剂盒:MALDI-TOF-MS(Clin-TOF Ⅱ)配套高血脂相关基因检测试剂盒(微阵列芯片-飞行时间质谱法)、软件分析系统(北京毅新博创生物科技有限公司);飞行时间质谱系统核酸样本纯化试剂(北京毅新博创生物科技有限公司,京经械备20190095号);人SLCO1B1和ApoE多态性检测试剂盒(PCR-荧光探针法)(武汉友芝友医疗科技有限公司,国械注准20153400245);全血基因组DNA提取试剂盒(西安天隆科技有限公司)。
1.2 方法
1.2.1 基因组DNA的提取:取200 μL EDTA-K2抗凝外周血,使用NP968全自动核酸提取仪及配套天隆全血提取试剂盒,按照说明书操作提取基因组DNA,使用Thermo MultiskanGO核酸分析仪测定提取DNA的浓度和纯度,取浓度在5 mg/L~200 mg/L,A260/280在1.7~2.0的样本用于后续实验,置-20 ℃保存。
1.2.2 MALDI-TOF-MS检测SLCO1B1和ApoE多态性:PCR扩增:PCR扩增体系包括1 μL基因组DNA、0.2 μL PCR酶、1 μL PCR缓冲液、1 μL扩增引物和1.8 μL增效剂,扩增条件为50 ℃反应2 min;95 ℃预变性2 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min, 45个循环后72 ℃持续5 min。SAP酶消化:将虾碱性磷酸酶0.5 μL及其反应液1.5 μL加入上一步的PCR扩增产物中,37 ℃保温30 min后,65 ℃保温5 min。单碱基延伸:在SAP酶消化后的产物中加入延伸反应混合物,包括0.23 μL延伸酶、0.83 μL反应液和0.94 μL延伸引物,进行延伸反应,延伸反应条件为94 ℃预变性30 s;94 ℃变性5 s,56 ℃退火5 s,80 ℃延伸5 s,内部5个循环,持续外部40个循环;最后72 ℃延伸3 min。MALDI-TOF-MS检测:延伸反应完毕后,向每PCR管/孔延伸产物中加入41 μL超纯水和15 mg飞行时间质谱系统核酸样本纯化试剂,颠倒混匀5 min完成脱盐,5 000 r/min离心1 min。取经过脱盐处理的样品点在样品靶上使之自然结晶;而后,通过MALDI-TOF-MS(Clin-TOF II)进行检测,MALDI-TOF-MS采用的是样品与基质混合进样,激光解析方式电离以及飞行时间方法进行质量分析。样本检测结果由配套分析软件检测质谱峰并判读所检测基因位点的基因型。
1.2.3 RT-qPCR检测SLCO1B1和ApoE多态性:用人SLCO1B1和ApoE多态性检测试剂盒,按照试剂盒操作说明要求配制PCR体系。简单来说,试剂盒中包括4种反应液,分别针对SLCO1B1 rs2306283 (388A>G)、rs4149056(521T>C)和ApoE rs429358(388T>C)、rs7412(526C>T) 4个基因位点,每人份需配置4个反应体系,将4种反应液分装到PCR管中,23 μL/管,再加入2 μL基因组DNA模板。在Roche LightCycler 480实时荧光定量PCR仪上完成这4个基因位点的检测。PCR反应条件为:37 ℃ 10 min;95 ℃ 5 min;95 ℃ 15 s,60 ℃ 60 s,40个循环。检测结果通过使用“Endpoint Genotyping”(终点基因分型)进行结果判读。
1.3 统计学分析
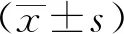
2 结果
2.1 研究对象的基因与基因型分布
71例患者包括男性32例,平均年龄为(57±13)岁,女性39例,平均年龄为(64±9)岁。分别用RT-qPCR和MALDI-TOF-MS对这71例患者的SLCO1B1 rs2306283 (388A>G)、rs4149056 (521T>C)和ApoErs429358 (388T>C)、rs7412 (526C>T) 4个基因位点进行检测(图1,2)。
2.2 两种方法检测SLCO1B1和ApoE的基因型结果的一致性(表1,2)

3 讨论
作为治疗脂代谢紊乱的一线药物,他汀类药物虽具有很好的降脂作用,但其所产生的包括他汀相关性肌病在内的副作用及治疗效果的个体差异已成为困扰临床用药的难题,这种差异被证实与基因多态性密切相关[5]。SLCO1B1 rs4149056(521T>C)和rs2306283(388A>G)多态性,ApoErs429358(388T>C)和rs7412(526C>T)多态性是种族多样化人群中普遍发生的变异,许多体外和临床研究已经评估了这些变异对个体药物配置和反应差异的影响[6-7]。
本研究中SLCO1B1 388A>G位点的基因型分布为AA(4.32%)

A.criteria for interpreting results by RT-qPCR; B.SLCO1B1 SNPs analysis; C.ApoE SNPs analysis

图2 MALDI-TOF-MS检测SLCO1B1和ApoE多态性位点
目前市场上检测SNP的商品化试剂盒多是基于RT-qPCR或基因芯片法,这些方法基于化学(荧光)方法,依赖于核苷酸的互补性对核酸序列进行分析,对序列的长度、复杂性和反应条件等具较高的要求,易受多种化学因素的影响,从而导致检测结果的偏差。MALDI-TOF-MS依赖于分子量这一物理参数,是根据核苷酸组成分子被电离后在真空管中的飞行时间来确定其分子量大小,最终确定核苷酸序列。此外,RT-qPCR技术只适用于对有限的基因位点进行检测,MALDI-TOF-MS可在同一反应体系中对多个SNP位点进行多重检测和分析,可大幅提高检测通量和效率,是对现有RT-qPCR的重要补充。本研究发现,虽然MALDI-TOF-MS与RT-qPCR两种方法在检测结果上具高度一致性,但有1例样本出现差异,MS复检时得到与RT-qPCR一致的结果,说明重复检测可提高MALDI-TOF-MS的准确性,建议在实际应用中针对每个样本设立3个重复检测。
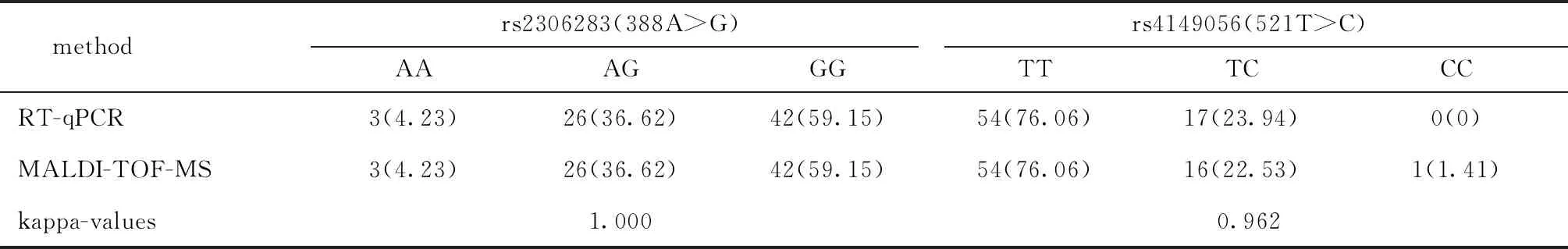
表1 研究对象SLCO1B1的基因型分布
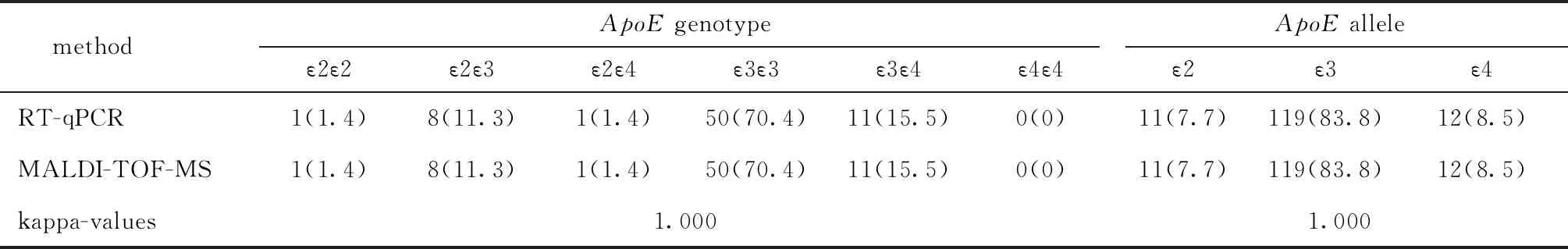
表2 研究对象ApoE基因型及等位基因的分布
本研究首次建立了MALDI-TOF-MS对于SLCO1B1和ApoE常见多态性位点的检测方法,并与RT-qPCR技术进行比较,结果表明MALDI-TOF-MS与RT-QPCR的检测结果有较好的一致性。综上所述,MALDI-TOF-MS技术可应用于脂质和药物代谢相关基因检测,其临床适用性仍需结合临床具体用药情况和个体化的反应进一步分析。

