隐球菌性脑炎合并抗N-甲基-D-天冬氨酸受体脑炎一例
刘东明,许宏伟,易 芳
中南大学湘雅医院老年神经科,长沙 410008
隐球菌性脑炎和抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)脑炎是两种不同的疾病,前者是一种致命的中枢神经系统感染性疾病,免疫缺陷者易感,如艾滋病、肾病综合征、系统性红斑狼疮等;后者则是发生在人体组织内的一种以精神、行为异常、痫性发作及运动障碍为主要表现的自身免疫性疾病。两种疾病的病理及发病机制完全不同,但都能导致认知功能障碍及精神行为异常,而抗NMDAR脑炎也可以情绪及精神障碍为核心表现,目前尚未见这两种疾病共存的报道。中南大学湘雅医院于2018年10月16日至11月14日收治了1例肾病综合征患者,同时合并隐球菌性脑炎和抗NMDAR脑炎,现报道如下。
临床资料
患者,男,49岁,因反复头痛、发热2月余,左侧肢体乏力4 d于2018年10月16日收入我科。患者自2018年8月份开始反复出现头痛、发热,曾多次在当地医院就诊,按照上呼吸道感染治疗。入院前4 d再发头痛、发热,伴左侧肢体乏力,同时反应迟钝、精神倦怠、焦虑抑郁、间歇性精神行为异常,如睡在大街上,幻觉及胡言乱语,性格变得幼稚、多疑,认为医生护士想加害他,不愿配合治疗及检查。患者既往于2018年1月在当地医院临床诊断肾病综合征,一直口服泼尼松治疗。入院神经系统查体示神清,懒言,检查欠配合,理解力、计算力、时间定向力及近记忆力下降,左上肢肌力5-,余未见明显异常。大学学历,简易精神状态检查量表(Mini-mental State Examination,MMSE)评分为22分。腰椎穿刺压力为195mmH2O(1mmH2O=0.0098 kPa)。脑脊液常规:白细胞数 78×106/ml,多核细胞0.7,单核细胞0.3;脑脊液生化:葡萄糖 0.27 mmol/L(同步血糖5.77 mmol/L),氯111.6 mmol/L(同步血氯95.8 mmol/L)。脑脊液隐球菌荚膜抗原检测及墨汁染色均阳性,脑脊液真菌培养示真菌孢子-新型隐球菌。脑电图示普遍慢波。头部MRI示双侧基底节区、双侧海马等部位异常信号,脑膜未见明显强化(图1)。故诊断为隐球菌性脑炎。同时外送血清及脑脊液自身免疫性脑炎抗体检测示血清及脑脊液抗NMDAR抗体均阳性(图2),其中脑脊液1∶32(+++),血清1∶32(++)。血清及脑脊液寡克隆带显示为2型,即仅有脑脊液中存在寡克隆带(IgG比率为8.71>0.7)。结合患者认知障碍、精神行为异常等临床表现,诊断为抗NMDAR脑炎。采用两性霉素B联合氟康唑注射液抗真菌治疗同时,予以丙种球蛋白(25 g/d,连续5 d)抗NMDAR脑炎治疗。在完成1个疗程丙种球蛋白治疗后,该患者的认知功能障碍、情绪及精神症状较前均明显改善,对医生的治疗也更加配合。继续治疗至病情稳定,并多次复查脑脊液真菌培养阴性后,于2018年11月14日转入当地医院继续抗真菌治疗。半年后随访,患者因急性肾功能衰竭死亡。
讨 论
2015年,Piola等[1]曾报道1例隐球菌性脑膜炎同时怀疑合并有抗NMDAR脑炎的病例,但仅仅因为脑电图发现刷,没有抗体的支持,该病例抗NMDAR脑炎的诊断并未明确。因此,本例患者是迄今为止首次在免疫缺陷患者中发现同时合并隐球菌性脑炎及抗NMDAR脑炎的病例。
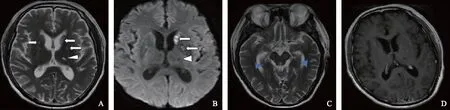
A.T2WI显示双侧基底节区胶样囊肿高信号(箭头)和扩大的血管周围间隙(白色三角形);B.DWI显示胶样囊肿(箭头)和扩大的血管周围间隙(白色三角形);C.双侧海马区可见T2WI高信号(蓝色三角形);D.头部增强MRI未见明显异常
A.axial T2-weighted MRI reveals a hypertense gelatinous pseudocysts(arrowheads)and perivascular gaps(white triangle)in both sides;B.axial diffusion-weighted MRI shows gelatinous pseudocysts(arrowheads)and perivascular gaps(white triangle)in both sides;C.axial T2-weighted MRI reveals hypertense signals in the bilateral hippocampus(blue triangles);D.axial contrast-enhanced T1-weighted MRI shows no obvious enhancement
图1头部核磁共振
Fig1Brain magnetic resonance imaging
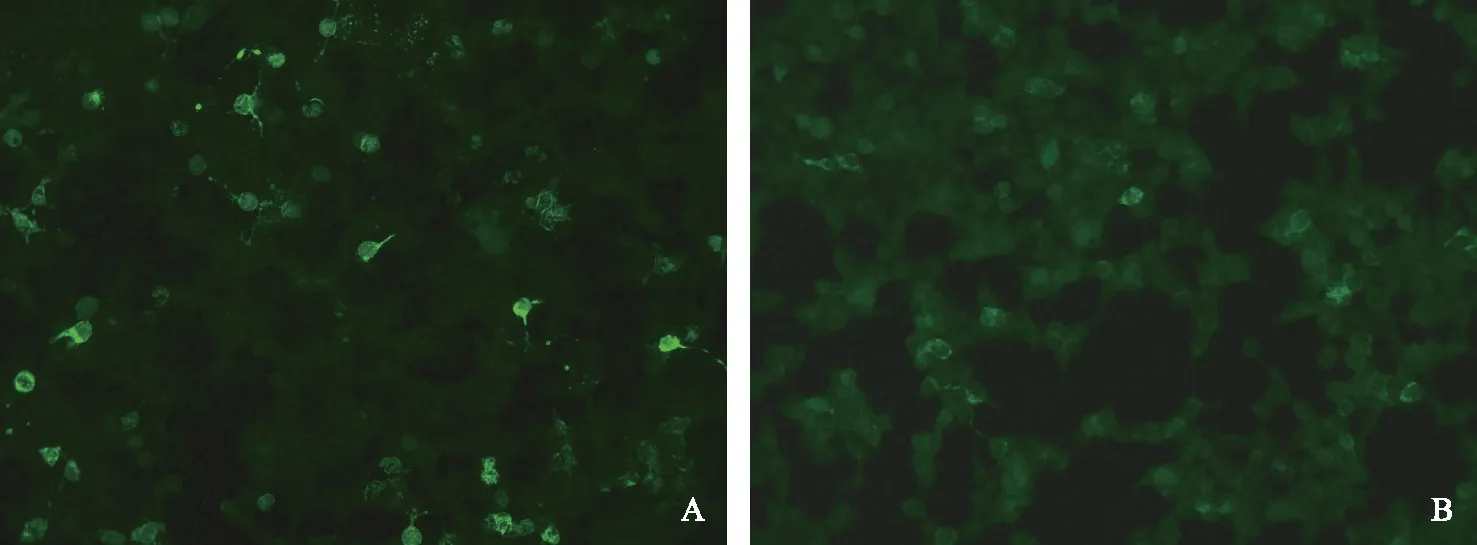
NMDAR:N-甲基-D天冬氨酸受体
NMDAR:N-methyl-D-aspartate receptor
A.脑脊液抗NMDAR抗体阳性(CBA法);B.血清抗NMDAR抗体阳性(CBA法)
A.positive anti-NMDAR antibodies in the cerebrospinal fluid(by cell-based assay);B.positive anti-NMDAR antibodies in the serum(by cell-based assay)
图2血清及脑脊液抗体检测结果(间接免疫荧光法)
Fig2Positive anti-NMDA antibodies in serum and cerebrospinal fluid(indirect immunofluorescence assay)
根据抗NMDAR脑炎诊断标准,必须有6大典型临床表现的1项或多项,有抗体阳性,同时必须排除其他可能的疾病[2]。本例患者存在认知功能下降、情绪障碍及精神异常表现,血清及脑脊液抗NMDAR抗体均有意义增高,使用丙球治疗1个疗程后,上述症状即较前明显好转,因此我们认为抗NMDAR脑炎的诊断明确。同时根据脑脊液培养结果及典型头部MRI表现,隐球菌性脑炎的诊断也明确。然而,目前我们仍难以区分这两种疾病发生的先后顺序及两者之间是否存在因果关系。
2007年,Josep等[3]首次报道抗NMDAR脑炎好发于伴有卵巢畸胎瘤的女性副肿瘤综合征中。而后研究发现,抗NMDAR脑炎不仅存在于不伴肿瘤的其他人群[4-5],且更可能与多种感染性疾病相关,如单纯疱疹病毒(herpes simplex virus,HSV)脑炎、寄生虫感染、蜱传性脑炎、流感、人类免疫缺陷病毒、腮腺炎、支原体肺炎及肠道病毒等其他病毒性脑炎[6-10]。抗NMDAR脑炎是自身免疫性脑炎的一种亚型,其作用机制是通过体液免疫引起相对可逆的神经功能障碍,其靶抗原位于神经元表面,免疫治疗有效[2,11]。目前,对于感染与抗NMDAR脑炎并存现象,许多研究趋向于认为是感染后触发机体自身免疫反应,可能的机制有以下2种:(1)分子模拟:病原体蛋白质触发免疫反应,该免疫反应对NMDAR存在的相似结构错误定向,诱发抗NMDAR脑炎。该假设被认为更符合合并肿瘤的抗NMDAR脑炎的发病机制,因为肿瘤可模仿表达抗NMDAR表位。(2)感染性炎症破坏了边缘结构,然后释放并向免疫系统表达大量局部NMDAR表位,启动自身免疫反应。最近有文献指出,非副肿瘤性抗NMDAR脑炎的病因与感染后免疫介导相关[12-13];在HSV感染后的抗NMDAR脑炎患者中也发现,NMDAR抗体可与NR1a和NR2b亚单位(而不仅仅是NR1a亚单位)的转染细胞反应,提示HSV感染后的抗NMDAR脑炎患者比经典抗NMDAR脑炎综合征表现出更广泛的抗体谱[14]。因此第2种机制也可能是使其他突触或神经元细胞表面抗体出现而导致相关综合征的原因之一[15]。由此推测,未来可能不仅发现越来越多感染性疾病可诱发抗NMDAR脑炎,而且也可能引起自身免疫性脑炎的其他类型。
综上,我们的报道首次证实,隐球菌性脑炎和抗NMDAR脑炎可以共存于同一患者,并推测其原因可能与其他感染后诱发抗NMDAR脑炎的机制类似,但需要更多的病例及研究来证实。该病例可为未来进一步研究提供方向,同时也提示临床医生在诊治过程中需警惕颅内感染尤其合并免疫缺陷患者合并自身免疫性脑炎的可能,从而减少漏诊率,提高治愈率。

