滤泡调节性T细胞在眼肌型重症肌无力中的研究进展
吴 娜,胡裕翔,许晓璇,晏 立,程 艺,饶 杰,吴雅俊,吴晓蓉
南昌大学第一附属医院眼科,南昌 330006
重症肌无力(myasthenia gravis,MG)是一种由抗乙酰胆碱受体特异性抗体(acetylcholine receptor antibody,AchR-Ab)介导、细胞免疫依赖以及补体系统参与的获得性自身免疫性疾病,主要造成神经肌肉接头(neuromuscular junction,NMJ)突触后膜乙酰胆碱受体(acetylcholine receptor,AchR)的损害而产生肌无力的症状。MG在任何年龄段均可发病,普通人群中发病率高达(8~20)/10万人,经过免疫治疗可以得到长期缓解,但易复发且部分患者合并一定的残留症状[1]。眼外肌是MG最常受累的肌群,约20%的MG患者临床症状和体征仅局限于眼外肌,即单纯眼肌型重症肌无力(ocular myasthenia gravis,OMG),表现为非对称性的上睑下垂、双眼复视和/或斜视。50%~70%的OMG患者肌无力症状可逐渐累及骨骼肌系统,最终发展为全身型MG(generalized masthenia gravis,GMG),几乎所有患者均需长期用药缓解,10%~15%患者不可完全控制症状,影响了患者的生活与生存质量[2]。OMG发病与免疫系统失衡直接相关,而滤泡调节性T细胞(follicular regulatory T cells,Tfr)是新发现的一类具有维持免疫系统稳态功能的Foxp3+调节性T细胞(regulatory T cell,Treg)亚群。本文主要介绍了Tfr细胞及其相关免疫因子表达与OMG发病之间关系的研究进展。
Tfr细胞概述
Tfr细胞的起源与分化Tfr细胞起源于CD25+Foxp3+Treg细胞而位于生发中心(germinal center,GC)[3]。研究显示,在小鼠和人类生发中心存在一类表达Bcl-6和CXCR5的Treg细胞亚群,而后在人类扁桃体的滤泡间区域中发现并确定该细胞亚群为Tfr细胞[4-6]。对Tfr细胞与GC之间关联的研究证实,Tfr细胞并非来源于胸腺,该细胞可起源于Treg细胞[5,7]。Tfr细胞分化的早期阶段,部分表达Bcl-6的Treg细胞在接收抗原提呈树突状细胞(dendritic cells,DC)刺激信号后,可触发Bcl6-CXCR5轴反应,使其在获得CXCR5表型过程中逐渐分化为Tfr细胞[7-8],而早期分化的Tfr细胞在趋化因子CXCL13(CXCR5配体)诱导下,逐渐迁移至GC淋巴滤泡并发挥其免疫抑制功能。在这一过程中,程序性死亡受体1(programmed death receptor 1,PD-1)以及其他细胞因子受体可能通过与相应配体的结合[7,9],共同激活Treg细胞向Tfr细胞的分化(图1)。
Tfr细胞的表达特性及免疫作用Tfr细胞在表达特性上与滤泡辅助性T细胞(follicular helper T cells,Tfh)具有一定相似性。Tfh细胞是一种表型特征为CXCR5+ICOShi的CD4+T效应细胞亚群,因高表达CXCR5+而可被募集于GC,其特异性表达Bcl-6、白细胞介素(interleukin,IL)-21以及PD-1等其他因子,可在GC中辅助B细胞增殖分化为高亲和力B细胞和长寿浆细胞,进而促进B细胞生成大量免疫球蛋白[10]。目前已有许多研究发现,Tfh细胞及GC-B细胞在重症肌无力的发生发展中发挥着重要作用[11]。与Tfh细胞类似,Tfr细胞也可表达高水平的CXCR5、PD-1、可诱导共刺激分子(inducible costimulatory molecule,ICOS)以及经典的Tfh细胞转录因子Bcl-6,尽管其水平低于Tfh细胞[12-13]。Tfr和Tfh细胞相似的表达特性决定了它们可共同定位于GC。然而,Tfr细胞起源于天然Treg前体,其本质为Treg细胞亚群,因而Tfr细胞表面也可高表达典型的Treg细胞相关标记而区分于Tfh细胞,例如Foxp3+、糖皮质激素诱导肿瘤坏死因子受体(glucocorticoid-induced tumor necrosis factor receptor,GITR)、Blimp-1、细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)、IL-10等。Tfr细胞具有显著的类似于Treg细胞的调节功能,进而参与体内的免疫反应[5,14]。因此,Tfr细胞具有Treg细胞及Tfh细胞的双重特性。
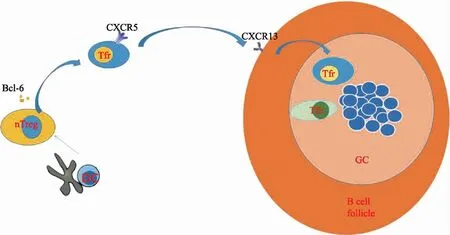
图1滤泡调节性T细胞起源分化图
Fig1Origin and differentiation of follicular regulatory T cells
此外,成熟的Tfr细胞在GC中发挥着负性免疫调控作用,能够有效直接抑制GC-Tfh细胞的数量、活性和对B细胞成熟的辅助效应,抑制GC-B细胞的增殖分化和致病性抗体的分泌,包括抗原特异性IgM、IgA和IgG以及OMG的致病抗原AchR-Ab等,进而抑制各类相关抗体介导的免疫应答,具有维持免疫耐受平衡作用[15]。最近研究表明,这种负反馈调节对于适当的GC反应是必需的,若Tfr细胞的数量降低或功能减弱则可导致GC反应增强,OMG致病抗原AchR-Ab所介导的体液反应也将随之增强,这是导致OMG等免疫介导疾病的发生机制之一[16]。
Tfr细胞与OMG的联系
Tfr细胞在OMG和GMG患者中的表达情况多项研究表明,Tfr细胞和Tfh细胞在MG患者外周血中表达失衡。Wen等[17]在一项关于MG中循环Tfr与Tfh细胞失衡的研究发现,与健康对照组相比,循环Tfr细胞在MG患者外周血中的表达比例下降,而Tfh细胞表达比例则显著升高;Tfr/Tfh细胞比例与QMGs评分测量的MG严重程度呈显著负相关,表明Tfr细胞的比例降低、Tfh细胞的增多与MG的发病有一定关系,且Tfr/Tfh细胞比例变化或参与调控了MG发病进程。阳柏凤[8]在研究治疗前后MG患者外周血中Tfr细胞和Tfh细胞的表达比例时验证了这种关联,激素治疗前MG患者的Tfr细胞比例明显低于健康者,Tfh细胞比例却高于健康者;激素治疗后Tfr细胞的表达较治疗前增多,Tfh则较之前减少,该结果表明Tfr细胞比例降低、Tfh比例增多在MG发病中确有一定作用,且这种比例变化可随患者病情缓解而恢复。OMG为MG的一种亚型,Zhao等[18]研究发现,与OMG和健康对照组相比较,Tfr细胞表达数量在健康对照组最高,OMG次之,GMG中最低;相反,Tfh细胞的表达数量在GMG中最高,OMG次之,对照组中最低;同时,Tfr/Tfh细胞的比值异常在对照组中较高,其次是OMG患者,在GMG患者中表达最低。该结果提示Tfr和Tfh细胞在GMG和OMG的发生机制中均有一定作用,且该作用与MG的严重程度和进展相关,或可为GMG和OMG的治疗方案提供新思路。以上数据均显示OMG和GMG患者Tfr/Tfh细胞表达异常,该异常可能在OMG和GMG免疫反应中发挥重要作用,而这种异常表达的发生机制尚不完全清楚。另外在实验性自身免疫性MG动物模型(experimental autoimmune myasthenia gravis,EAMG)发病过程中,显示Tfh细胞的频率增加,Tfr细胞的频率降低;且干预结果表明,通过改变Tfr细胞和Tfh细胞的数量或频率可以减轻自身免疫性疾病的严重程度,提示Tfr和Tfh细胞平衡表达对维持正常免疫功能以及免疫耐受等过程具有重要作用,其比值失衡可能参与MG的发病[19]。
Tfr细胞在OMG中可能的作用机制
Tfr细胞相关表达因子的作用:Tfr细胞表达的多种因子均在免疫反应中具有重要作用,其表达因子失衡亦可引起OMG的发生。Tfr细胞的表达结合了Treg及Tfh细胞的双重特性,既可表达Foxp3、CTLA-4,也同时表达CXCR5、PD-1、ICOS以及Bcl-6、Blimp-1等因子[12,20]。其中,Foxp3被认为是Treg细胞的标志性分子,其在控制GC反应和调节机体免疫自稳中具有关键作用,Foxp3基因突变可引起机体的免疫失调和紊乱,导致严重的自身免疫性疾病[5]。而OMG患者外周血中Foxp3+表达的缺陷可能是其免疫异常的机制之一。通过磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)传递的ICOS信号可促进Foxp3转录,有利于Treg和Tfr细胞的抑制功能[21]。Tfr细胞表达的Bcl-6为Tfh细胞的特征性转录因子,其在Tfh细胞迁移至GC过程中具有辅助作用;同时Tfr细胞的发育也有赖于的Bcl-6-CXCR5轴的驱动,Bcl-6缺陷将导致Tfr细胞功能完全缺失[5],Tfr细胞对GC反应的抑制作用也将解除,而过度的GC反应可能为OMG发病的诱因。此外,转录因子Blimp-1具有诱导成熟B细胞向浆细胞分化的功能,可维持浆细胞表达及抗体分泌,是引起自身免疫性疾病的危险因素[22]。Tfr细胞还可高表达Tfh细胞一样的趋化受体CXCR5,因而Tfr细胞在趋化因子CXCL13(CXCR5配体)的诱导下迁移至GC,进而在GC中对Tfh细胞和GC-B细胞发挥抑制作用,从而维持机体免疫自稳。CTLA-4是Tfr细胞发挥抑制功能的重要介质,缺乏CTLA-4的Tfr细胞将减弱对B细胞抗体生成过程的抑制能力。与之相反的是,Tfr细胞可被高水平的PD-1抑制,PD-1缺陷的Tfr细胞却会使其抑制能力提高[12]。同时,PD-1为重要的免疫抑制分子,是一种主要由T细胞表达的Ⅰ型表面跨膜蛋白受体,PD-1与其配体PD-L1或PD-L2的结合抑制了GC中Tfh的活化,进而抑制GC-B细胞的增殖分化[23]。PD-1功能受损时,将引起Tfh细胞异常活化以及抗原特异性B细胞激活和抗体产生[24],并可能诱导OMG的发生。
Tfr细胞通过调控GC在OMG发病中的作用机制:研究发现,Tfr细胞可通过限制GC反应而抑制抗体的产生,从而阻断自身免疫病的发生[25]。GC是次级淋巴组织淋巴滤泡中针对抗原刺激而不断增殖形成的特殊结构,是免疫反应过程中抗原特异性B细胞增殖活化和抗体亲和力成熟的场所。抗体反应起源于GC[12],而AchR-Ab介导的体液免疫是OMG发病的关键机制。研究发现,MG患者体内出现增强的GC-B细胞反应,表现为体液和肌肉接头内存在大量自身反应性抗体,表明GC反应增强引起的免疫效应增强、自身抗体分泌增多可能为致使OMG发生和发展的重要原因之一。
近年研究发现,Tfr细胞对GC反应具有抑制作用。GC是Tfh细胞、抗原特异性B细胞以及特异性滤泡树突状细胞相互作用的主要场所,特异性AChR抗体的产生有赖于活化的Tfh细胞与特异性B细胞之间的免疫协作。Tfr细胞对Tfh细胞的数量和B细胞的分化成熟均有抑制作用,进而能有效限制GC反应的进展以及抑制抗体的分泌。因而,OMG患者GC反应增强可能与患者体内Tfr比例下降有着直接的联系。在研究Tfr细胞对GC-B细胞及浆细胞影响的实验中,研究者在去功能性Tfr细胞的小鼠上进行过继转移,结果表明功能性Tfr细胞的丧失导致血清中特异性抗体水平升高,GC-B细胞增加,抗原特异性B细胞和浆细胞增加,原因在于Tfr细胞的缺失解除对GC反应的抑制作用,克隆性抗原特异性B细胞和抗体分泌也随之增加。亦有大量研究通过体外抑制测定和体内Tfr过继转移测定方法,证实了Tfr细胞对GC反应的这种关键抑制功能[19-20,26]。关于Tfr细胞在MG中作用的多项研究结果均显示,Tfr细胞在OMG患者外周血中的表达数量减少且与病情严重程度负相关,其内在机制可能是Tfr细胞表达的减弱促进了GC反应,增强的GC反应致使OMG发生与发展,Tfr细胞的表达能力越弱,对GC反应的调节则越不可控,病情则越严重[8,27]。
Tfr细胞对Tfh、B细胞的调节作用与OMG的关联:Tfh细胞主要功能是通过直接作用或分泌细胞因子来辅助B细胞的成熟和GC反应,导致高亲和力抗体的产生,而Tfr细胞对Tfh细胞具有抑制功能,进而维持免疫平衡。Tfr细胞可通过影响Tfh细胞中某些细胞因子的表达从而抑制Tfh细胞的活化,进而可影响Tfh细胞与B细胞在GC中的相互作用,导致相应的抗体生成减少[14]。Bcl-6基因敲除小鼠的脾脏Tfr细胞表达明显下调,导致IL-10、IL-21、γ-干扰素等因子的分泌显著增加,血清IgG抗体下降,IgA抗体升高[28]。同样的,0MG外周血中Tfr细胞表达频率减弱而Tfh细胞的表达频率增强,其可能原因是Tfr细胞表达减弱使Tfh细胞的活化相对增强,进而引起免疫亢进致使疾病发生。
综上,随着对OMG的研究深入,人们发现Tfr细胞与OMG发病也有着密切联系。Tfr细胞因表达CXCR5而进入GC,却对GC中Tfh细胞及B细胞的免疫反应起着关键抑制作用,进而抑制致病性抗体的分泌。Tfr细胞的表达减弱可能是包括OMG在内的免疫性疾病发生的重要原因之一,其具体免疫学机制仍有待进一步阐明。因此,深入阐述Tfr细胞表型、功能及相关免疫学因素与OMG发生发展的内在联系,将为OMG的更有针对性的靶点治疗提供新的思路和理论依据。

