小鼠胚胎玻璃化冷冻方法的改进研究
高 妍,郝金栋,袁 宝,姜 昊,陈承祯,张嘉保
(吉林大学 动物科学学院,长春 130062)
虽然胚胎玻璃化冷冻技术已趋于成熟和稳定,但降低冷冻损伤、简化操作步骤、提高冷冻效率仍是当前研究的热点。1970年,研究人员在深海鱼的血清中发现了抗冻蛋白[1],这种蛋白能通过非共价吸附到冰核表面,抑制冰晶生成和重结晶,减少机体因结冰引起的损害[2]。抗冻蛋白已经广泛应用到食品加工[3]、农作物抗冻[4]、胚胎以及精液冷冻[5]中,并取得了良好的抗冻效果。抗冻蛋白Ⅲ(AFPⅢ)是一种主要存在于绵尉亚科鱼类的球蛋白,其亲水残基的氢键与冰晶有较好的结合力,可以减少降温过程中冰晶的生成而起到冷冻保护作用。试验将AFPⅢ应用于小鼠囊胚玻璃化冷冻,并采用两步、三步解冻法解冻,观察冷冻效果,为改良玻璃化冷冻方法、提高冷冻效率奠定基础。
1 材料与方法
1.1 试验动物
SPF级雌性ICR小鼠30只、雄性ICR小鼠10只,饲养于吉林大学实验动物中心[SCXK(吉)2016-0001]。饲养环境温度为25℃,相对湿度为50%~60%,每日光照12 h。试验设计获得吉林大学实验动物伦理委员会批准,严格按照动物使用指南进行并给予试验动物人道主义关怀。
1.2 主要试剂与仪器、用品
AFPⅢ,购自A/F Protein Inc公司;胎牛血清(FBS),购自Gibco公司;孕马血清(PMSG)和人绒毛膜促性腺激素(hCG),购自宁波第二激素厂;蔗糖、聚蔗糖、乙二醇(EG)、二甲基亚砜(DMSO)、M16培养液、M2操作液,均购自Sigma公司;CO2恒温培养箱,购自Thermo Fisher公司;小鼠取卵手术器械,购自上海医疗器械有限公司手术器械厂;胚胎冷冻管,购自青岛益然生物科技有限公司;液氮罐,购自河南天驰仪器设备有限公司。以上仪器及设备由吉林大学动物科学学院模式动物实验室提供。
1.3 试验步骤及方法
1.3.1 小鼠胚胎的获取与培养 取10只7周龄的ICR雌鼠,腹腔注射10 IU PMSG,48 h后注射10 IU hCG,与雄鼠合笼过夜。次日早晨检查阴道栓,将有阴道栓的雌鼠取出单独饲养,注射hCG,48 h后颈椎脱臼处死。用灭菌的手术器械取出雌鼠输卵管,用1 mL注射器划破,用口吸管收集2细胞期胚胎,转移至提前平衡的M16培养液滴中,置于37℃、5% CO2培养箱中培养,发育至囊胚期,用于冷冻试验。
1.3.2 玻璃化冷冻液和解冻液的配制 基础液(FS):10%胎牛血清(FBS)+90%杜氏磷酸盐缓冲液(dPBS)+30%聚蔗糖 +0.5 mol/L蔗糖。预平衡液:10% EG+10% DMSO。玻璃化冷冻液:EFS30为70% FS+30% EG,EFS40为60% FS+40% EG;EFSA30为EFS30+500 ng/mL AFPⅢ,EFSA40为EFS40+500 ng/mL AFPⅢ。解冻液1:含0.5 mol/L蔗糖的M2操作液;解冻液2:含0.25 mol/L蔗糖的M2操作液。
1.3.3 胚胎玻璃化冷冻 将囊胚分为4组,分别以EFS30、EFS40、EFSA30和EFSA40为冷冻液对小鼠囊胚进行玻璃化冷冻。具体方法:将准备好的囊胚用预平衡液处理5 min后,再用冷冻液处理1 min,然后按照图1步骤将胚胎装入0.25 mL细管中,直接投入液氮中保存。将冷冻后的胚胎用两步法进行解冻,统计每组胚胎解冻后的存活数和孵化数,计算存活率和孵化率。
1.3.4 胚胎的解冻及培养 用冷冻效果较好的冷冻液对胚胎进行玻璃化冷冻,然后将冷冻的胚胎分为2组,分别用两步法和三步法解冻。具体方法:将冷冻细管从液氮中取出,放入37℃水浴。待管中溶液溶解后剪掉封口端,推动棉栓使管中内容物流入解冻液中,在体视显微镜下回收胚胎。两步法是将回收的胚胎先移入解冻液1中复苏5 min,再移入新鲜的M16培养液复苏5 min;三步法是将回收的胚胎先移入解冻液1中复苏3 min,再移入解冻液2中复苏3 min,最后移入新鲜的M16培养液复苏3 min。解冻后的胚胎移入平衡好的M16培养液滴中,于37℃、5% CO2培养箱中培养,统计每组胚胎解冻后的存活数和孵化数,计算存活率和孵化率。
1.4 数据的统计分析
试验数据采用SPSS19.0软件进行统计分析,进行单因素方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 AFPⅢ对胚胎玻璃化冷冻效果的影响
结果见表1。
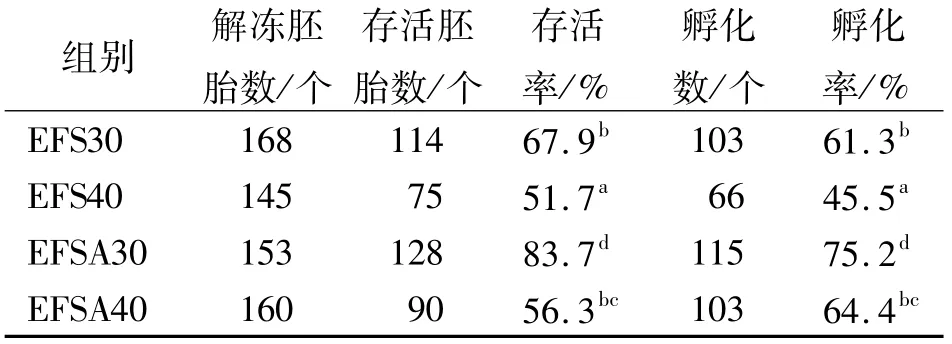
表1 小鼠囊胚玻璃化冷冻存活率和孵化率测定结果
由表1可以看出:EFSA30组存活率和孵化率分别为83.7%和75.2%,显著高于EFS30组(P<0.05);EFSA40组存活率和孵化率分别为56.3%和64.4%,显著高于EFS40组(P<0.05);EFSA30组存活率和孵化率显著高于EFSA40组(P<0.05)。说明AFPⅢ可以提高冷冻胚胎的存活率和孵化率。由于冷冻液EFSA30的效果好于EFSA40,遂选用EFSA30进行下一步试验。
2.2 不同解冻方法对胚胎冷冻效果的影响
结果见表2。

表2 两种方法解冻后小鼠囊胚玻璃化冷冻存活率和孵化率测定结果
由表2可以看出,用三步法解冻后,囊胚存活率和孵化率分别为92.8%和83.3%,显著高于两步法(P<0.05)。说明用冷冻液EFSA30对囊胚进行玻璃化冷冻后,用三步法解冻可以获得更多存活的胚胎。
3 讨论
3.1 AFPⅢ对胚胎玻璃化冷冻效果的影响
自玻璃化冷冻胚胎技术成功以来,人们一直为改进冷冻方法和冷冻液的配方做着不断的研究[6-8]。EFS30和EFS40冷冻液是在基础冷冻液中添加聚蔗糖作为冷冻保护剂,目前已经被广泛应用于小鼠胚胎的玻璃化冷冻中。传统的冷冻保护剂主要是一些人工合成的化学物品,而抗冻蛋白是存在于自然界中具有提高生物抗冻能力的蛋白质,它的发现为冷冻液的改良提供了新的思路。抗冻蛋白生物来源主要有鱼类[9]、植物类[10]、昆虫类[11]和微生物类[12]四种,其中鱼类抗冻蛋白由于发现较早,研究相对较多。AFPⅢ是鱼类抗冻蛋白中的一种,已经被证明可以应用于胚胎冷冻[13]。本试验结果表明,在传统冷冻液中添加AFPⅢ后,EFSA30组冷冻囊胚解冻后的存活率和孵化率为83.7%和75.2%,显著高于EFS30组(67.9%和61.3%)。EFSA40组冷冻囊胚解冻后的存活率和孵化率为56.3%和64.4%,显著高于EFS40组(51.7%和45.5%)。因此,AFPⅢ可以作为一种良好的保护剂用以提高胚胎玻璃化冷冻效率。
3.2 解冻方法对胚胎玻璃化冷冻效果的影响
在以往研究中发现,采用一步冷冻法,胚胎瞬间进入高渗的冷冻液,急剧脱水会对胚胎结构造成损害,因此两步冷冻法比一步冷冻法的冷冻效果好[14-15]。而在解冻方面却存在不同观点,不同实验室对两步法和三步法解冻各有偏好。此外,胚胎玻璃化冷冻效果还与冷冻时胚胎所处发育阶段有关,不同发育时期的胚胎应该选用适合该阶段的冷冻配方和方法[16-18]。本试验结果表明,在EFS30中添加AFPⅢ后,用三步法解冻玻璃化冷冻的囊胚存活率和孵化率显著高于两步法。这可能与三步法中多梯度溶液的缓冲作用有关。然而三步法是否适用于其他发育阶段的胚胎冷冻,还需要进一步研究探索。
4 结论
在冷冻液中添加AFPⅢ可以有效提高小鼠囊胚的玻璃化冷冻效果。此外,相对于两步解冻法,三步解冻法更适合于囊胚阶段胚胎玻璃化冷冻后的解冻过程,这为胚胎玻璃化冷冻方法的改进提供了新的思路和参考依据。

