3 株链霉菌对谷子早期白发病的防治作用
陈杰,杨珍平,夏清,陈昆仑,高志强,韩彦卿,韩渊怀,林文
(山西农业大学农学院,山西太谷030801)
白发病是一种由禾生指梗霉(Sclerospora graminicola)引起的系统性真菌病害,在全球谷子(Setaria italica)产区均有发生,发病率高达50%,造成谷子产量损失达30%之多[1]。目前,谷子白发病的防治措施主要有化学药剂防除[2,3]、轮作倒茬[4]、选用抗病品种[5]等。随着白发病对谷子造成的危害逐渐增加,寻找安全有效的防治手段仍是谷子白发病的研究热点。
利用微生物防治谷类白发病的措施是可行的。目前,谷类白发病生防真菌和细菌均有相关报道。真菌中的钩状木霉(Trichoderma hamatum)和棘孢木霉(Trichoderma asperellum)可增强珍珠粟(Pennisetum glaucum)对白发病的抗性[6,7],土壤真菌中的草酸青霉(Penicillium oxalicum)和黄连青霉(Penicillium chrysogenum)在降低白发病发病率的同时也促进了珍珠粟的生长[8,9]。细菌中的荧光假单胞菌(Pseudomonas fluorescens)UOM SAR 14 和UOM SAR 80 浸种处理能够降低白发病的病情并促进珍珠粟的生长[10],短小芽胞杆菌(Bacillus pumilus)INR7、SE34 和 枯 草 芽孢杆菌(Bacillus subtilis)GB03 对珍珠粟白发病也均有一定防治效果[11~13]。目前,谷类白发病生防放线菌的研究较少,仅Jogaiah 等[14]报道珍珠粟的根内生放线菌灰色链霉菌(Streptomyces griseus)SJ_UO M-07-09 和链孢囊菌(Streptosporangium roseum)SJ_UOM-18-09 能够抑制白发病病菌孢子囊的形成,然而,这些放线菌对谷子白发病的实际防除效果尚不明确。
土壤中或种子表面携带的卵孢子是病原菌的主要来源。白发病菌首先在地下侵染种子幼芽,进而引起整株发病,因而白发病也属于土传真菌病害。土壤放线菌尤其是链霉菌具有防治植物土传真菌病害的能力[15~17]。这类对土传病害有防除作用的链霉菌也可能具有防治谷子白发病的潜能。因此,本研究以来源于健康土壤中对多种作物具有抗病促生作用的黄白链霉菌(Streptomyces albidoflavus)T4、密旋链霉菌(Streptomyces pactum)Act12 和娄彻氏链霉菌(Streptomyces rochei)D74 3 株生防链霉菌为试验材料,通过盆栽种子包衣供试链霉菌活菌制剂和白发病菌卵孢子,分析施菌处理和对照(不施加菌剂)中白发病的发病及谷子生长情况,初步明确3 株供试链霉菌对谷子生长前期白发病的防治潜能及对谷子植株生长的影响,旨在筛选有应用价值的菌株并为谷子白发病的生防放线菌研究提供理论依据。
1 材料与方法
1.1 试验材料
谷子:本试验所用谷子品种为晋谷40,为易被白发病菌侵染的谷子品种,由山西农业大学农学院农业生物工程研究所提供。病原菌:本试验所用谷子白发病卵孢子收集自田间发病的谷子植株,由山西农业大学农学院农业生物工程研究所提供。链霉菌:黄白链霉菌(Streptomyces albidoflavus)T4、密 旋 链 霉 菌(Streptomyces pactum)Act12 和娄彻氏链霉菌(Streptomyces rochei)D74,对多种作物具有抗病促生作用[18~20]的土壤放线菌。3 株链霉菌均以固态发酵粉状制剂的方式施加,菌剂由西北农林科技大学资源环境学院微生物资源研究室提供。其中,T4、Act12 和D74 菌剂中活孢子含量分别为每克干菌粉中2.3×109个、6.1×109个和 2.3×109个。
1.2 试验方法
试验设计:本试验设计分别施加T4、Act12 和D74 链霉菌剂的3 个处理和1 个不施加菌剂的对照。
病原菌与放线菌混合物制备:称取0.02 g 谷子白发病卵孢子粉,加入已灭菌过0.25 mm 筛的6.0 g 土中混匀,制成卵孢子土,再将卵孢子土与链霉菌菌剂按质量比1∶1 混合均匀制备成病原菌与链霉菌剂的混合物,以灭菌土代替链霉菌剂的处理作为对照。
种子包衣方法:将已知粒数的均匀饱满谷子种子用6%羧甲基纤维素钠溶液浸湿后放于上述混合物中,至各粒种子均匀包裹混合物后取出,播种,剩余混合物烘干、称重用于计算菌剂包衣量。每粒谷子种子平均粘附T4、Act12 和D74 孢子的数 目 分 别 为 1.3×107个 、5.7×107个 和 1.3×107个。
试验方法:盆栽土壤选用田间耕层土壤,过0.5 cm 筛去除石子和植物残渣后加入1/2 体积的蛭石,混匀。加入 0.4 g·kg-1尿素和 1.2 g·kg-1过磷酸钙后再次混匀,装入直径为11 cm,高10 cm 的底部带孔的塑料花盆中,每盆装土0.4 kg。每盆播种4 穴包衣后谷子,每穴2 粒,各处理6 盆重复。播种日期为2019 年4 月22 日,播种后将试验盆放于光照和黑暗时间分别为12 h 的25 ℃人工气候箱中培养并正常管理。于播种后15 d 和45 d 测量谷子株高。播种后15 d、45 d 和75 d 统计各株谷子总叶片数和白发病叶数(叶脉中间能观察到白发病症状即视为发病),按公式(1)计算病叶率(%);同时于播种后75 d,将发病叶片按发病程度进行分级(0级,健康叶片;1 级,白发病症状面积小于或等于整个叶片面积1/2;2 级,叶片白发病症状面积大于整个叶片面积 1/2;3 级:出现“白化叶”症状。),并按公式(2)计算各株谷子病情指数。播种后75 d,采集各处理中各株谷子顶数第2 片完全展开叶,用冰盒带回实验室4 ℃冰箱保存,用于POD 和PPO 酶活力的测定。POD 采用愈创木酚法,PPO 采用邻苯二酚法测定[21]。同一采样时间,收获各盆地上部剩余植株,称量鲜重和烘干后干重。采样时各处理随机选取3 盆,小心取出谷子完整根系,用自来水冲洗掉表面泥土后用WinRHIZO 根系系统进行分析,获取每盆总根长、根表面积、根体积和根平均直径数据,然后将根系烘干称重。其余3 盆根系取出洗净烘干后称量干重。各指标数据按公式(3)计算处理与对照数值相比的增加率△CK(%)。

1.3 统计分析
采用Microsoft Excel 2016 进行数据处理,Sigmaplot 12.5 进行作图,SPSS 18.0 软件进行单因素方差分析,最小显著差数法(LSD)进行多重比较(P< 0.05)。
2 结果与分析
2.1 链霉菌对谷子白发病的防除作用
由图1 可见,播种后15 d,施加3 种链霉菌剂对谷子白发病的病叶数及病叶率影响不大。播种后45 d,T4 和Act12 菌剂处理的病叶数和病叶率与不施加菌剂的对照相比降低了64.3%~83.3%,但差异未达显著水平。在播种后75 d,施加T4 和Act12 菌剂的处理中,病叶数与对照相比分别显著减少了 35.9% 和 21.9%(P< 0.05);施加 T4、Act12 和D74 的处理中,病叶率也分别显著降低了41.4%、20.6%和18.7%(P< 0.05)。
由图 2 可见,播种后 75 d,施加 T4 和 D74 的处理中,谷子白发病病情指数与不施加菌剂的对照相 比 亦 分 别 降 低 了 36.0% 和 21.3%(P< 0.05)。
2.2 链霉菌剂对谷子生长的影响
由图3 可见,播种后15 d,在施加T4 和Act12菌剂的处理中,谷子株高分别为4.2 cm 和4.5 cm,与对照相比分别增加了15.4% 和24.2%(P<0.05);Act12 处理的播种后45 d 谷子株高与对照相比增加了24.4%(P< 0.05)。D74 对谷子播种后15 d 和45 d 的株高均无显著影响。
由表 1 可见,播种后 75 d,T4 和 Act12 处理谷子叶片数与对照相比分别增加了20.3%和19.4%(P< 0.05),T4、Act12 和 D74 处理下同一时期谷子地上部植株总干重与对照相比分别增加了32.9%、23.7% 和 22.7%(P< 0.05)。在施加D74 的处理中,谷子地上部鲜重为9.8 g,与对照相比增加了 50.3%(P< 0.05)。此外,T4 和 Act12处理的谷子地上部鲜重与对照相比分别增加了21.6%和21.9%,T4 也使谷子根系干重与对照相比增加了19.8%,但处理与对照间差异不显著。
由表 2 可见,T4、Act12 和 D74 3 种菌剂对谷子总根长、根表面积和根体积影响不大;但Act12 处理谷子根系的平均直径与不施加菌剂的对照相比显著增加了 102.6%(P< 0.05),T4 和 D74 处理谷子平均直径较对照分别增加了65.1% 和35.9%,但对照与处理间差异不显著。

图1 链霉菌对谷子白发病病叶数(a)和病叶率(b)的影响Fig.1 Effects of Streptomyces on the number(a)and proportion(b)of diseased leaves
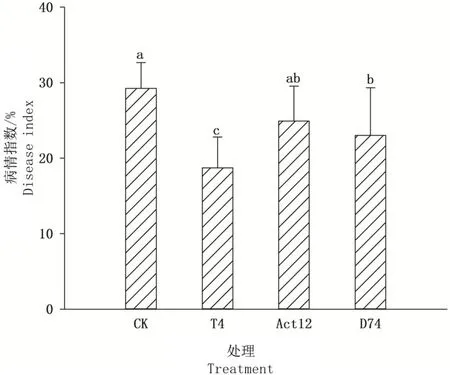
图2 链霉菌对播种后75 d 谷子白发病病情指数的影响Fig.2 Effects of Streptomyces on the disease index of millet downy mildew at 75 days after sowing
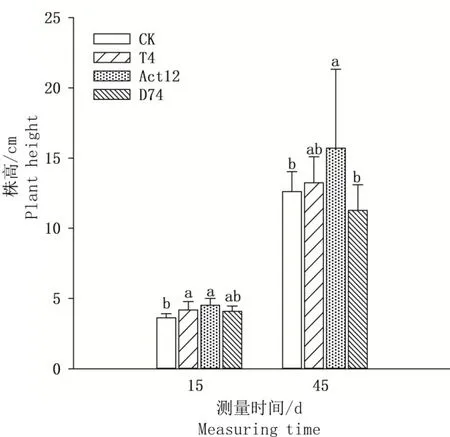
图3 链霉菌对谷子株高的影响Fig.3 Effects of Streptomyces on the plant height of millet
由图4 可见,播种后75 d,D74 处理下谷子叶片POD 酶活力与无菌剂对照相比增加了71.4%,T4 处理下谷子叶片PPO 酶活力也与对照相比增加了22.2%,然而,对照与处理间差异均不显著。施加Act12 菌剂对播种后75 d 谷子叶片POD 和PPO 酶活力亦无显著影响。
3 讨论与结论
目前,谷子白发病生防真菌和细菌已有不少研究[6,22],但尚缺乏生防放线菌的相关报道。本研究结果表明,施加黄白链霉菌T4、密旋链霉菌Act12 和娄彻氏链霉菌D74 三种链霉菌剂对接菌前期(播种后15 d 和45 d)谷子白发病的发生影响不大;而在接菌后期(播种后75 d)均显著降低了谷子白发病的病叶率并增加了地上部生物量,同时T4 和Act12 降低了白发病的病情指数。这表明供试3 株链霉菌能够降低谷子植株受白发病菌侵染后的发病程度,同时促进谷子植株的生长,减轻白发病对谷子造成的危害。
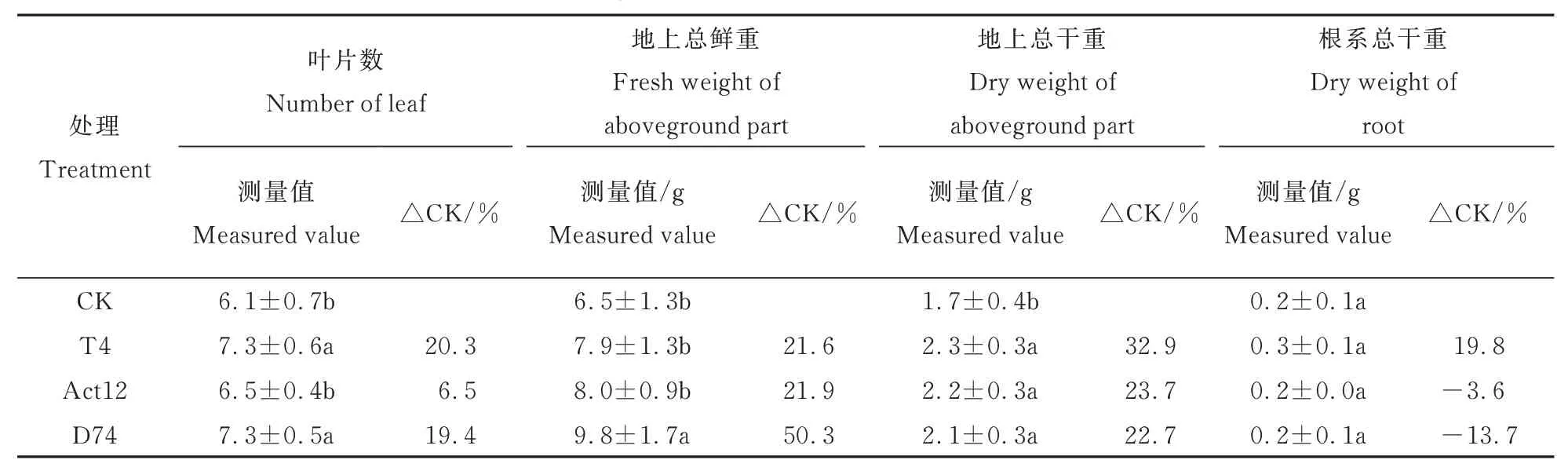
表1 链霉菌对播种后75 d 谷子生长的影响Table 1 Effects of Streptomyces on the growth of millet plants at 75 days after sowing

表2 链霉菌对播种后75 d 谷子根系指标的影响Table 2 Effects of Streptomyces on the root traits of millet plants at 75 days after sowing

图4 链霉菌对谷子叶片防御酶活性的影响Fig 4 Effects of Streptomyces on the activities of defensive enzymes of millet leaves
放线菌尤其是链霉菌能够产生代谢物质抑制病原菌的生长[23,24]。相关研究表明,Act12 等土壤链霉菌的代谢产物中存在抑制土传真菌生长的物质[25,26]。本研究中所用 3 株链霉菌也可能通过产生了某些抗菌次级代谢产物抑制土壤及谷子种子表面白发病病原真菌的生长,进而减轻了谷子白发病的病症,但具体发挥作用的代谢物质仍需进一步试验确定。
大量定殖于土壤是土壤放线菌发挥作用的基础。本试验中,谷子白发病菌与放线菌同时接种于谷子种子表面后播种,链霉菌从接菌开始到在土壤中大量繁殖并发挥作用需要一段时间,这可能是接种链霉菌早期对谷子白发病防治效果不明显的原因之一。
放线菌能够通过作用于植株根系,刺激根系的生长发育,进而增加作物对根系侵染病害的抗性。本试验中,施加3 种链霉菌剂都显著增加了谷子的地上部生物量,但对根系生长和发育的影响不大,这可能与谷子植株体內资源分配策略有关:通过将更多的养分转移到地上部茎叶,提高光合作用能力,产生更多的有机物后期转运到籽粒中,从而增加植株的生存能力。通过诱导提高植物自身抗性是放线菌防治真菌病害的重要机制[18,27,28]。植物受病原菌侵染时,体内活性氧大量累积,危害植物正常生长[29]。POD、PPO 和 PAL 等氧化酶类通过清除植物体内过剩的超氧自由基或促进木质素和氧化酚类等增强植物细胞结构物质的产生来增强植物的抗病性[30,31]。包括 Act12 等多种土壤链霉菌具有增强植物叶片防御酶活性的功能[32,33]。据报道,谷类作物对白发病的抗性与植株POD 和PAL 等多种酶活力提高有关[7,34]。然而,在本研究中,仅施加T4 和D74 菌剂的处理在数值上增加了谷子叶片POD 和PPO 酶活力。分析其原因,一方面可能是3 种供试链霉菌本身对谷子生长早期防御酶活力的影响不大;另一方面,本试验中链霉菌剂施加量为常规用量,可能不是各菌剂最佳施用量,因而导致链霉菌的功能未完全表现出来,后续研究应进一步探究各菌剂尤其是T4 防治谷子白发病的最佳施用量。
本研究采用种子表面包衣粉状活菌制剂的形式施加供试链霉菌,较传统菌悬液和发酵液的施用方式具有活性高、耐保存、操作简单和便于田间大规模应用等多种优势。白发病菌首先在地下通过侵染种子幼芽进而引发植株发病。本试验通过在谷子种子表面包裹一层活菌孢子粉,使病原菌在地下侵染种子幼芽和根系时,放线菌在种子周围同步大量繁殖,充分与植物根系和病原菌接触,能够更好地发挥防治作用。本试验在室内小盆栽条件下研究了3 种供试链霉菌剂对谷子白发病的防治效果,后续试验应进一步探究室外盆栽及田间土壤条件下供试放线菌对谷子整个生育期白发病的防治作用及植株生长和产量的影响。
综上所述,3 株供试链霉菌 T4、Act12 和 D74均具有防治谷子白发病的潜能,其中以T4 的防病促生效果最好。本研究结果表明,土壤放线菌尤其是具有抗病促生等多种功能的链霉菌具有防治谷子白发病的潜能,为谷子白发病生防微生物的选择提供了新的思路。

