S100P在NSCLC中的表达、信号通路和预后关系生物信息分析及验证
汤山松 刘娟
1资阳市人民医院肿瘤科641300;2四川省人民医院病理科,成都610000
肺癌是临床上最为常见的恶性肿瘤,其发病率在男性为第一位,女性为第二位,且病死率位居所有肿瘤的第一位[1]。一直以来,肺癌都是影响人类生存健康的重大难题之一。近期发布的全球癌症统计报告显示,肺癌、气管和支气管肿瘤发病率及病死率居各种癌症之首位[2]。因此,找出特异度、敏感度更高的蛋白及基因标志物,对于肺癌的早期诊治及评估预后具有重要价值。
近些年的研究表明S100P 在人类多种恶性肿瘤中呈现明显上调表达,并与患者肿瘤病理学特征存在一定的关系[3]。然而S100P 在非小细胞肺癌(non-small cell lung cancer,NSCLC)患者肿瘤组织和癌旁组织中的表达情况及其与NSCLC 患者生存关系研究鲜有报道。本研究采用生物信息学方法分析TCGA 数据库中S100P的表达水平及其高低表达与NSCLC 患者总生存期 (overall survival,OS)和无疾病进展生存期 (disease free survival,DFS)的关系。同时,采用免疫组织化学法检测48例NSCLC患者肿瘤组织中S100P 蛋白表达水平,并分析其与患者临床病理特征的关系,对前述生物信息分析结果进行验证。
1 对象与方法
1.1 S100P表达水平分析 在TCGA 数据库中分析“肺癌”“非小细胞肺癌” “鳞癌” “腺癌”和“S100P基因”检索物种为人类,分析S100P 基因在多种组织中的变动情况,并比较其在肿瘤组织和对应的癌旁正常组织中的差异表达情况。认为存在组织差异表达的条件为S100P基因m RNA 上调或下调表达超过2 倍 (|Log2FC|>1),且P<0.05[4]。
1.2 S100P 蛋白网络分析 采用STRING 数据库,与S100P相互作用蛋白网络,并分析其相关蛋白聚类情况,S100P 蛋白-蛋白相互作用网络构建条件为置信度大于0.5,相互作用来源为共表达、基因功能和比邻关系[5]。
1.3 共表达及生存分析 在TCGA 数据库中,依据与S100P基因共表达关系,选取正相关和负相关表达最为明显的2个基因进行分析,计算相关系数;根据S100P基因在NSCLC患者癌组织中表达的中位数,分为高表达组和低表达组,采用Logrank检验分析比较S100P 基因表达与患者预后的关系。
1.4 免疫组织化学检测S100P蛋白表达 回顾性分析四川省资阳市人民医院收治的NSCLC患者48例,采用免疫组织化学法检测患者手术标本中NSCLC患者癌组织和癌旁正常组织中S100P蛋白表达水平,分析比较S100P 基因编码蛋白表达与患者临床病理特征的关系。本研究符合《赫尔辛基宣言》的原则。免疫组织化学检测S100P 蛋白表达按试剂盒操作说明进行。S100P蛋白表达高低表达判定,在高倍镜下随机选取5个视野,根据着色强弱和阳性细胞比例综合判定S100P 表达强度。按色强度评分:不着色 (0分)、浅黄 (1分)、棕黄(2分)、棕褐色(3分);按照每高倍镜 (SP×200)下阳性细胞所占的比例分为<10% (0分)、≥10%且<25% (1分);≥25%且<50% (2分)、≥51%且<75% (3分);≥75% (4分)。总体评分值=阳性细胞比例评分×染色强度评分。最终评判:<6分为低表达,≥6分为高表达。低表达率(%)=低表达例数/总例数×100%。高表达率(%)=高表达例数/总例数×100%。
1.5 统计学分析SAS 9.1统计学软件进行相关分析,计量资料以x-±s表示,数据比较采用t检验;计数资料采用例数(百分比)表示,数据比较采用χ2检验。S100P基因高低表达组生存期采用Logrank检验。P<0.05为差异有统计学意义。
2 结果
2.1 S100P 基因表达 TCGA 数据库中,S100P蛋白在大多数肿瘤组织中呈现高表达;在肺腺癌组织中S100P 基因表达水平显著高于癌旁组织(P<0.05)。同时,S100P表达水平在NSCLC不同临床分期差异有统计学意义 (F=3.74,P<0.05)。见图1、2。

图1 S100P基因mRNA 在肺腺癌、肺鳞癌及对应正常组织中的表达 A:肺腺癌与对应正常组织;B:肺鳞癌与对应正常组织
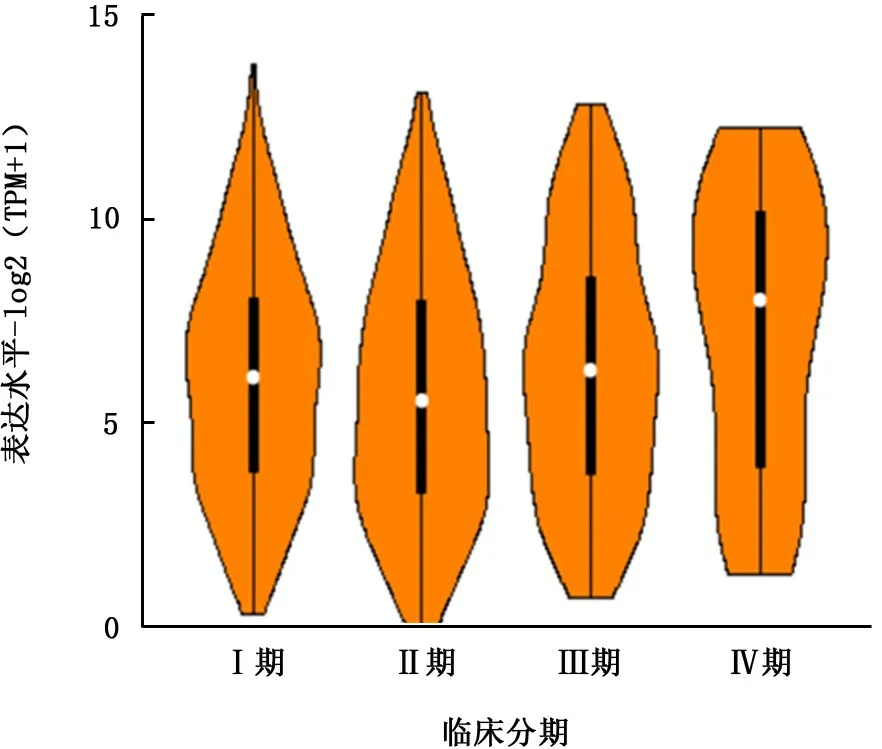
图2 S100P基因m RNA 表达与非小细胞肺癌患者临床分期的关系
2.2 S100P 蛋白-蛋白相互作用网络 蛋白-蛋白相互作用关系采用String数据进行分析,选取了与S100P 蛋白相互作用较为紧密的蛋白网络节点数50个,相互作用关系236个,区域聚类指数为0.39,蛋白相互作用网络富集显著 (P<0.05)。
2.3 相关分析 共表达分析显示,与S100P基因正相关表达最显著的基因为FURIN 基因 (r=0.55,P<0.05),与S100P 基因负相关表达最显著的基因为CAMK1 (r=-0.38,P<0.05)。
2.4 生存分析 生存分析显示高表达组与低表达组OS 差异无统计学意义 (HR=1.1,P>0.05),高表达组患者DFS低于低表达组(HR=1.3,P<0.05),见图3、4。肺腺癌中S100P高表达患者OS 和DFS 生存均低于低表达组 (P值均<0.05)。
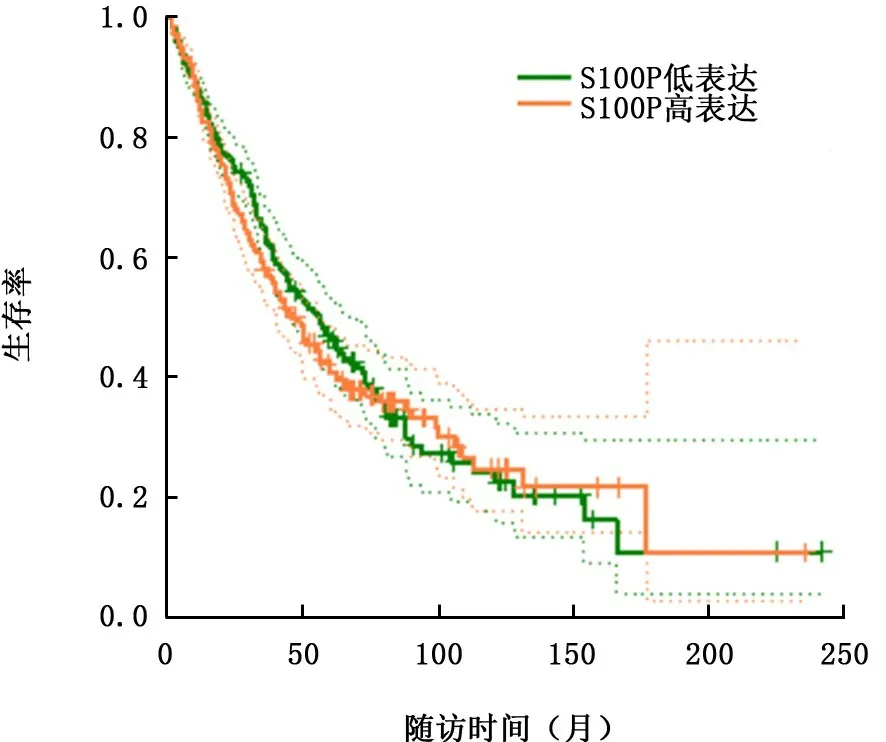
图3 S100P基因m RNA 在非小细胞肺癌患者中总生存期的受试者工作特征曲线

图4 S100P基因m RNA 在非小细胞肺癌患者中无疾病进展生存期的受试者工作特征曲线
2.5 S100P基因编码蛋白表达情况 免疫组织化学显示S100P 蛋白主要表达于肺癌或正常肺组织细胞核,呈现棕褐色颗粒 (图5)。S100P 在NSCLC患者癌和癌旁组织中的阳性表达率分别为54.2% (26/48)和16.7% (8/48),癌组织中阳性标的率显著高于癌旁组织 (χ2=14.76,P<0.05)。
2.6 S100P 蛋白表达与NSCLC 患者临床病理特征关系 S100P 蛋白在癌组织中的阳性表达与NSCLC患者的临床分期和纵隔淋巴结转移有关(P值均<0.05),而与患者年龄、性别、肿瘤大小、病理类型、病例分级和有无胸水无关 (P值均>0.05),见表1。
3 讨论
S100P是介导钙离子结合蛋白S100家族重要成员[6-7]。自1992 年S100P 被报道以来,这种相对分子质量10 400的钙结合蛋白就受到了研究这的广泛的关注。虽然S100P 自身在人体组织中并非广泛表达,但人体胚胎发育以及肿瘤发生、发展中发挥重要作用[8-10]。
S100P在进化方面也相对较新,因为它只存在于脊椎动物的基因组中。在子宫壁激素节律性波动过程中观察到这种蛋白的表达,它可能与胚胎着床以及发育中的胚胎有密切关系。然而,大多数已发表的研究认为S100P在多种人类恶性肿瘤的发生、发展中发挥重要作用。在人类恶性肿瘤中,S100P越来越被认为是一种潜在的诊断和治疗靶点。
相关研究显示,S100P在多种不同类型的肿瘤中大多呈现高水平表达[11],这与我们生物信息分析结果也较为一致。此外,大量来自转录组学和蛋白质组学分析实验数据显示S100P 在体外和体内过度表达,肿瘤细胞的生物学功能发生明显改变,包括增殖、迁移能力等。S100P的表达受多种激素的影响,并受多种转录因子的调节。相关实验证实S100P在雄激素[12]、smad、stat/creb和sp/klf[13]以及孕酮[14]等因子作用下明显上调。在体外研究中,BMP4 也被确定为S100P 表达的调节因子,在这两种蛋白质之间观察到正相关表达[15]。同时,在转移性和雄激素难治性前列腺癌细胞中观察到IL-6和S100P表达之间的相关性,并推测IL-6可刺激S100P表达[16]。
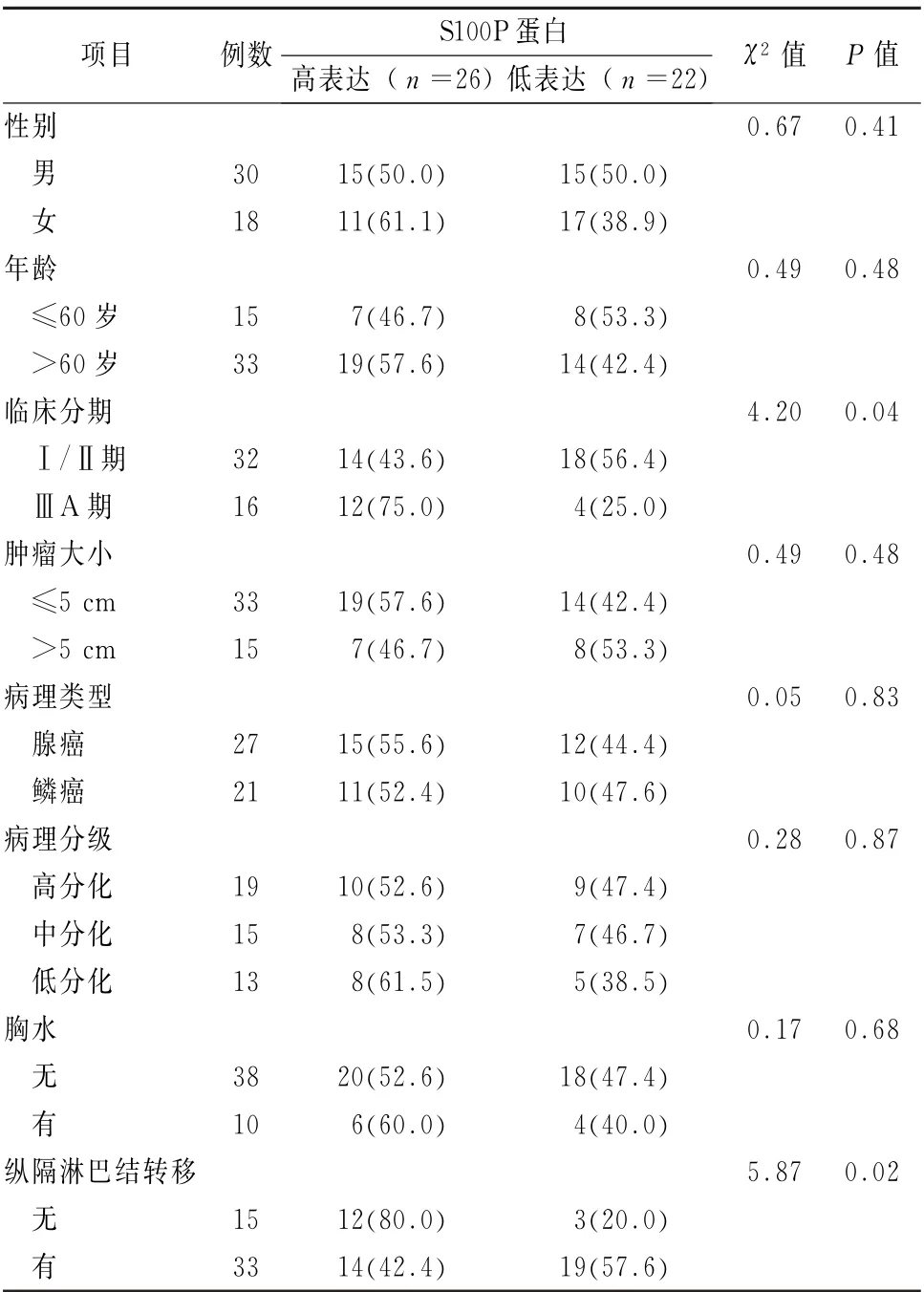
表1 S100P基因编码蛋白表达与非小细胞肺癌患者临床病理特征关系 [例 (%)]
S100P在NSCLC中的表达研究报道不多,其在NSCLC中的表达及其与患者预后关系研究鲜有报道。根据S100P 在其他肿瘤中的表达情况及生物学功能,我们推测S100P在NSCLC的预后和临床病理特征中也可能发挥重要作用。因此,我们分别采用生物信息和免疫组织化学方法探讨S100P的表达情况及其与NSCLC 的关系。本研究发现,S100P在NSCLC患者,尤其是肺腺癌患者癌组织中的表达水平明显上调,并与患者预后相关。S100P高表达患者OS 和DFS 明显降低,提示S100P 可能是NSCLC 预后不良的危险因素。同时,免疫组织化学检测也证实S100P 高表达患者分期较晚,纵隔淋巴结转移率较高。也证实了其作为NSCLC预后不良的危险因素。
因此,S100P基因在NSCLC 患者肿瘤组织中呈现高表达,并与NSCLC患者预后不良有关,有望成为NSCLC患者预后相关分子标志物,并成为NSCLC靶向治疗的潜在靶点。
利益冲突 所有作者均声明不存在利益冲突

