提高间充质干细胞表面CXCR4 表达的实验研究*
李 蓉 ,路海苏 ,胡书群 ,吕兰欣 ,2
(1 徐州医科大学,江苏221002;2 徐州医科大学附属医院急救中心)
干细胞是一类具有自我复制能力的多潜能细胞,在一定条件下,它可以分化成多种功能细胞[1]。干细胞在多种疾病中已获得研究和应用,如烧伤、骨创伤、骨肿瘤、血管再生及修复、神经再生及修复、角膜修复、肝脏、肺、心肌修复等[2-3]。间充质干细胞(mesenchymal stem cells,MSCs)具有易分离、扩增以及体外操作简便等特点,在组织工程、细胞移植、基因治疗等领域的应用前景十分广阔[4]。MSCs 迁移至受损部位进行细胞替代,并分泌各种因子,帮助受损部位重建功能[5-6]。
多种趋化因子、生长因子及黏附分子对MSCs具有趋化作用,引导其向损伤区及其邻近组织迁移,即干细胞归巢[7]。干细胞的归巢率在组织损伤治疗中有着重要意义。基质细胞衍生因子-1α(SDF-1α)及其趋化因子受体-4(CXCR4)在MSCs 迁移中发挥重要作用[8-10]。研究发现,MSCs 表面存在趋化因子受体CXCR4 和 CX3CR1,损伤区域 SDF-1α 和 fractalkine等趋化因子表达增加,作用于移植细胞表面受体,引导其向缺血病灶迁移[11]。然而体外培养的MSCs 在传代过程中,其表面CXCR4 受体逐渐减少,导致MSCs移植后归巢效率低下,难以发挥应有作用[12-13]。因此,提高MSCs 体外培养过程中CXCR4 受体的表达效率在细胞治疗中至关重要。
1 材料与方法
1.1 材料 兔骨髓间充质干细胞(赛业生物);人脐带间充质干细胞(顺昊生物);胎牛血清(FBS)(BI);CCK-8 试剂盒(VICMED);兔源 CXCR4 一抗(Abcam);Alex594-抗兔二抗(Life Technology);细胞培养相关试剂(Hyclone)。
1.2 方法
1.2.1 细胞培养:将兔骨髓间充质干细胞(Rabbit-MSCs)与人脐带间充质干细胞(HUC-MSCs)用含有10%胎牛血清的 L-DMEM 重悬,于 37 ℃、5% CO2培养。24 h 后换液,弃未贴壁细胞,待细胞达80%~90%融合时,以0.25%胰蛋白酶消化后按1∶2 传代,达到基本融合后再次消化传代,进行体外扩增和富集。
1.2.2 MSCs 处理:(1)低氧培养:将生长旺盛的第3代细胞接种于10 cm 培养皿及24 孔板中,培养至70%~80%融合后,置于 37 ℃、3%O2、5%CO2、92%N2的饱和湿度孵育箱内培养24 h。以常氧培养作为对照,分别行免疫荧光染色及流式细胞仪检测表面CXCR4 表达情况。(2)SDF-1 预处理:采用不同浓度SDF-1(1 ng/mL,10 ng/mL,100 ng/mL)培养液培养MSCs,以正常条件培养的MSCs 为对照组。在24h 检测细胞活性,取高浓度组进行免疫荧光染色及流式细胞仪检测细胞表面CXCR4 的表达。
1.2.3 CCK-8 检测细胞活性:向96 孔板的待检测细胞加入10%CCK-8 溶液培养2 h,每组6 个复孔,将100 μL 培养液转移至新96 孔板,全波长酶标仪检测450 nm 处吸光值。
1.2.4 免疫荧光染色:将24 孔板各待测孔弃去培养液,PBS 洗涤;3% BSA(含 0.1%Triton-X100)封闭1 h;兔源 CXCR4 一抗(1∶200)4 ℃孵育过夜;PBS 洗涤 2 次,37 ℃孵育 Alex594-抗兔二抗 1 h;PBS 洗 2次后用DAPI 进行细胞核染色,荧光显微镜观察。
1.2.5 流式细胞仪检测:弃去细胞培养液后PBS 洗涤,0.25%胰酶消化,使细胞悬浮,移入离心管,1 000 r/min 离心 5 min;弃上清,用含 2%BSA 的 PBS 液制成浓度为106/mL 的单细胞悬液;加入PE-CXCR4 抗体,4℃孵育 40 min;PBS 洗涤 2 次,使用流式细胞仪检测。
1.3 统计学处理 使用SPSS12.0 统计学软件进行数据分析。计量资料以表示,多组间比较采用单因素方差分析(One-Way ANOVA),两组间比较时采用 Student’s T-test。P<0.05 为差异具有统计学意义。
2 结 果
2.1 MSCs 镜下观察兔骨髓 MSCs 与人脐带MSCs培养3 天后换液,弃未贴壁细胞,光镜下观察,可见细胞80%~90%融合,均匀贴壁,形态均一,呈生长旺盛的漩涡样、辐射状排列的单层细胞。人脐带MSCs形态较兔骨髓MSCs 更为细长,体积更大,符合两类细胞特征。见图1。
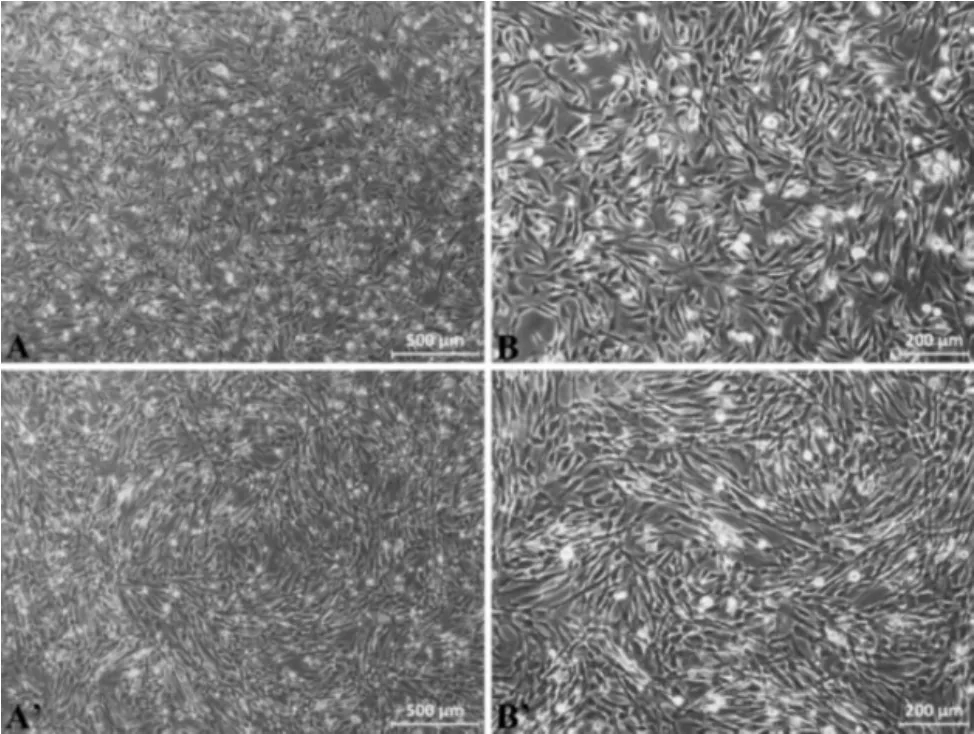
图1 MSCs 镜下观察
2.2 MSCs 培养活性测定CCK-8 检测 结果显示,不同浓度 SDF-1(1 ng/mL,10 ng/mL,100 ng/mL)预处理对Rabbit-MSCs 活性无影响(图2A),低氧处理24 h 对细胞活力亦无显著影响(图2B);HUC-MSCs和Rabbit-MSCs 分别经高浓度SDF-1 及低氧预处理后的细胞活性与正常培养组比较,差异均无统计学意义(P>0.05),见图3。说明上述预处理方法对MSCs 细胞活性无抑制作用。

图2 两种预处理培养后Rabbit-MSCs 细胞活性

图3 两种预处理培养后Rabbit-MSCs 和HUC-MSCs 细胞活性
2.3 流式细胞仪检测MSCs 表面CXCR4 表达 正常培养条件下兔骨髓MSCs 及人脐带MSCs 表面CXCR4 表达率很低,分别为0.81%和2.86%。经高浓度SDF-1(100 ng/mL)和低氧处理后,两种 MSCs 表面CXCR4 表达有所提高,其中低氧环境下CXCR4表达提高更明显,两种MSCs 表面CXCR4 表达率分别为正常培养的1.91 倍和2.3 倍。见图4。
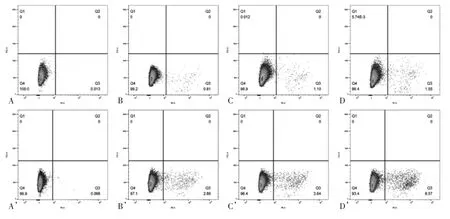
图4 流式细胞仪检测MSCs 表面CXCR4 表达
2.4 CXCR4 免疫荧光染色 图5 为Rabbit-MSCs和HUC-MSCs 免疫荧光染色结果,A/A’为正常培养组,可见其表面红色荧光很少,说明CXCR4 表达率低;B/B’、C/C’为 SDF-1 高浓度处理组及低氧处理组,结果显示,红色荧光较正常培养组有明显增多,说明两种处理方法均可以提高MSCs 表面CXCR4表达。这一结果与流式细胞仪检测结果一致。

图5 CXCR4 免疫荧光染色
3 讨 论
在众多干细胞中,MSCs 由于取材方便、可自身来源、易于分离、体外扩增能力强、无免疫排斥反应、无伦理争议等优势而成为再生医学领域的优选种子细胞[14-15]。骨髓来源和脐带来源的MSCs 是两类研究和应用较为广泛的间充质干细胞,在脑外伤、脑卒中、神经损伤、组织工程中被深入研究[15-18]。文献报道,SDF-1 与 CXCR4 具有相互作用,MSCs 表达 CXCR4,并沿SDF-1 浓度梯度进行迁移[19]。然而,体内MSCs 虽能表达较高水平的CXCR4,但随着体外培养时间的延长,MSCs 表达CXCR4 逐渐降低,从而影响MSCs 回输至体内向病灶区域迁移的能力[13,20-21]。因此,在干细胞治疗研究中,提高体外培养过程中MSCs 表面CXCR4 的表达水平具有十分重要意义。
有研究表明,肿瘤坏死因子-α(TNF-α),白介素-6(IL-6)等可以诱导 MSCs 表面 CXCR4 表达,但同时会抑制MSCs 增殖,甚至引起MSCs 凋亡[22]。研究显示,CXCR4 基因修饰可促进MSCs 向SDF-1 的定向迁移,在SDF-1 浓度适宜的条件下,定向迁移能力较对照组提高近5 倍,表明基因修饰是一种有效提高MSCs 表面CXCR4 表达的方法[23]。但是目前基因修饰采用的慢病毒或腺病毒载体存在潜在风险,不宜大规模临床试验的开展。
本研究旨在通过对MSCs 进行低氧和SDF-1 处理,提高MSCs 表面CXCR4 的表达。结果显示,低氧和SDF-1 两种处理方法均未抑制MSCs 的活性,适用于体外MSCs 的培养和扩增。流式细胞仪和免疫荧光检测显示,低氧和SDF-1 处理后MSCs 表面CXCR4 表达水平均有提高,其中低氧处理对提高两种MSCs 表面CXCR4 表达的效果均明显优于SDF-1 处理。Liu 等[13]研究结果显示,人骨髓来源 MSCs 在3%O2环境培养2 h 后其表面CXCR4 的表达是正常培养的4 倍左右。上述结果均表明,低氧环境培养MSCs 可有效提高MSCs 靶向性迁移能力,有助于解决干细胞治疗中存在的细胞移植方式、细胞归巢、细胞定植数量少等瓶颈问题,同时,低氧处理不需要使用昂贵的生长因子,是一种安全、廉价的方法。但需要指出的是,与以往研究结果对比发现,低氧处理MSCs 表面表达CXCR4 的效率与基因修饰法的差距较大,因此需要进一步研究如何更有效提高低氧处理的效率。有研究表明,低氧诱导因子-1α(HIF-1α)可以提高 MSCs 表面 CXCR4 的表达[13]。HIF-1 是一种异源二聚体,主要由HIF-1α 和HIF-1β 两个亚单位组成。HIF-1β 在细胞内稳定表达,发挥结构性作用[24]。HIF-1α 是 HIF-1 的活性亚基,受缺氧信号的调控。推测在低氧条件下,细胞内的缺氧环境活化HIF-1α 亚基,从而使得细胞表面CXCR4 表达增高。因此,进一步研究HIF-1α 通过哪些信号通路影响CXCR4 的表达,可能有助于提高低氧处理促进CXCR4 表达的效率。
综上所述,本研究通过低氧预处理及SDF-1 预处理对两种来源的间充质干细胞进行培养,采用CCK-8 检测细胞活性,免疫荧光染色及流式细胞仪检测细胞表面CXCR4 表达情况,结果表明两种处理方法均不影响细胞活性,能提高细胞表面CXCR4 表达,其中低氧预处理的效果更为显著。提示低氧环境下进行MSCs 体外培养是提高CXCR4 表达的有效、廉价方法,有望在临床干细胞治疗中广泛应用。

