基于蛹虫草单核芽生孢子的原生质体制备条件的优化
娄海伟 余颖豪 林俊芳 郭丽琼* 叶志伟 李 艳 魏 韬 云 帆
(1 华南农业大学食品学院生物工程系 广州510642 2 河南工业大学粮油食品学院 郑州 450001 3 广东省微生态制剂工程技术研究中心 广州510642 4 广州市澳键丰泽生物科技股份有限公司 广州510760)
蛹虫草(Cordyceps militaris)是一种重要的食药两用真菌, 它具有和冬虫夏草相似的药用价值和活性成分[1],被广泛作为冬虫夏草的替代品。 蛹虫草含有虫草素[2]、虫草酸[3]、虫草多糖[4]等生物活性成分,具有免疫调节[5]、抗疲劳[6]、抗肿瘤[7]等活性,已成为研究的热点。随着菌体中喷司他丁等抗癌化合物的发现[8], 蛹虫草的市场需求量逐渐增大。虽然蛹虫草的人工栽培技术已推广应用,但产量仍无法满足日益增长的市场需求, 其主要原因是价格较高的菌体中生物活性成分含量低。 基因工程是提高蛹虫草生物活性成分的有效方法,然而大多数与生物活性成分合成相关的基因的功能仍然未知, 主要是因为蛹虫草具有一层较厚且致密的细胞壁,这给基因工程操作中载体DNA 的转化带来很大困难。目前,蛹虫草遗传转化的方法主要有农杆菌介导转化法[9]、基因枪法[10]、聚乙二醇(polyethylene glycol,PEG)介导的原生质体转化法[11]。 相对于基因枪法,PEG 介导原生质体转化法设备条件要求低,方法简单。相对于农杆菌介导转化法,PEG 介导转化原生质体法试验周期短。 另外, 通过原生质体融合亦可选育高产生物活性成分的优良蛹虫草菌株[12]。 原生质体的制备是实现蛹虫草原生质体转化和原生质体融合的技术关键。
对于食用真菌, 制备原生质体的材料主要有菌丝、芽生孢子、分生孢子等。在基因工程操作中,通常需要单细胞核的受体材料, 且细胞壁易被酶水解。 蛹虫草产菌丝、芽生孢子[13]、分生孢子[14]。 芽生孢子细胞壁薄[15],易被溶壁酶水解释放原生质体,是良好的制备原生质体的材料。 目前,还未见有关蛹虫草芽生孢子细胞核观察的报道, 亦未见采用蛹虫草芽生孢子制备原生质体的报道。 本文以蛹虫草芽生孢子为材料,观察其细胞核数,对其原生质体制备条件和再生培养基中的渗透压稳定剂进行优化, 为蛹虫草原生质体的转化和原生质体的融合提供依据。
1 材料和方法
1.1 菌株与试剂
蛹虫草10 号菌株(CM-10)保藏于华南农业大学食品学院天然产物实验室。 4’,6-二脒基-2-苯 基吲哚 (4’,6 -diamidino -2 -phenylindole,DAPI),Solarbio 公 司; 荧光增白剂(Fluorescent Brightener 28),Sigma 公司;溶壁酶,广东省微生物研究所;氯化钾、氯化钠、甘露醇、山梨醇、葡萄糖、蔗糖、磷酸二氢钾、硫酸镁等均为分析纯,购自广州化学试剂厂。
1.2 培养基
马铃薯葡萄糖水(Potato dextrose broth,PDB)培养基:马铃薯20.0%(质量分数,下同)、葡萄糖2.0%、硫酸镁0.15%、磷酸二氢钾0.3%。
马铃薯葡萄糖琼脂 (Potato dextrose agar,PDA)培养基:PDB 培养基、琼脂2.0%。
再生培养基(Regeneration medium,RM):PDA培养基、渗透压稳定剂。
1.3 仪器与设备
DMi8L 徕卡荧光显微镜, 德国徕卡微系统有限公司;SW-CJ-1FD 超净工作台, 江苏苏州安泰空气技术有限公司;MQD-S2R 振荡培养箱, 上海旻泉仪器有限公司;MJ-Ⅱ霉菌培养箱,上海一恒科技有限公司;5804R 高速冷冻离心机,Eppendorf公司。
1.4 方法
1.4.1 芽生孢子的收集 将菌株CM-10 接种到PDA 培养皿上,25 ℃培养28 d,得到活化母种。 用接种刀从CM-10 母种培养皿上取4 块1 cm×1 cm 的菌块接种于100 mL PDB 培养基中,25 ℃振荡培养4 d(150 r/min),得到发酵液。 用6 层灭菌纱布过滤发酵液,离心(8 000 r/min,10 min)滤液(含芽生孢子),弃上清,用灭菌双蒸水(doubledistilled water,ddH2O)清洗3 次即得蛹虫草芽生孢子,用于荧光染色和原生质体的制备。
1.4.2 芽生孢子的荧光染色 取适量芽生孢子与500 μL 10%甲醛溶液混合, 静置24 h 后离心(8 000 r/min,10 min)弃上清,加入50 μL 2.5 μg/mL 荧光增白剂(染色细胞壁)和50 μL 5 μg/mL的DAPI(染色细胞核)静置染色30 min,取10 μL染色后的芽生孢子滴加至载玻片,加盖盖玻片,在1 000 倍荧光显微镜下观察细胞核数 (激发波长340 nm)。
1.4.3 原生质体的制备 将芽生孢子用0.8 mol/L的KCl 清洗3 次, 并重悬于0.8 mol/L 的KCl 中,通过血球计数板计数法调整其浓度至1×109个/mL。 取100 μL 芽生孢子液,离心(8 000 r/min,10 min)并弃上清,加1 mL 溶壁酶液(溶壁酶粉末溶解于0.8 mol/L 的KCl 中,经0.22 μm 微孔滤膜过滤除菌)混匀,置于恒温摇床中(90 r/min)酶解一定时间, 酶解后经4 层擦镜纸过滤得包含原生质体的滤液,4 ℃离心 (4 000 r/min,10 min)后弃上清,加1 mL 0.8 mol/L 的KCl 重新悬浮原生质体,在400 倍显微镜下采用血球计数板对其计数。
1.4.4 原生质体制备条件的单因素试验 在预试验的基础上,选取酶质量分数、酶解温度、酶解时间作为原生质体制备的影响因素, 以原生质体得率为评价指标,进行单因素试验。调节酶质量分数为0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,酶解温度为18,22,26,30,35,40 ℃, 酶解时间为1.0,1.5,2.0,2.5,3.0,3.5,4.0,5.0 h。
1.4.5 原生质体制备条件的优化 根据单因素试验结果,选择酶质量分数、酶解温度、酶解时间为自变量(xi),以原生质体得率为响应值(Y),选用Box-Behnken 试验设计[16]。各因素变化区间根据单因素试验确定。每个试验点均做3 个平行样。因素水平编码见表1。
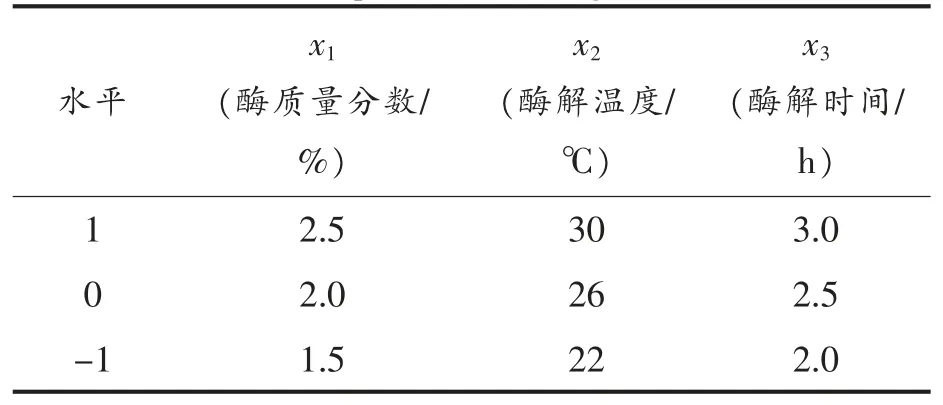
表1 Box-Behnken 试验因素水平编码表Table 1 Factors and levels of Box-Behnken experimental design
1.4.6 RM 中渗透压稳定剂的单因素试验 原生质体的再生受到RM 中的渗透压稳定剂种类和浓度的影响, 本试验选取6 种常用的渗透压稳定剂(氯化钾、氯化钠、甘露醇、山梨醇、葡萄糖、蔗糖),以渗透压稳定剂种类和浓度为影响因子, 以原生质体再生率为评价指标,进行单因素试验。调节渗透压稳定剂的浓度为0.2,0.4,0.6,0.8,1.0 mol/L。
在响应面优化条件下制备原生质体, 用0.8 mol/L KCl 调整浓度至1×103个/mL, 取50 μL 涂布于RM 上,同时取50 μL 涂布于PDA 培养基上做对照,25 ℃避光培养6 d, 计算原生质体的再生率。
原生质体再生率 (%)=(RM 上的菌落数 -PDA 培养基上的菌落数)/ 涂布原生质体数 ×100%
1.5 统计分析
应用Design-Expert 8.0.6 软件进行Box-Behnken 试验设计和分析;Origin 9.0 软件进行数据处理和图形的制作(P<0.01 表明差异极显著;P<0.05 表明差异显著;P>0.05 表明差异不显著)。
2 结果与分析
2.1 蛹虫草芽生孢子的细胞核观察
蛹虫草芽生孢子在1 000 倍的明场显微镜下呈棒状结构(图1a),这与前人的研究结果一致[13-14]。在1 000 倍的荧光显微镜下观察发现, 蛹虫草芽生孢子为单核的细胞(图1b)。 以上结果表明,蛹虫草可以产芽生孢子,且为单个细胞核,适合作为基因工程操作的材料。

图1 蛹虫草芽生孢子的显微观察Fig.1 Microscopic observation of Cordyceps militaris blastospores
2.2 原生质体制备的单因素试验结果
2.2.1 酶质量分数对原生质体得率的影响 溶壁酶的主要作用是水解细胞壁, 使芽生孢子释放原生质体,是影响原生质体释放的主要因素。本试验在酶解温度30 ℃、酶解时间3 h 条件下,调节酶质量分数为0.5%,1.0%,1.5%,2.0%,2.5%,3.0%进行酶解试验,结果见图2。
由图2 可知,在酶质量分数为0.5%~2.0%时,随着酶质量分数的增加, 原生质体的得率逐渐增加,这是因为此阶段芽生孢子足够多,而酶相对较少,随着酶质量分数增加,原生质体释放量增多,当酶质量分数为2.0%时,原生质体的得率达到最大值。 当酶质量分数大于2.0%,随着酶质量分数增加,原生质体得率呈下降趋势,这可能是因为酶已饱和或过饱和, 过多的酶作用于已形成的原生质体, 使已形成的原生质体破裂而造成原生质体得率降低[17]。 以上结果表明,2.0%的溶壁酶质量分数较适合蛹虫草原生质体的制备。

图2 溶壁酶质量分数对原生质体得率的影响Fig.2 The effect of lywallzyme concentration on the yield of protoplasts
2.2.2 酶解温度对原生质体得率的影响 在溶壁酶质量分数2.0%、酶解时间3 h 条件下,调节酶解温度为18,22,26,30,35,40 ℃进行酶解试验,结果见图3。
由图3 可知,随着酶解温度的升高,原生质体的得率显著升高,当温度升高至26 ℃时,原生质体的得率达到最大值。 当酶解温度高于26 ℃时,随着温度的升高,原生质体的得率迅速下降。与其它酶促反应一样, 温度是影响酶活性的主要因素之一,大多数酶都具有最适酶活性温度,溶壁酶亦是如此,越偏离最适酶活性温度,酶活性越低[18]。当酶解温度偏离26 ℃时, 原生质体的得率下降,这是因为溶壁酶的活性降低, 由此可知溶壁酶的最适酶活性温度为26 ℃左右。
2.2.3 酶解时间对原生质体得率的影响 在溶壁酶质量分数2.0%,酶解温度26 ℃条件下,调节酶解时间为1.0,1.5,2.0,2.5,3.0,3.5,4.0,5.0 h 进行

图3 酶解温度对原生质体得率的影响Fig.3 The effect of temperature on the yield of protoplasts
2.3 原生质体制备条件的优化
2.3.1 模型方程建立与显著性检验 在单因素试验基础上, 采用响应面法对原生质体的制备条件进行优化。试验方案设计和响应值见表2。通过分析自变量和因变量得到一个能够在给定的范围内预测原生质体得率的回归模型, 该回归模型方程为:Y = -1.55518×108+ 2.55208×107x1+ 6.51302×106x2+4.13958×107x3-2.91667×105x1x2+5.83333×105x1x3- 1.45833×105x2x3- 4.70833×106x12-1.06120×105x22-7.54167×106x32。
Box-Behnken 试验设计的方差分析见表3。由表3 可知,本研究所得回归模型极显著(P<0.0001),失拟不显著(P=0.8395),决定系数R2为0.9917,说明建立的模型与实际情况拟合良好,误差小, 能较好的表明各因素与原生质体得率之间的关系。 根据方差分析和回归方程系数显著性检酶解试验,结果见图4。
由图4 可知,随着酶解时间的延长,原生质体的得率迅速升高, 当酶解时间延长至2.5 h 时,原生质体的得率达到最大值。 但当酶解时间超过2.5 h 后,原生质体的得率逐渐降低。 以上结果表明适宜的酶解时间是制备原生质体的重要条件,酶解时间过短,芽生孢子的细胞壁去除不彻底,导致原生质体的得率低[19];酶解时间过长,导致已生成的原生质体皱缩, 损害细胞质膜并使原生质体破裂,从而引起原生质体的得率降低[17]。 以上结果表明,酶解2.5 h 较适合蛹虫草原生质体的制备。验的结果, 将差异不显著的因子剔除后得到的回归方程为:Y = - 1.58435×108+ 2.69792 × 107x1+6.51302 × 106x2+ 4.25625 × 107x3- 2.91667 ×105x1x2-1.45833×105x2x3-4.70833×106x12-1.06120×105x22-7.54167×106x32。

图4 酶解时间对原生质体得率的影响Fig.4 The effect of time on the yield of protoplasts
2.3.2 自变量对原生质体得率的影响 原生质体的得率受回归方程的回归系数的影响。 由表3 可知,x1、x2、x3、x1x2、x2x3、x12、x22、x32项对原生质体的得率均有显著影响,x1x3影响不显著。 根据回归方程中的回归系数绝对值的大小可分析各个因素的改变对原生质体得率影响的大小。 回归方程一次项的回归系数绝对值大小依次为x3、x1、x2,表明酶解时间对原生质体得率的影响最大, 其次是酶质量分数、酶解温度。 固定3 个因素中的1 个因素在0水平, 得出其余2 个因素的交互作用对原生质体得率影响的响应面图, 如图5~图7。 由图5~图7可知,3 个因素与原生质体得率呈抛物线的关系,即随着各影响因素值的增加, 原生质体得率先升高后降低, 这说明各因素与响应值之间并非单纯的直线线性关系。 响应曲面的陡峭程度反应变量对原生质体得率的影响程度, 曲面越陡表明影响越大,反之则较小。 图5~图7 表明,任何两个因素的交互作用都存在最高点, 即各因素在所选取的范围内均能得到最大响应值, 表明各因素所选择的试验范围合理有效。

表2 Box-Behnken 试验设计和响应值Table 2 Experimental design of Box-Behnken and response values
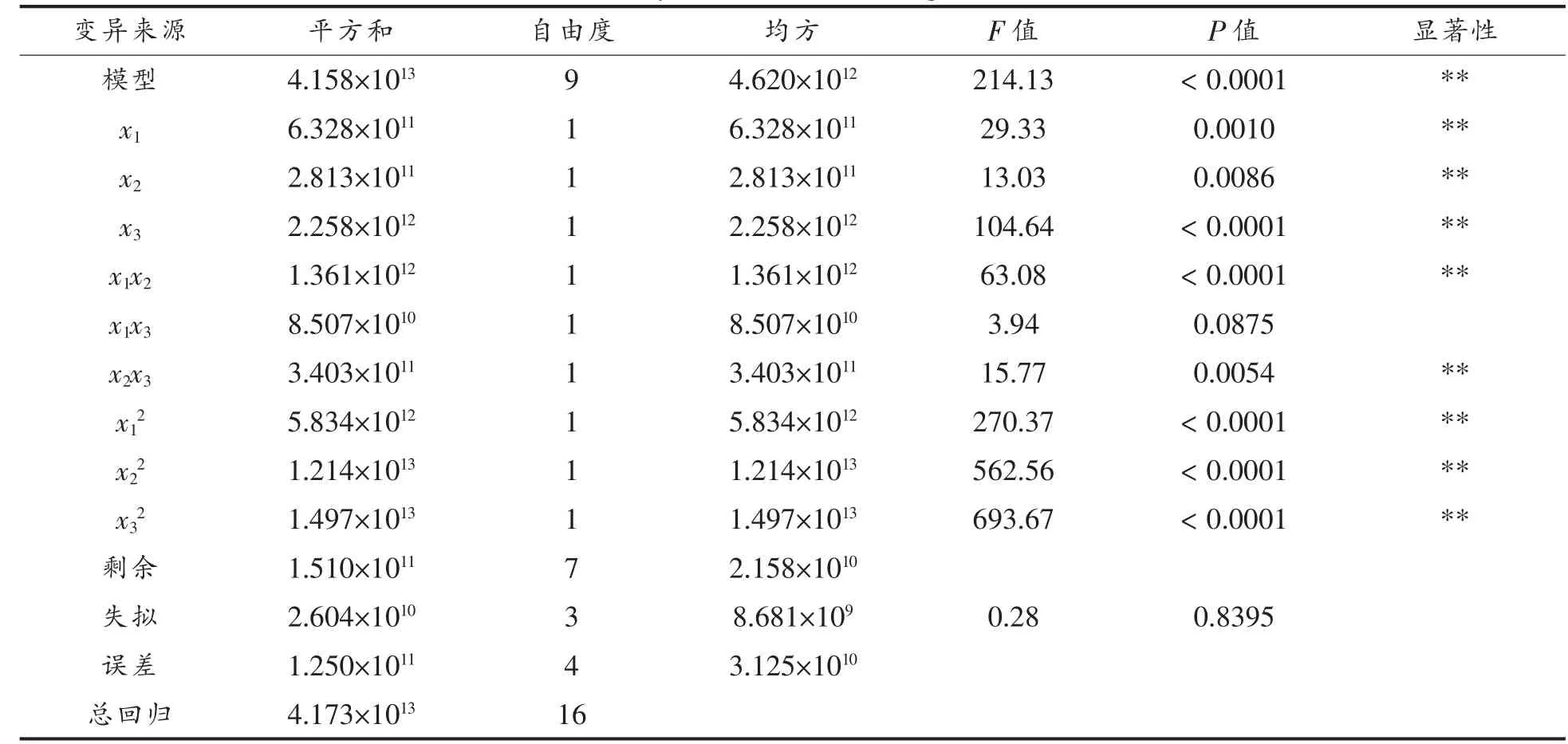
表3 回归模型方差分析表Table 3 Analysis of variance of regression model
2.3.3 最适条件和回归模型的验证 根据上述建立的回归模型, 采用Design-Expert 8.0.6 软件优化原生质体的制备条件,得出最适制备条件为:酶质量分数2.06%,酶解温度26.1 ℃,酶解时间2.57 h, 在此条件下, 原生质体得率的预测值为8.97×106个/mL,而实际测得的原生质体得率为(9.17±0.29)×106个/mL, 实际值与预测值之间的相对误差为2.18%,差异不显著,说明该模型对原生质体制备条件的优化可靠性强,具有一定的实用价值。
2.4 蛹虫草原生质体的显微观察
在响应面优化的条件下制备原生质体, 并直接在1 000 倍的明场显微镜下观察, 结果见图8。通过显微观察可知, 蛹虫草原生质体呈半透明状态、圆形,与棒状的芽生孢子形态差异显著,易于区分,在制备原生质体时,可随时显微观察芽生孢子的酶解情况。
2.5 RM 中渗透压稳定剂对蛹虫草原生质体再生的影响
2.5.1 RM 中渗透压稳定剂种类对原生质体再生率的影响 原生质体对不同种类的渗透压稳定剂耐受能力不一[20],本试验设定RM 中渗透压稳定剂的浓度为0.8 mol/L, 研究6 种常用的渗透压稳定剂对原生质体再生率的影响(图9)。
由图9 可知,RM 中的6 种渗透压稳定剂对原生质体的再生有显著的影响。 甘露醇作为RM 中的渗透压稳定剂时,再生率最高(大于40%),其次是山梨醇、氯化钾、葡萄糖、蔗糖,其再生率均在19%以上。 而以氯化钠作为渗透压稳定剂时,原生质体的再生率最低,仅为13.67%±2.52%。因此,选用甘露醇作为RM 中的渗透压稳定剂。
2.5.2 RM 中甘露醇浓度对原生质体再生率的影响 以甘露醇作为RM 中的渗透压稳定剂, 调节甘露醇的浓度分别为0.2,0.4,0.6,0.8,1.0 mol/L,研究RM 中甘露醇浓度对原生质体再生率的影响,结果见图10。
由图10 可知,随着RM 中甘露醇浓度的增加,原生质体的再生率逐渐升高, 当甘露醇浓度达到1.0 mol/L 时,原生质体的再生率达到最大值(43.67%±2.08%),且与0.8 mol/L 甘露醇(再生率43.33%±2.08%)对再生率的影响差异不显著,因此,为节约成本,本试验选取0.8 mol/L 甘露醇作为RM 中的最适浓度和渗透压稳定剂。
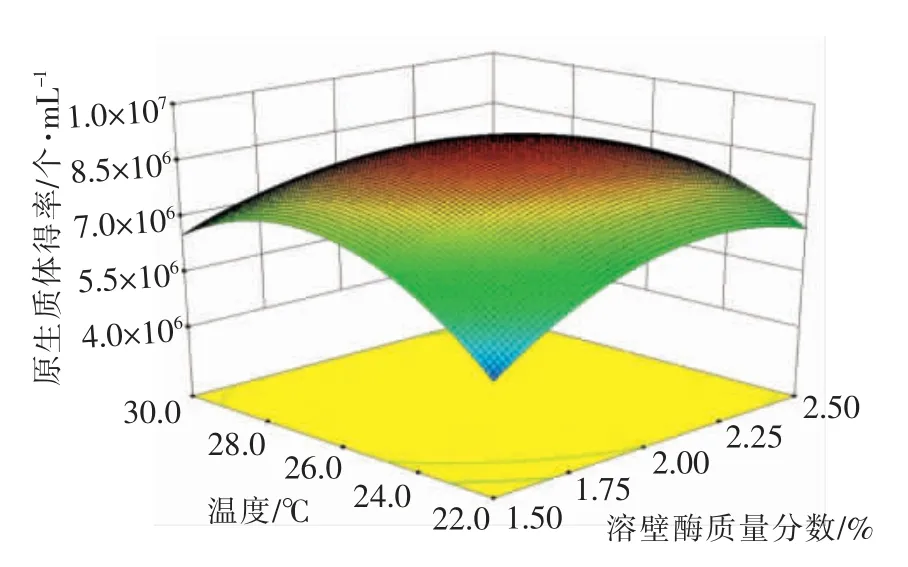
图5 溶壁酶质量分数和酶解温度对原生质体得率影响的响应面图Fig.5 Response surface for effects of lywallzyme concentration and temperature on the yield of protoplasts

图6 溶壁酶质量分数和酶解时间对原生质体得率影响的响应面图Fig.6 Response surface for effects of lywallzyme concentration and time on the yield of protoplasts

图7 酶解温度和酶解时间对原生质体得率影响的响应面图Fig.7 Response surface for effects of temperature and time on the yield of protoplasts

图8 蛹虫草原生质体的显微观察(1 000×)Fig.8 Microscopic observation of Cordyceps militaris protoplasts
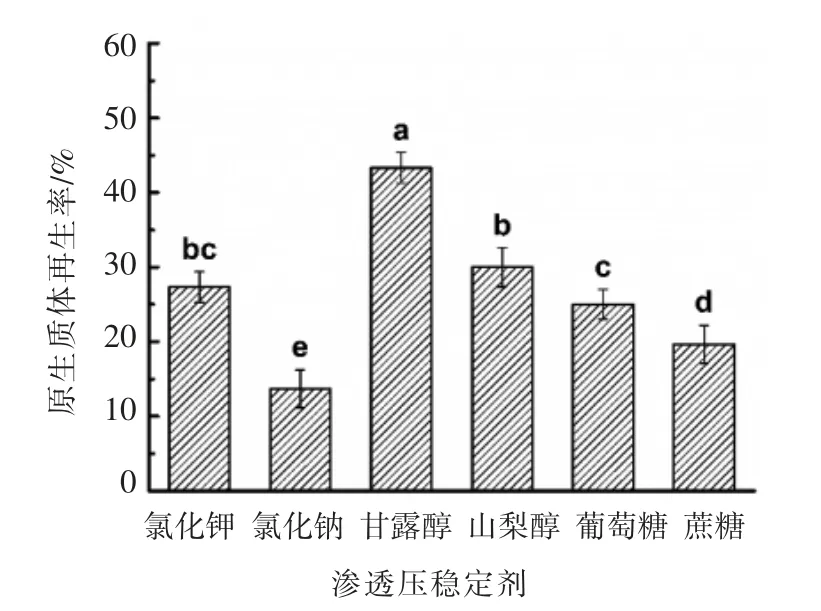
图9 渗透压稳定剂对原生质体再生率的影响Fig.9 Effects of osmotic stabilizers on the regeneration rate of protoplasts
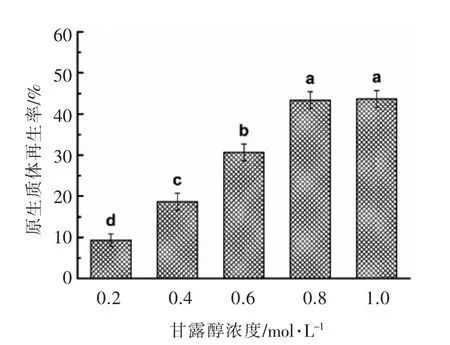
图10 甘露醇浓度对原生质体再生率的影响Fig.10 The effect of mannitol concentration on the regeneration rate of protoplasts
3 结论
通过显微镜观察, 蛹虫草的芽生孢子呈棒状结构、 单个细胞核, 原生质体呈半透明的圆形结构。在单因素试验的基础上,通过响应面法优化了蛹虫草原生质体的制备条件, 建立了多元回归模型,模型显著且拟合度良好。酶解条件对原生质体得率的影响大小顺序为:酶解时间> 溶壁酶质量分数> 酶解温度。 优化的最适酶解条件为:溶壁酶质量分数2.06%,酶解温度26.1 ℃,酶解时间2.57 h。 在此条件下, 原生质体的得率达到了(9.17±0.29)×106个/mL。 再生培养基中的最适渗透压稳定剂的浓度和种类为0.8 mol/L 甘露醇。

