柽柳黄素对3T3-L1脂肪细胞胰岛素抵抗的影响及AMPK信号通路的作用机制
伍明江,张德芹,李 盼,石旭柳,刘 璐
1遵义医药高等专科学校药学系,遵义 563006;2天津中医药大学 中医药研究院,天津 301617;3河北农业大学渤海校区理工学院,黄骅 061100;4北京中医药大学东方学院中药学院,廊坊 065001
胰岛素抵抗是2型糖尿病主要的发病机制之一,脂肪细胞作为胰岛素敏感的靶细胞之一,在胰岛素抵抗和2型糖尿病的发病中起着重要作用。腺苷酸活化蛋白激酶(AMPK)是细胞内能量代谢重要的一种调节因子,是研究糖尿病及其他代谢相关疾病的核心,其参与机体胰岛素敏感性的调节,AMPK的激活能降低血糖、改善糖脂代谢紊乱和减轻胰岛素抵抗。
柽柳黄素是槲皮素甲基化代谢产物[1,2],在番石榴叶[3]、银杏[4]、艾纳香[5]等中药中具有分布。在我们前期研究中发现,柽柳黄素是槲皮素体内主要的甲基化代谢产物,主要存在于尿液和粪便中[6]。槲皮素具有显著改善胰岛素抵抗作用[7,8],而柽柳黄素作为槲皮素体内的主要代谢产物,研究其对胰岛素抵抗的影响很有必要。据报道,柽柳黄素具有抗炎[9]、抗氧化[10]、抗肿瘤[11]、抗血栓[12]、心肌保护[13]等作用,但柽柳黄素在改善胰岛素抵抗及其作用机制的研究尚未见报道,为了阐明槲皮素体内主要甲基化代谢产物柽柳黄素对胰岛素抵抗的影响,本实验拟通过建立3T3-L1脂肪细胞胰岛素抵抗模型,观察柽柳黄素对细胞增殖分化、Glu的摄取和细胞内TG的影响,并进一步探索AMPK信号通路中与糖脂代谢相关基因和蛋白在改善胰岛素抵抗中的作用机制。该研究为柽柳黄素在糖脂代谢紊乱性疾病方面的作用及其作用机制探讨奠定了一定的基础。
1 材料与方法
1.1 实验材料
1.1.1 细胞株
小鼠3T3-L1脂肪前体细胞,购自于北京医学科学院基础医学研究所。
1.1.2 药物与试剂
柽柳黄素(天津万象恒远科技有限公司,批号20160828);地塞米松、MTT噻唑蓝、罗格列酮、DMSO、油红O、IBMX(美国Sigma公司,批号分别为D1756、M2128、R2408、V900090、O0625、I5879);FastQuant cDNA第一链合成试剂盒,SYBR Green试剂盒(天根生化科技北京有限公司,批号分别为KR106-02和FP205-02);DMEM(高糖)(美国HyClone公司,批号SH30022.01);胎牛血清,胰蛋白酶(美国Gibco公司,批号分别为16000044、25210056);PS,Trizol Reagent(美国 Invitrogen公司,批号分别为15070066、15596018);重组人源胰岛素(北京索莱宝科技有限公司,批号I8830);葡萄糖含量测定试剂盒(北京普利莱基因技术有限公司,批号E1010);甘油三酯含量测定试剂盒(北京诺博莱德科技有限公司,批号0510A17);Phospho-AMPKα 抗体、Phospho-ACC 抗体、Phospho-PKB 抗体、Fatty Acid Synthase 抗体、β-Actin 抗体(美国CST公司,批号分别为2531S、11818T、4060T、3180T、4970T);PPARα抗体(美国ABcam公司,批号ab24509);Goat Anti-Rabbit IgG(H+L)HRP(美国Affinity公司,批号S0001);引物合成(上海生物工程技术服务有限公司)。
1.1.3 实验仪器
OLYMPUS CKX31型倒置相差显微镜(日本Olympus公司);IL-161HI型二氧化碳培养箱(施都凯仪器设备上海有限公司);ClightCycler480II型实时荧光定量PCR仪(瑞士Roche公司);Varioskan Flash型全波长酶标仪(美国Thermo公司);Nanodrop型超微量分光光度计(美国Thermo公司);SW-CJ-2D型双人单面净化工作台(苏州净化设备有限公司);JY300C型电泳仪及水平电泳槽(北京市六一仪器厂);MultiGel-21型多功能冷光荧光影像定量分析系统(台湾TOPBIO公司);ImageQuant 350 型荧光化学发光成像仪(美国GE公司)。
1.2 实验方法
1.2.1 MTT法检测柽柳黄素对3T3-L1脂肪细胞存活率的影响
待96孔细胞培养板中细胞贴壁生长至覆盖板底70~80%左右,配制浓度分别为0、0.195、0.390、0.781、1.563、3.125、6.250、12.500、25.000、50.000 μg/mL的待测样品,弃掉原培养液,加入样品,置于37 ℃、5%CO2培养箱内继续培养,48 h后按20 μL/孔加入5×MTT溶液,继续培养4 h,取出后吸去旧培养液,加入150 μL/孔DMSO,放于酶标仪中,振荡30 s,测定OD在492 nm处的吸收值。
1.2.2 3T3-L1脂肪细胞油红O染色鉴定
将培养液换成含有0.5 mmol/L IBMX、1 μmol/L地塞米松和10 μg/mL胰岛素的高糖DMEM完全培养液进行诱导分化,培养48 h后,换为含10 μg/mL胰岛素的高糖DMEM完全培养液培养,继续培养48 h后,换为高糖DMEM完全培养液维持培养,培养至第12 天,约90%细胞分化为成熟脂肪细胞,收集,PBS洗3次,加10%中性甲醛固定30 min,油红O染料室温下孵育15 min,脱色液(60%异丙醇)洗3次,倒置显微下观察细胞分化情况。
1.2.3 3T3-L1脂肪细胞胰岛素抵抗模型的建立
3T3-L1脂肪细胞诱导分化成功后,分别在高糖DMEM完全培养液(含1 μmol/L地塞米松)中继续培养24、48、72 h,按照葡萄糖含量测定试剂盒说明书检测细胞对葡萄糖摄取情况。
1.2.4 柽柳黄素对细胞Glu摄取量和细胞内TG含量的测定
1.2.4.1 细胞对Glu摄取量测定
诱导成功后,将培养液换成含有1 μmol/L地塞米松的DMEM(高糖)完全培养基孵育24 h,使用含有1 μmol/L地塞米松的DMEM(高糖)完全培养基配制药物并进行细胞换液,孵育48 h,根据葡萄糖含量测定试剂盒说明书检测细胞对葡萄糖摄取情况。
1.2.4.2 细胞内TG含量测定[14]
按照“1.2.4.1”操作,根据甘油三酯含量测定试剂盒说明书测定细胞内甘油三酯含量。
1.2.5 qRT-PCR检测AMPK信号通路相关基因的表达
1.2.5.1 抽提总RNA及cDNA的合成
细胞诱导成功后,在高糖DMEM完全培养液(含1 μmol/L地塞米松)中继续培养24 h后,使用含有1 μmol/L地塞米松的DMEM(高糖)完全培养液配制药物,设置正常对照组、模型对照组、罗格列酮组及药物组,继续培养48 h后,用Trizol 法抽提细胞中的总RNA,测定总RNA浓度及OD在260 nm和280 nm的比值,按FastQuant cDNA第一链合成试剂盒说明进行反转录,合成cDNA。
1.2.5.2 引物设计及合成
根据NCBI公布的小鼠基因序列,设计上下游引物,引物序列见表1。
1.2.5.3 qRT-PCR
根据SuperReal PreMix Plus(SYBR Green)试剂盒说明应用于实时荧光定量PCR仪进行实验,采用2-△△CT方法计算各基因相对含量,每组实验重复3次。
1.2.6 柽柳黄素与AMPK信号通路相关蛋白分子对接
结合AMPK信号通路,在PDB数据库(www.rcsb.org)中搜索相关蛋白,通过Discovery Studio 4.5软件对靶蛋白进行处理,使用Chembio 3D软件构建各化合物的三维结构,导入Discovery Studio 4.5软件。采用不同对接方法(CDOCKER、LibDock、LigandFit)将结晶复合物中小分子配体对接到蛋白结晶中,然后与原结晶复合物中的小分子进行均方根偏差(RMSD)值比较,以此验证和选择对接方法。

表1 AMPK信号通路相关基因引物序列
1.2.7 Western blot检测AMPK信号通路相关蛋白的表达
诱导成功后,在高糖DMEM完全培养液(含1 μmol/L地塞米松)中继续培养24 h后,使用含有1 μmol/L地塞米松的DMEM(高糖)完全培养液配制药物,设置正常组、模型组、阳性对照组及药物组,继续培养48 h后,收集细胞,去培养液后用预冷的PBS冲洗3遍,加入配好的裂解液,刮下细胞后在EP管中冰上充分裂解30 min,期间涡旋3次。4 ℃下以12 000 rpm离心10 min,用BCA检测试剂盒测蛋白质浓度,样品分别加5×缓冲液(稀释成1×),涡旋,99 ℃煮10 min,冷却到室温后-20 ℃保存。依次进行SDS-PAGE电泳、转膜、封闭及抗体孵育、发光及显影,采用Image J软件对条带进行灰度分析,每组实验重复3次。
1.2.8 数据处理
2 结果
2.1 MTT法检测柽柳黄素对3T3-L1脂肪细胞存活的影响
随着药物浓度的增加,柽柳黄素对细胞生长的抑制作用逐渐增强,通过计算,柽柳黄素IC50为33.79±13.60 μg/mL,结果见表2。
2.2 油红O染色鉴定
诱导分化前3T3-L1细胞呈不规则梭形成纤维细胞形态,细胞内无脂滴;诱导分化后细胞呈椭圆形、圆形,并分化为成熟脂肪细胞,细胞内脂滴明显,分布于细胞核周围,油红O染色后,脂滴呈红色,鉴定结果见图1。
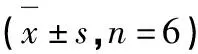
表2 柽柳黄素对3T3-L1脂肪细胞存活的影响

图1 T3-L1脂肪细胞诱导前(A)和诱导后(B)显微图
2.3 3T3-L1脂肪细胞胰岛素抵抗模型的建立
3T3-L1脂肪细胞的诱导分化成功后,在地塞米松中孵育48 h,模型组细胞对葡萄糖的摄取较正常对照组显著降低(P<0.05);在地塞米松中孵育72 h,模型组细胞对葡萄糖的摄取较正常对照组显著降低(P<0.01),表明诱导分化后3T3-L1脂肪细胞在地塞米松中孵育48~72 h后胰岛素抵抗模型建立成功,结果见表3。
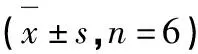
表3 3T3-L1脂肪细胞胰岛素抵抗中的Glu摄取
注:与正常组比较,*P<0.05;**P<0.01。
Note:Compared with normal group,*P<0.05;**P<0.01.
2.4 细胞对Glu的摄取
与模型组比较,柽柳黄素低、高两个剂量组均对3T3-L1脂肪细胞葡萄糖的摄取显著增加(P<0.01),表明柽柳黄素具有促进3T3-L1脂肪细胞对Glu的摄取,结果见表4。
2.5 细胞内TG的含量
与模型组比较,柽柳黄素高剂量组对3T3-L1脂肪细胞内甘油三酯有显著降低(P<0.05),表明柽柳黄素具有降低3T3-L1脂肪细胞内TG的作用,结果见表5。
2.6 qRT-PCR检测AMPK信号通路相关基因的表达
与模型组比较,柽柳黄素显著提高AMPK基因的表达(P<0.01),以及显著降低FAS基因的表达(P<0.05),结果见表6和图2。
2.7 柽柳黄素与AMPK信号通路相关蛋白分子对接
柽柳黄素与AMPK、FAS、PPARα和PKB蛋白均具有一定的分子对接结合能力,其中能与FAS蛋白上多个氨基酸残基靶点结合,主要有范德华力、π键、氢键等结合键,表明柽柳黄素与FAS蛋白对接较好,柽柳黄素与FAS蛋白分子对接模拟图见图3。

表4 化合物对3T3-L1脂肪细胞Glu摄取的影响
注:与模型组比较,**P<0.01。
Note:Compared with modell group,**P<0.01.

表5 化合物对3T3-L1脂肪细胞内TG含量的影响
注:与模型组比较,*P<0.05;**P<0.01。
Note:Compared with modell group,*P<0.05;**P<0.01.

表6 3T3-L1脂肪细胞AMPK信号通路相关基因的mRNA相对表达量
注:与模型组比较,*P<0.05;**P<0.01。
Note:Compared with model group,*P<0.05;**P<0.01.

图2 柽柳黄素对AMPK信号通路相关基因的影响
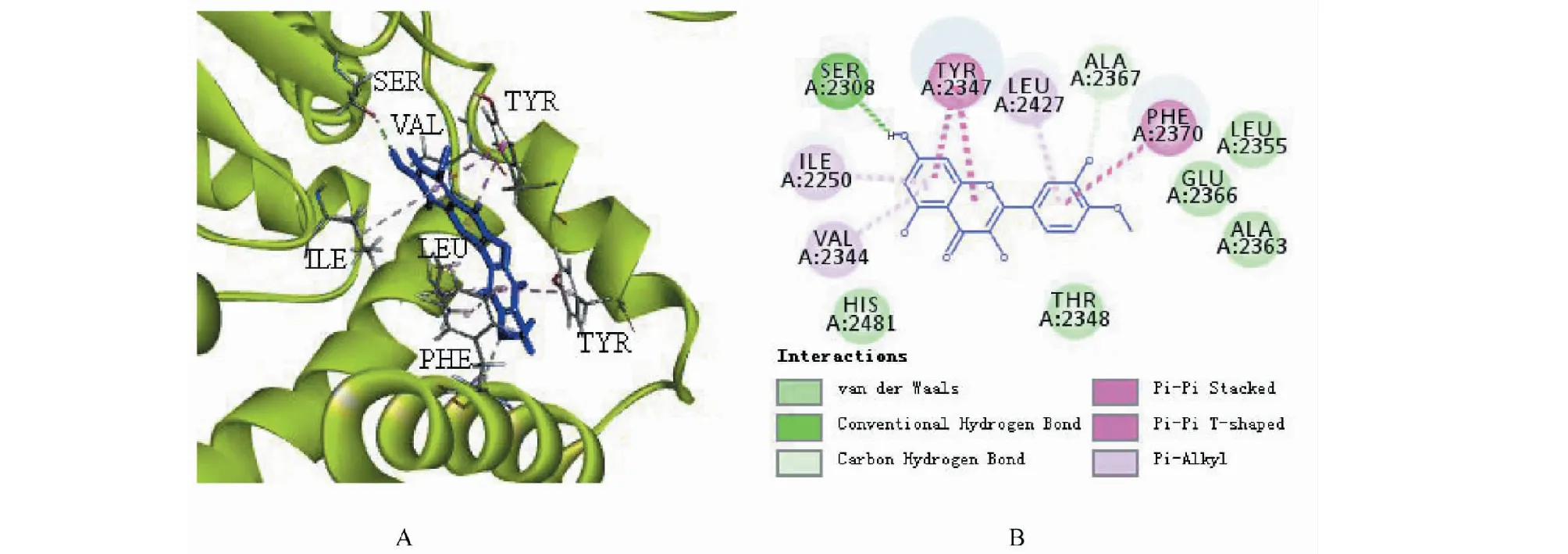
图3 柽柳黄素与FAS蛋白分子对接3D(A)和2D(B)模拟图

图4 柽柳黄素对AMPK信号通路相关蛋白的影响
2.8 Western blot检测AMPK信号通路相关蛋白的表达
与模型组比较,柽柳黄素可增加磷酸化AMPK(P-AMPK)、磷酸化ACC(P-ACC)、磷酸化PKB(P-PKB)和PPARα蛋白的表达,可抑制FAS蛋白的表达,但无显著性差异,结果见图4、5和表7。
3 结论
柽柳黄素给予剂量增大到25 μg/mL时,细胞存活下降;油红O染色法鉴定诱导分化前后3T3-L1脂肪细胞发现,细胞诱导分化后出现明显的红色脂滴;利用地塞米松孵育48~72 h后,模型细胞对葡萄糖的摄取量(或消耗量)明显减少(P<0.01),胰岛素抵抗模型建立;药效学研究考察发现柽柳黄素作用48 h后,细胞对Glu的摄取显著增加(P<0.01),细胞内TG含量显著降低(P<0.05或P<0.01),说明柽柳黄素具有一定的降糖调脂作用。

表7 3T3-L1前体细胞AMPK信号通路相关蛋白的相对表达量
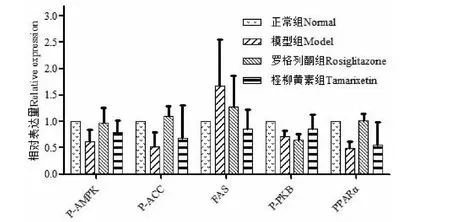
图5 柽柳黄素对AMPK信号通路相关蛋白的表达
AMPK是生物能量代谢调节的关键分子,是研究糖脂代谢紊乱及其他相关代谢疾病的核心,它表达于各种代谢相关器官中,能被机体各种刺激激活,对机体保持葡萄糖平衡起着重要的调节作用[15]。磷酸化的AMPK能开启GLUT4的基因表达,而GLUT4数量的增加,促进了细胞对Glu的摄取;ACC和FAS分别是脂肪酸合成的限速酶和合成酶,它们的表达影响着脂肪的含量,AMPK的活化能磷酸化ACC抑制其发挥作用,同时还通过抑制ACC基因的表达限制脂肪酸的合成[16],激活AMPK导致SREBP-lc基因表达的降低,从而抑制FAS基因的表达,影响TG的生成[17];Adiponectin能增加骨骼肌细胞脂肪酸氧化和糖吸收,可以激活AMPK,而Leptin参与糖、脂肪及能量代谢的调节,增加能量释放,抑制脂肪细胞的合成[18];IRS-1、IRS-2属于胰岛素底物受体,其表达水平的降低可导致胰岛素信号转导障碍进而引发胰岛素抵抗[19];PKB表达的降低,会使胰岛素信号传递受阻,导致葡萄糖摄取和糖原合成减少[20];而PPARα的表达,增加脂肪酸氧化,减少细胞内TG的含量。
在进行柽柳黄素对3T3-L1脂肪细胞作用机制探讨中,我们选择AMPK信号通路主要相关基因和蛋白进行研究,这些基因或因子直接或间接影响AMPK的表达,从而影响葡萄糖和脂肪水平。通过柽柳黄素对10个基因进行qRT-PCR的研究,发现柽柳黄素显著提高AMPK基因的表达(P<0.01)和显著降低FAS基因的表达(P<0.05),可见,柽柳黄素影响AMPK信号通路,对FAS基因的表达具有显著抑制作用,从而影响TG的生成;在进行Western blot研究前,将柽柳黄素与相关蛋白进行分子对接,以此预测化合物与蛋白的结合能力[21,22],其中柽柳黄素与FAS蛋白结合较好;Western blot检测结果显示柽柳黄素均可增加磷酸化AMPK、磷酸化ACC、磷酸化PKB和PPARα蛋白和抑制FAS蛋白的表达,但无显著性差异。
柽柳黄素作为槲皮素体内的主要代谢产物,在对3T3-L1脂肪细胞胰岛素抵抗的改善方面具有与槲皮素相似的作用。上述结果说明,柽柳黄素具有增加3T3-L1脂肪细胞对Glu的摄取和降低细胞内TG含量,其作用机制可能与AMPK信号通路中相关基因和蛋白表达有关,具体机制还需进一步研究。该研究阐明了槲皮素体内代谢产物柽柳黄素具有调节糖脂代谢紊乱的作用,为柽柳黄素降糖调脂方面的研究和开发奠定了基础。

