原产地和入侵地紫茎泽兰对泽兰实蝇寄生的耐受性及其生理响应
孙昂 和淑琪 陈亚平 卢元顺 赵文杰 段艳茹 桂富荣

摘要:【目的】研究入侵植物紫莖泽兰对专食性天敌泽兰实蝇寄生的耐受性并探讨其入侵前后的生理响应,为紫茎泽兰的生物防治提供理论依据。【方法】泽兰实蝇寄生后,于初现羽化窗时测量紫茎泽兰原产地(墨西哥)和入侵地(中国)种群叶片脯氨酸(Pro)、丙二醛(MDA)含量及多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性等生理指标;全部羽化后测定并计算紫茎泽兰的株高、总生物量、根冠比和比茎长等生长指标,比较分析泽兰实蝇寄生后不同种群紫茎泽兰的抗性和耐受性。【结果】在泽兰实蝇寄生条件下,入侵地紫茎泽兰的总生物量、茎生物量比和根冠比较原产地种群分别显著升高37.80%、15.38%和21.77%(P<0.05,下同);入侵地紫茎泽兰PAL、POD和SOD活性分别较原产地显著降低46.91%、46.60%和37.52%,而PPO活性与原产地紫茎泽兰无显著差异(P>0.05);同时,入侵地紫茎泽兰的Pro和MDA含量分别较原产地显著增加66.30%和145.08%。【结论】入侵后紫茎泽兰的资源分配策略发生改变,入侵地紫茎泽兰种群对泽兰实蝇寄生的耐受性增强,对泽兰实蝇的防御响应有所降低,防御策略发生改变。
关键词: 紫茎泽兰;泽兰实蝇;耐受性;生理特性
中图分类号: S451.1 文献标志码: A 文章编号:2095-1191(2020)05-1128-08
Abstract:【Objective】The tolerance of the invasive plant Ageratina adenophora(Sprengel) R. King & H. Robinson parasitized by Procecidochares utilis Stone were studied to compare its physiological response of native and invasive populations, and to provide theoretical basis for the biological control of A. adenophora. 【Method】Measured the leaf physiological activity of A. adenophora from native(Mexico) and invaded(China) populations at the feather window[proline(Pro), malondialdehyde(MDA), polyphenol oxidase(PPO), phenylalanine ammonia-lyaseenzymes(PAL), catalase(POD) and superoxide dismutase(SOD) activities], as well as growth indexes such as plant height, total biomass, root-to-shoot ratio and specific stem length after all emergence,the differences of resistance and tolerance of A. adenophora under the parasitism of P. utilis were analyzed. 【Result】Under the parasitic conditions of P. utilis, the total biomass, stem biomass ratio and root-shoot ratio of A. adenophora invasive population increased significantly by 37.80%, 15.38% and 21.77%, respectively(P<0.05, the same below). The activities of PAL, POD and SOD were significantly reduced by 46.91%, 46.60% and 37.52% respectively compared with the native. However, there was no significant difference in the PPO activity of A. adenophora between invasive population and native populationafter parasitism(P>0.05). The content of Pro and MDA of A. adenophora invasive population increased significantly by 66.30% and 145.08% compared with the native. 【Conclusion】The A. adenophora may change the resource allocation strategy after invasion, the invasive population of A. adenophora increase tolerance to the parasitism of P. utilis, while reduce the defense response to the parasitism of P. utilis. Defense strategy has changed.
Key words: Ageratina adenophora(Sprengel) R. King & H. Robinson; Procecidochares utilis Stone; tolerance; physiological characteristics
Foundation item: National Natural Science Foundation of China(31660546)
0 引言
【研究意义】紫茎泽兰[Ageratina adenophora (Sprengel) R. King & H. Robinson]为多年生草本植物,原产于墨西哥,于20世纪40年代传入我国(万方浩等,2011)。因其繁殖力強、适生性广,已成功入侵多个国家和地区,是世界上危害最严重的入侵植物之一(Sang et al.,2010;朱文达等,2018)。目前云南省紫茎泽兰的发生面积达2480万ha,占全省总面积的67%,遍及100多个县(市)(鲁萍等,2005),造成了严重的经济损失和环境破坏(Gui et al.,2009)。泽兰实蝇(Procecidochares utilis Stone)被认为是有效控制紫茎泽兰的专食性天敌,并先后在新西兰和澳大利亚等国用于防治紫茎泽兰(马沙等,2012)。为遏制紫茎泽兰的扩张,自20世纪80年代开始,我国将专食性天敌泽兰实蝇引入云南部分地区,之后又引入四川及贵州等地释放(王吉秀等,2013;兰明先等,2018),但泽兰实蝇对我国境内紫茎泽兰的实际控制效果并不理想(李爱芳等,2006)。因此,比较泽兰实蝇寄生对原产地和入侵地紫茎泽兰生长及生理特性的影响,分析原产地与入侵地紫茎泽兰对专性寄生天敌的耐受性,并探讨入侵植物紫茎泽兰防御策略改变对生物防治效果的影响,可为更好地利用天敌防控紫茎泽兰提供理论依据。【前人研究进展】植物在受到昆虫取食后,为阻碍昆虫进一步的干扰和胁迫,会通过改变自身的物理结构或调节生长来进行防御(Wang et al.,2012)。高芳磊等(2018)研究了昆虫采食对不同生境下空心莲子草生长及化学防御反应的差异,发现模拟昆虫采食处理显著抑制了不同生境下空心莲子草的总生物量和根、茎、叶生物量,也影响了水生生境、水陆两栖生境及陆生生境下空心莲子草的生物量分配(根、茎、叶生物量分配和根冠比)。同时,植物体内的可溶性物质(可溶性糖、可溶性蛋白和游离氨基酸等)及保护性生物酶[多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等]也会在昆虫取食后发生改变,从而起到防御保护作用,防止昆虫的进一步取食(邓小霞等,2013;王馨雨等,2020)。季梅等(2014)研究发现薇甘菊叶片中的主要防御性酶活在颈盲蝽取食48 h后发生显著改变,其中PAL和过氧化物酶(POD)活性下降,而PPO活性升高;张洪英等(2016)研究发现豌豆蚜取食苜蓿7 d后,抗虫品种中的可溶性糖和PAL、SOD、POD等保护性酶活性显著高于低抗品种。对于外来入侵植物而言,入侵植物摆脱了原产地与其协同进化自然天敌的调控,会通过改变资源分配策略将原本用于防御的资源用于生长,从而取得更强的竞争优势,迅速扩张,即竞争力增强进化假说(EICA)(Müller-Sch?rer et al.,2004)。乌桕入侵美国后,与我国原产地种群相比,入侵地乌桕表现为生长速度快、竞争力强,且具有较低的根冠比和较高的叶面积指数,其对环境的抗逆性更强(Zou et al.,2007);同时,入侵地乌桕中专食性昆虫的防御物质(单宁)含量降低,对专食性昆虫表现出更低的抗性(Wang et al.,2012)。周方等(2017)通过比较不同营养条件下不同产地喜旱莲子草的生长指标,发现高营养条件下入侵地和原产地喜旱莲子草的生物量及比茎长受到显著影响,入侵地种群表现较高的生物量和较低的比茎长,表明其对天敌的防御力降低,更偏向于生长竞争。外来入侵植物在新栖境对天敌的防御策略一直备受关注(黄伟等,2013)。目前,针对紫茎泽兰入侵后防御策略改变的研究多集中在紫茎泽兰入侵后其抗虫物质改变,以及入侵植物紫茎泽兰对气候的适应性方面。张常隆等(2009)研究发现,紫茎泽兰较高的表观可塑性对于紫茎泽兰在不同海拔生境的扩张起到重要作用。高鑫等(2018)研究表明,被泽兰实蝇寄生后,原产地紫茎泽兰的单宁和类黄酮物质含量增长高于入侵地植物,原产地植物表现为更强的抗性。【本研究切入点】李爱芳等(2006)研究发现泽兰实蝇对我国境内紫茎泽兰的实际控制效果并不理想;本课题组在野外的实际调查中也发现泽兰实蝇对紫茎泽兰的防治效果低,难以控制其扩张与危害。目前,针对紫茎泽兰被专食性天敌泽兰实蝇寄生后,入侵地和原产地紫茎泽兰在防御策略中的耐受性生长指标及防御性酶活性的改变鲜有报道。【拟解决的关键问题】通过比较分析泽兰实蝇寄生条件下原产地与入侵地紫茎泽兰生长指标和生理指标,得出紫茎泽兰入侵过程中对寄生性天敌防御策略的变化,以期为紫茎泽兰的生物防治提供理论依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试土壤 采用云南昆明典型的红壤土,土壤去除杂质、过筛后保存;腐殖土购自昆明斗南花鸟市场。将灭菌的红壤和腐殖土以2∶1混合均匀后备用。
1. 1. 2 供试植株 紫茎泽兰原产地种群(墨西哥)种子来自农业农村部外来入侵生物预防与控制研究中心,入侵地种群(中国)种子采自云南昆明市(东经102°44′,北纬25°09′),均种植于云南农业大学温室大棚,开展同质园试验。挑选大小一致、颗粒饱满的原产地及入侵地紫茎泽兰种子在育苗盘内育苗,将育苗盘分别置于光照培养箱[温度(27±1)℃,相对湿度75%,光周期16L∶8D,下同]中培育3个月;选择长势良好、大小一致的紫茎泽兰植株,单株分别移栽至塑料盆(盆高12 cm,口径15 cm),置于温室中培育,每2 d调整花盆的位置,植株生长至6个月时备用。
1. 1. 3 供试虫源 泽兰实蝇采自云南农业大学。采集带有虫瘿的紫茎泽兰枝条,带回实验室后摘除多余的枝叶,将虫瘿末端用湿润的脱脂棉包裹(每隔2 d补充一次水分),置于八角瓶内,八角瓶上部用纱网(100目)笼罩,置于光照培养箱中每日观察。待完全羽化取出泽兰实蝇成虫置于预先放有紫茎泽兰植株的纱笼内(纱网100目,大小1.2 m×0.7 m×0.9 m)培育3代以上,供试验接虫使用。
1. 2 试验方法
1. 2. 1 寄生试验 选取原产地和入侵地长势一致、株高在10 cm左右的紫茎泽兰幼苗各40株,其中,原产地和入侵地紫茎泽兰各20株,分别用1个白色纱网笼罩,确保排除外界其他干扰,放入光照培养箱,任其自然生长,作为未寄生的对照组(CK);另外,选取原产地和入侵地紫茎泽兰植株各20株,分别用1个白色纱网笼罩,再向每个纱笼内放入24对泽兰实蝇成虫,让其自然寄生,作为寄生组,置于光照培养箱培养。寄生5 d后取出所有泽兰实蝇成虫,定期检查记录泽兰实蝇寄生虫瘿数量。待植株上的虫瘿出现羽化窗时,选择羽化窗个数均为3个、虫瘿直径相近的紫茎泽兰植株各3株进行生理指标测定;未寄生的对照组选择与寄生组长势基本一致的紫茎泽兰植株各3株进行测定。待成虫完全羽化,剩余的植株用于生长指标测定。所有植株每3 d浇一次水,每天重新排列各试验盆的位置,以消除可能存在的位置差异。
1. 2. 2 生理指标测定 脯氨酸(Pro)、丙二醛(MDA)、PPO、PAL、POD和SOD采用南京建成生物工程研究所研发的试剂盒进行测定。酶源蛋白含量测定参考高俊凤(2006)的方法:采用考马斯亮蓝G-250法,分别称取寄生组和对照组紫茎泽兰虫瘿部位的叶片0.2 g,加入5.0 mL蒸馏水研磨,5000×g离心10 min,取上清液,再用蒸馏水冲洗研钵2~3次,合并上清液定容至10.0 mL;取上清液0.1 mL,加入5.00 mL考马斯亮蓝G-250试剂和0.9 mL蒸馏水后摇匀,在分光光度计595 nm处测定吸光值,根据标准曲线和样品吸光值计算可溶性蛋白含量。
1. 2. 3 生长指标测定 选择寄生组与对照组的原产地和入侵地紫茎泽兰各10株(共计40株)。整株植株去除培养土并洗净,将植物根、茎、叶分离,分别测定植株根生物量、茎生物量、叶生物量、主枝干重和主枝长,80 ℃下烘干48 h至恒重,测量各部分的干质量。计算总生物量(Total biomass,TB)、茎生物量比(Stem mass ratio,SMR)、根生物量比(Root mass ratio,RMR)、叶生物量比(Leaf mass ratio,LMR)、比茎长(Specific stem length,SSL)和根冠比(Root/shoot ratio,RSR)。其中,茎生物量比=茎生物量/总生物量、根生物量比=根生物量/总生物量、叶生物量比=叶生物量/总生物量、比茎长=主枝长/主枝干重、根冠比=地下干重/地上干重。
1. 3 统计分析
所有數据均运用Excel 2003和SPSS 24.0进行处理,应用独立样本T 检验分析原产地与入侵地紫茎泽兰生长和生理指标的差异;以泽兰实蝇寄生条件(寄生和未寄生)和紫茎泽兰种群(原产地和入侵地)为处理因子,应用双因素方差分析(Two-way ANOVA)进行不同来源地和泽兰实蝇寄生对紫茎泽兰生长影响试验数据的差异显著性检验。数据采用平均数±标准差表示,用GraphPad Prism 8.0制图。
2 结果与分析
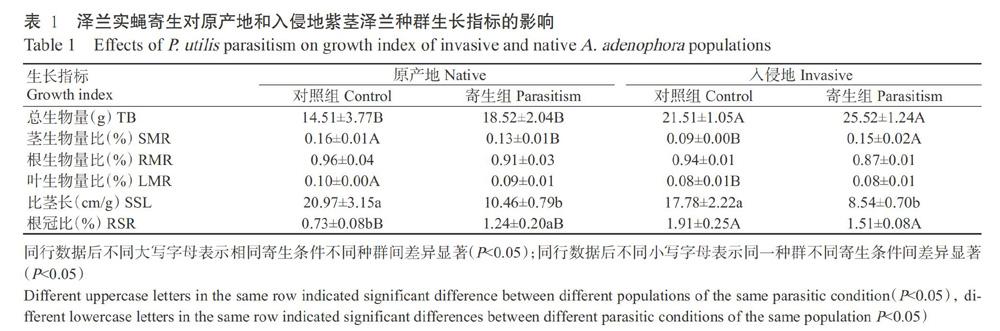
2. 1 泽兰实蝇寄生对原产地和入侵地紫茎泽兰生长指标的影响
入侵地和原产地紫茎泽兰种群的生长指标测定结果(表1)显示,在未被寄生(对照)条件下,入侵地紫茎泽兰的总生物量和根冠比较原产地种群分别显著升高48.24%和161.64%(P<0.05,下同);比茎长和根生物量比虽然较原产地种群有所降低,但差异不显著(P>0.05,下同);茎生物量比和叶生物量比较原产地种群分别显著降低43.75%和20.00%,说明入侵地紫茎泽兰的生长势优于原产地。在泽兰实蝇寄生条件下,原产地紫茎泽兰的根冠比较未寄生组显著升高69.86%;入侵地和原产地紫茎泽兰的根生物量比分别较未寄生组降低7.45%和5.21%,二者间差异不显著;入侵地紫茎泽兰的总生物量、茎生物量比和根冠比较原产地种群分别显著升高37.80%、15.38%和21.77%;入侵地紫茎泽兰的根生物量比低于原产地4.40%,二者间无显著差异;入侵地和原产地紫茎泽兰的比茎长分别较未寄生组显著降低51.97%和50.12%。
2. 2 泽兰实蝇寄生条件和紫茎泽兰种群对紫茎泽兰生长指标影响的双因素方差分析结果
进行泽兰实蝇寄生条件和紫茎泽兰种群对紫茎泽兰生长指标影响的双因素方差分析,结果(表2)显示,总生物量和叶生物量比受到泽兰实蝇种群(不同来源地)的显著影响;根生物量比受到寄生条件的显著影响;比茎长受到寄生条件的极显著影响(P<0.01,下同);茎生物量比和根冠比受到种群和寄生双因素的共同极显著影响。
2. 3 泽兰实蝇寄生对原产地和入侵地紫茎泽兰生理指标的影响
2. 3. 1 对紫茎泽兰Pro和MDA含量的影响 由图1可知,在未被泽兰实蝇寄生的条件下,入侵地紫茎泽兰的Pro和MDA含量分别为47.72和11.89 ?g/g,分别较原产地显著升增加31.80和9.22 ?g/g。被泽兰实蝇寄生后,原产地紫茎泽兰的Pro和MDA含量分别较未寄生组显著增加了9.09和3.74 ?g/g;入侵地紫茎泽兰的MDA含量与未寄生组相比增加3.81 ?g/g,但差异不显著;寄生后入侵地紫茎泽兰的Pro和MDA含量分别较原产地寄生组显著增加66.30%和145.08%。泽兰实蝇寄生后,原产地紫茎泽兰的Pro和MDA含量显著上升,而入侵地紫茎泽兰的Pro和MDA含量无显著变化,表明泽兰实蝇寄生会显著影响原产地紫茎泽兰的Pro和MDA含量,而对入侵地紫茎泽兰无显著影响。
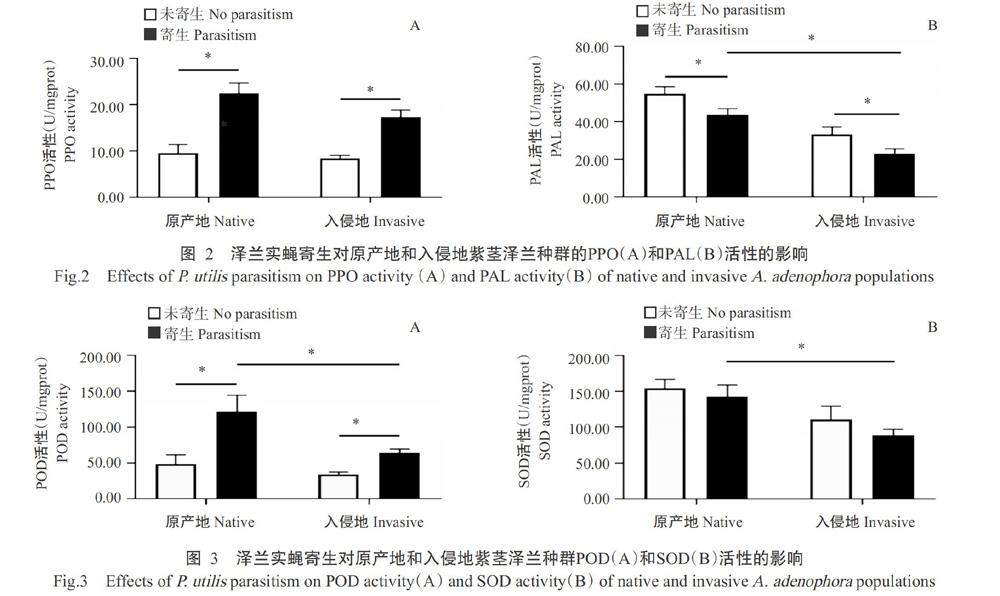
2. 3. 2 对紫茎泽兰PPO和PAL活性的影响 由图2可知,在未被泽兰实蝇寄生的条件下,原产地紫茎泽兰的PPO和PAL活性分别为9.58和54.92 U/mgprot,而入侵地的PPO和PAL活性分别为8.44和33.36 U/mgprot,原产地和入侵地紫茎泽兰的PPO和PAL活性无显著差异。泽兰实蝇寄生后,原产地紫茎泽兰的PPO活性较未寄生组显著增加12.88 U/mgprot;入侵地紫茎泽兰的PPO活性较未寄生组显著增加8.95 U/mgprot;而寄生后入侵地紫茎泽兰的PPO活性与原产地紫茎泽兰无显著差异。泽兰实蝇寄生后,原产地紫茎泽兰的PAL活性较未寄生组显著降低11.24 U/mgprot;入侵地紫茎泽兰的PAL活性较未寄生组显著降低10.17 U/mgprot。泽兰实蝇寄生后,入侵地紫茎泽兰的PAL活性较原产地紫茎泽兰显著降低46.91%。
2. 3. 3 对紫茎泽兰POD和SOD活性的影响 由图3可知,在未被泽兰实蝇寄生的条件下,原产地紫茎泽兰的POD和SOD活性分别为48.60和154.43 U/mgprot,入侵地紫茎泽兰的POD和SOD活性分别为33.71和111.17 U/mgpro,原产地和入侵地紫茎泽兰的POD和SOD活性无显著差异。泽兰实蝇寄生后,原产地紫茎泽兰的POD活性较未寄生组显著增加72.96 U/mgprot;同时入侵地紫茎泽兰的POD活性较未寄生组显著增加30.19 U/mgprot。泽兰实蝇寄生后,入侵地紫茎泽兰的POD和SOD活性分别较原产地显著降低46.60%和37.52%。
3 讨论
一个外来物种到达一个新生境后,可能通过调整自身生长而适应新的生境(Trtikova,2009;Trtikova et al.,2010,2011)。植物被昆虫取食后,具有一定的自然补偿能力(朱长华等,2011)。天敌取食植物的地上部分,比茎长越小说明植株茎秆越粗,越有利于钻茎化蛹类天敌的生长和繁殖(Pan et al.,2013)。根冠比与天敌的取食作用及植物的耐受性有关(Strauss and Agrawal,1999)。本研究测定比较泽兰实蝇寄生后入侵地和原产地紫茎泽兰的生长指标,发现入侵地紫茎泽兰的比茎长虽低于原产地植株但无显著差异,而总生物量和茎生物量比显著高于原产地植株,表明入侵地紫茎泽兰种群对专食性天敌的防御能力降低;同时,入侵地紫茎泽兰有较高的根冠比,表明当地上部分受到泽兰实蝇寄生后,紫茎泽兰能增大根部生物量,从土壤中获得更多的养分,增强其耐受性。本研究发现,不同生物量指标受不同因素的影响,其中茎生物量比和根冠比受到种群和寄生条件的双因素极显著影响,表明在泽兰实蝇寄生条件下,入侵地紫茎泽兰的资源分配与原产地相比已发生改变。
泽兰实蝇寄生对紫茎泽兰生理指标具有不同程度的影响。Pro含量与植物的逆境胁迫存在相关性,Pro含量越高,植物抗逆性越强;MDA含量越高,质膜损伤程度越严重(李生军,2018)。邓小霞等(2013)研究发现,当棉花遭受棉蚜取食时,其膜脂过氧化产生大量的MDA,同時细胞受损释放出大量的Pro,游离Pro含量上升,平衡胞外渗透压,避免细胞受损。本研究中,在未寄生条件下,入侵地紫茎泽兰的Pro含量显著高于原产地,表明入侵地紫茎泽兰的抗逆性高于原产地;泽兰实蝇寄生后,原产地紫茎泽兰的Pro含量显著高于未寄生组,而入侵地紫茎泽兰的Pro含量较未寄生组未表现出显著差异,可能与入侵地植株的抗逆性强有关(江海澜等,2011);同时,在泽兰实蝇寄生后,入侵地紫茎泽兰的Pro含量显著高于原产地,也表明入侵地植株对泽兰实蝇寄生具有更强的耐受性。在未被寄生条件下,入侵地紫茎泽兰的MDA含量显著高于原产地,在泽兰实蝇寄生后,入侵地紫茎泽兰的MDA含量仍显著高于原产地,膜脂过氧化增多,可能与入侵地紫茎泽兰在泽兰实蝇寄生后活性氧的暴发和清除有关(刘福等,2018);同时,相对于未寄生条件下的紫茎泽兰,原产地植株在泽兰实蝇寄生后MDA含量显著上升而入侵地植株表现不敏感,可能与抗逆性有关(王昌全等,2008),入侵地植株的抗逆性更强。
PPO是广泛存在于植物中的一类含铜金属酶类,是一种缺乏底物或潜在的酚氧化酶。PPO通过与酚类物质作用而产生醌类物质,从而增强植物的抗虫性,保护植物免受伤害,且PPO还与木质素的合成有关,能增强植物的物理防御能力(梁郸娜等,2016;王馨雨等,2020)。张金等(2014)研究发现,被蚜虫取食后忍冬叶片的PPO活性随时间而变化,表明忍冬叶片抗性随着蚜虫取食时间而变化。本研究结果显示,在泽兰实蝇寄生后,原产地和入侵地紫茎泽兰的PPO活性均高于未寄生条件下的紫茎泽兰,说明泽兰实蝇寄生激活了紫茎泽兰中PPO酶活的表达,增加有毒酚类氧化物的合成,木质素合成增强,对泽兰实蝇的抗性增强,从而抵御泽兰实蝇的寄生。
PAL在植物体内主要负责催化L-苯丙氨酸生成反式肉桂酸,合成黄酮和生物碱等苯丙素类化合物,促进植保素和木质素合成(贺立红等,2006)。在本研究中,被泽兰实蝇寄生后,入侵地紫茎泽兰的PAL活性显著低于原产地紫茎泽兰,说明入侵地紫茎泽兰的抗性减弱;同时,入侵地和原产地紫茎泽兰的PAL活性均较未寄生组显著下降,说明泽兰实蝇的寄生并未激活PAL酶活的反应,并且在某种程度上降低了PAL活性,表明紫茎泽兰和泽兰实蝇互作过程中存在某种机制使得泽兰实蝇逃避来自植物的防御反应。张晓玉等(2014)发现不同毒性大斑病菌菌株会导致玉米叶片PAL活性的表达差异,且当PAL活性减少时才能正常侵染,因此猜测泽兰实蝇寄生后紫茎泽兰PAL活性的降低可能与泽兰实蝇的寄生机制有关。
植物可通过活性氧等信号分子调控自身SOD和POD等抗氧化酶活性以缓解昆虫取食造成的伤害,进而增强对生物胁迫的抵御能力(Mitton et al.,2016)。本研究中,泽兰实蝇寄生后,原产地和入侵地紫茎泽兰的POD活性显著上升,细胞内由泽兰实蝇寄生损伤激活的活性氧被大量清除,缓解细胞毒性,但寄生后原产地紫茎泽兰的POD和SOD活性均显著高于入侵地植株,可能与原产地紫茎泽兰在泽兰实蝇寄生后抗性表达更为强烈有关,诱发更多的活性氧暴发,从而更多的活性氧被清除(王勇等,2013)。
综上所述,在泽兰实蝇寄生条件下,入侵地紫茎泽兰的总生物量、茎生物量和根冠比及Pro含量等耐受性相关指标均显著高于原产地植株,表现为耐受性增强;而入侵地紫茎泽兰PAL活性显著低于原产地植株,比茎长和PPO活性也低于原产地植株但差异不显著,表现为抗虫性降低;POD和SOD活性在入侵地植株中显著低于原产地,更多的活性氧被清除,进而可能导致MDA含量显著高于原产地种群。
紫茎泽兰入侵后,受到更小的天敌压力,使得植物的资源分配策略发生变化,更多的资源投入到增加营养生长上(吕永苗,2018),表现出更强的耐受性。当植物受到逆境胁迫时,体内会诱导激活多种信号传导途径从而产生一系列复杂的生理生化反应,使植物对环境产生耐受性或抗性(朱麟等,2005)。这为专一性天敌泽兰实蝇对紫茎泽兰在云南等入侵地的生物防治效应提供理论依据。因此,如何更好地利用和创新专一性天敌昆虫对外来入侵植物的预防和控制技术,将是外来入侵植物生物防治技术发展的科学问题之一。同时,可考虑联合应用专一性天敌、广食性昆虫及致病微生物等多种生物因素来共同防治紫茎泽兰,探讨专食性天敌泽兰实蝇和广食性昆虫与致病微生物的相互作用,也可考虑结合使用寄生植物(张秀伟等,2009),弱化紫茎泽兰对单一寄生天敌泽兰实蝇的耐受强度。此外,以往对紫茎泽兰入侵机制的研究都是基于实验室进行测定,若将不同生态系统的种群进行类似的研究,将对揭示紫茎泽兰在入侵地的扩张和快速进化具有重要意义。
4 结论
当专食性天敌泽兰实蝇寄生紫茎泽兰后,入侵地紫茎泽兰的总生物量、茎生物量比和根冠比较原产地种群显著升高,而PAL、POD和SOD活性显著降低,说明泽兰实蝇的寄生可能使入侵后紫茎泽兰的资源分配策略发生改变,入侵地紫茎泽兰种群对专食性天敌泽兰实蝇的耐受性增强,抗性降低,防御策略发生改变。
参考文献:
邓小霞,江海澜,彭俊,何泽敏,马天文,王俊刚. 2013. 花铃期棉花对棉蚜刺吸胁迫的生理响应[J]. 应用昆虫学报,50(1):161-166. [Deng X X,Jiang H L,Peng J,He Z M,Ma T W,Wang J G. 2013. Physiological responses of cotton to feeding by Aphis gossypii during the flower-bolling stage[J]. Chinese Journal of Applied Entomology,50(1):161-166.]
高芳磊,郭素民,閆明,李钧敏,于飞海. 2018. 不同生境下空心莲子草响应模拟昆虫采食的生长和化学防御策略[J].生态学报,38(7):2344-2352. [Gao F L,Guo S M,Yan M,Li J M,Yu F H. 2018. Effects of simulated insect herbivory on the growth and chemical defense of Alternanthera philoxeroides in different habitats[J]. Acta Ecologica Sinica,38(7):2344-2352.]
高俊凤. 2006. 植物生理学实验指导[M]. 北京: 高等教育出版社:74-76. [Gao J F. 2006. Experimental instruction of plant physiology[M]. Beijing: Higher Education Press:74-76.]
高鑫,宋少杰,孙圆圆,古丽加孜·叶尔肯别克,杨国庆. 2018. 紫茎泽兰入侵前后抗虫物质含量差异及其对泽兰实蝇寄生的响应[J]. 生物安全学报,27(3):209-215. [Gao X,Song S J,Sun Y Y,Gulijiazi·Yeerkenbieke,Yang G Q. 2018. Contents of anti-herbivore substance from the native and invasive populations of Ageratina adenophora Sprengel and its response to parasitism by Procecidochares utilis Stone[J]. Journal of Biosafety,27(3): 209-215.]
贺立红,张进标,宾金华. 2006. 苯丙氨酸解氨酶的研究进展[J]. 食品科技,31(7):31-34. [He L H,Zhang J B,Bin J H. 2006. Research progress of phenylalanine ammonia-lyase[J]. Food Science and Technonogy,31(7): 31-34.]
黄伟,王毅,丁建清. 2013. 入侵植物乌桕防御策略的适应性进化研究[J]. 植物生态学报,37(9):103-114. [Huang W,Wang Y,Ding J Q. 2013. A review of adaptive evolution of defense strategies in an invasive plant species,Chinese tallow(Triadica sebifera)[J]. Chinese Journal of Plant Eco-logy,37(9):103-114.]
季梅,泽桑梓,赵宁,杨斌. 2014. 颈盲蝽取食对薇甘菊叶片防御性酶活性的影响[J]. 浙江农业学报,26(3):748-751. [Ji M,Ze S Z,Zhao N,Yang B. 2014. Effect of Pachypeltis sp. feeding on defense enzyme activities in Mikania micrantha leaves[J]. Acta Agriculturae Zhejiangensis,26(3):748-751.]
江海澜,王俊刚,邓小霞,何泽敏,马天文,彭俊. 2011. 草甘膦对龙葵苗期生理指标的影响[J]. 西北农业学报,20(6):186-189. [Jiang H L,Wang J G,Deng X X,He Z M,Ma T W,Peng J. 2011. Effect of glyphosate on the physiological character of Solanum nigrum[J]. Acta Argriculturae Boteali-occidentalis Sinica,20(6):186-189.]
兰明先,张某,李建一,鲁武锋,李召波,夏涛,李丽芳,吴国星,高熹. 2018. 泽兰实蝇幼虫内生细菌的分离鉴定及除草活性研究[J]. 江西农业学报,30(1):59-64. [Lan M X,Zhang M,Li J Y,Lu W F,Li Z B,Xia T, Li L F,Wu G X,Gao X. 2018. Isolation,identification and herbicidal activity of symbiotic bacteria in procecidochares utilis larvae[J]. Acta Agriculturae Jiangxi,30(1):59-64.]
李爱芳,高贤明,党伟光,黄荣祥,邓祖平,唐和春. 2006. 泽兰实蝇寄生状况及其对紫茎泽兰生长与生殖的影响[J]. 植物生态学报,30(3):496-503. [Li A F,Gao X M,Dang W G,Huang R X,Deng Z P,Tang H C. 2006. Parasitism of Procecidochares utilis and its effect on growth and reproduction of Eupatorium adenophorum[J]. Journal of Plant Ecology,30(3):496-503.]
李生军. 2018. 低温胁迫对唐古特莨菪脯氨酸、丙二醛含量的影响研究[J]. 农民致富之友,(20):33. [Li S J. 2018. Effects of low temperature stress on the content of proline and MDA in Tanggut[J]. Friends of Farmers Getting Rich,(20): 33.]
梁郸娜,胡其靖,曹磊,宋琳琳,徐强,齐晓花,周福才,陈学好. 2016. 蚜虫侵染对黄瓜叶片中丙二醛含量及保护酶活性的影响[J]. 江苏农业学报,32(2):278-284. [Liang D N,Hu Q J,Cao L,Song L L,Xu Q,Qi X H,Zhou F C,Chen X H. 2016. Effect of aphid(Aphis gossypii Glo-ver) infestation on MDA content and protective enzymes activities in cucumber[J]. Jiangsu Journal of Agricultural Sciences,32(2): 278-284.]
刘福,尉敬涛,王宇宏,余柯佳,王翔. 2018. 丛枝菌根真菌(AMF)对棉花抗病防御酶系活性影响的研究[J]. 山西科技,50(4):768-774. [Liu F,Wei J T,Wang Y H,Yu K J,Wang X. 2018. Effects of arbuscular mycorrhizal fungi (AMF) on cotton disease resistance defense enzymes[J]. Shanxi Science and Technology,50(4): 768-774.]
鲁萍,桑卫国,马克平. 2005. 外来入侵种紫茎泽兰研究进展与展望[J]. 植物生态学报,29(6):1029-1037. [Lu P,Sang W G,Ma K P. 2005. Progess and prospects in research of an exotic invasive species,Eupatorium adenophorum[J]. Acta Phytoecologica Sinica,29(6):1029-1037.]
吕永苗. 2018. 外来植物入侵机制的整合分析:原產地与入侵地的比较[D]. 上海:华东师范大学. [Lü Y M. 2018. The meta-analysis of exotic plant invasion mechanism:Comparison between native range and introduced range[D]. Shanghai: East China Normal University.]
马沙,高熹,朱家颖,吴国新,汪金荣,叶敏,肖春,李正跃. 2012. 温度及补充营养物对泽兰实蝇寿命的影响[J]. 生物安全学报,21(3):74-77. [Ma S,Gao X,Zhu J Y,Wu G X,Wang J R,Ye M,Xiao C,Li Z Y. 2012. Effects of temperature and supplementary nutrients on the life span of adult Procecidochares utilis(Diptera:Tephritidae)[J]. Journal of Biosafety,21(3):74-77.]
万方浩,刘万学,郭建英,强胜,李保平,王进军,杨国庆,牛红榜,桂富荣,黄文坤,蒋智林,王文琪. 2011. 外来植物紫茎泽兰的入侵机理与控制策略研究进展[J]. 中国科学:生命科学,41(1):13-21. [Wan F H,Liu W X,Guo J Y,Qiang S,Li B P,Wang J J,Yang G Q,Niu H B,Gui F R,Huang W K,Jiang Z L,Wang W Q. 2011. Research progress on the invasion mechanism and control strategy of alien plant Ageratina adenophora[J]. Scientia Sinica (Vitae),41(1):13-21.]
王昌全,郭燕梅,李冰,袁大刚,张济龙,林正雨,唐敦义. 2008. Cd胁迫对杂交水稻及其亲本叶片丙二醛含量的影响[J]. 生态学报,28(11):5377-5384. [Wang C Q,Guo Y M,Li B,Yuan D G,Zhang J L,Lin Z Y,Tang D Y. 2008. Effect of Cd stress on the content of MDA in leaves of the hybrid rice and their parents[J]. Acta Ecologica Sinica,28(11):5377-5384.]
王吉秀,高熹,马沙,吴国星. 2013. Cd、Pb和Zn在土壤—紫茎泽兰—泽兰实蝇系统中的生物富集效应研究[J]. 中国生态农业学报,21(7):877-882. [Wang J X,Gao X,Ma S,Wu G X. 2013. Bioconcentration effects of Cd,Pb and Zn in soil- Eupatorium adenophorum Spreng-Procecidochares utilis Stone system[J]. Chinese Journal of Eco-Agriculture,21(7):877-882.]
王馨雨,杨绿竹,王蓉蓉,刘洁,单杨,张群,丁胜华. 2020. 植物多酚氧化酶的生理功能、分离纯化及酶促褐变控制的研究进展[J]. 食品科学,41(9):222-237. [Wang X Y,Yang L Z,Wang R R,Liu J,Shan Y,Zhang Q,Ding S H. 2020. Recent progress toward understanding the physiological function,purification,and enzymatic browning control of plant polyphenol oxidases[J]. Food Science,41(9):222-237.]
王勇,郭俊杰,陈家骅,季清娥. 2013. 长尾潜蝇茧蜂寄生后橘小实蝇幼虫体内4种酶活性的变化[J]. 热带作物学报,34(2):335-338. [Wang Y,Guo J J,Chen J H,Ji Q E. 2013. The changes of the activity of four enzymes in larvae of Bactrocera dorsalis(Hendel) parasitized by Diachasmimorpha longicaudata[J]. Chinese Journal of Tropacal Crops,34(2):335-338.]
张常隆,李扬苹,冯玉龙,郑玉龙,类延宝. 2009. 表型可塑性和局域适应在紫茎泽兰入侵不同海拔生境中的作用[J].生态学报,29(4):1940-1946. [Zhang C L,Li Y P,Feng Y L,Zheng Y L,Lei Y B. 2009. Roles of phenotypic plasticity and local adaptation in Eupatorium adenophora invasions in different altitude habitats[J]. Acta Ecologica Sinica,29(4):1940-1946.]
张洪英,魏淑花,张蓉,苗润,李克昌,罗晓玲,张宇. 2016. 豌豆蚜为害对苜蓿品种酶活性和营养物质的影响[J]. 草业科学,33(1):144-152. [Zhang H Y,Wei S H,Zhang R,Miao R,Li K C,Luo X L,Zhang Y. 2016. Effects of Acyrthosiphon pisum on enzyme activities and nutrients of different alfalfa varieties[J]. Pratacultural Science,33(1):144-152.]
张金,孙秀娟,石岩,李佳,张永清. 2014. 蚜虫为害对忍冬叶片防御酶活性及初生代谢的影响[J]. 山东农业科学,46(8):57-60. [Zhang J,Sun X J,Shi Y,Li J,Zhang Y Q. 2014. Response of defensive enzyme activity and some primary metabolites in Lonicera japonica Thunb. leaves to aphid damage[J]. Shandong Agricultural Sciences,46(8):57-60.]
張晓玉,张温典,田兰,巩校东,张运峰,谷守芹,范永山. 2014. 不同毒性玉米大斑病菌侵染对感病玉米叶片PAL活性的影响[J]. 玉米科学,22(1):154-158. [Zhang X Y,Zhang W D,Tian L,Gong X D,Zhang Y F,Gu S Q,Fan Y S. 2014. Effects of infection with different virulent isolates of Setosphaeria turcica on PAL activity of susceptible corn leaves[J]. Journal of Maize Sciences,22(1):154-158.]
张秀伟,桑维钧,谢鑫,王莉爽,邱波. 2009. 菟丝子寄生后紫茎泽兰的叶绿素及酶类活性变化研究[J]. 贵州农业科学,37(12):106-108. [Zhang X W,Sang W J,Xie X,Wang L S,Qiu B. 2009. Study on chlorophyll content and activity changes of enzymes in Eupatorium adenopho-rum parasitized by dodder[J]. Guizhou Agricultural Scien-ces,37(12):106-108.]
周方,张致杰,刘木,潘晓云. 2017. 养分影响入侵种喜旱莲子草对专食性天敌的防御[J]. 生物多样性,25(12):1276-1284. [Zhou F,Zhang Z J,Liu M,Pan X Y. 2017. Effe-cts of nutrient levels on defense against specialist insects in an invasive alligator weed[J]. Biodiversity Science,25(12):1276-1284.]
朱麟,楊振德,赵博光,方杰. 2005. 植食性昆虫诱导的植物抗性最新研究进展[J]. 林业科学,44(1):165-173. [Zhu L,Yang Z D,Zhao B G,Fang J. 2005. Recent advances of herbivorous insect induced resistance in plant[J]. Scien-tia Silvae Sinicae,44(1): 165-173.]
朱文达,颜冬冬,何燕红,李林,欧阳灿彬,曹坳程. 2018. 石榴替代控制紫茎泽兰的种植模式研究[J]. 江西农业学报,30(1):65-69. [Zhu W D,Yan D D,He Y H,Li L,Ou-yang C B,Cao A C. 2018. Study on cultivation pattern of pomegranate(Punica granatum) for replacement and control of Eupatorium adenophorum[J]. Acta Agriculturae Jiangxi,30(1):65-69.]
朱长华,于茜茜,范秀琴. 2011. 昆虫与植物的协同进化关系[J]. 河北林果研究,26(2): 84-86. [Zhu C H,Yu X X,Fan X Q. 2011. The relationship of co-evolution between insects and plants[J]. Hebei Journal of Forestry and Orchard Research,26(2): 84-86.]
Gui F R,Wan F H,Guo J Y. 2009. Determination of the population genetic structure of the invasive weed Ageratina adenophora using ISSR-PCR markers[J]. Russian Journal of Plant Physiology,56(3):410-416.
Mitton F M,Ribas F J L,Gonzalez M,Miglioranza K S B,Monserrat J M. 2016. Antioxidant responses in soybean and alfalfa plants grown in DDTs contaminated soils:Useful variables for selecting plants for soil phytoreme-diation[J]. Pesticide Biochemistry and Physiology,130:17-21.
Müller-Sch?rer H,Schaffner U,Steinger T. 2004. Evolution in invasive plants:Implications for biological control[J]. Trends in Ecology and Evolution,19(8): 417-422.
Pan X Y,Jia X,Fu D J,Li B. 2013. Geographical diversification of growth-defense strategies in an invasive plant[J]. Journal of Systematics and Evolution,51(3):308-317.
Sang W G,Zhu L,Axmacher J C. 2010. Invasion pattern of Eupatorium adenophorum Spreng in southern China[J]. Biological Invasions,12(6): 1721-1730.
Strauss S Y,Agrawal A A. 1999. The ecology and evolution of plant tolerance to herbivory[J]. Trends in Ecology & Evolution,14(5):179-185.
Trtikova M. 2009. Effects of competition and mowing on growth and reproduction of the invasive plant Erigeron annuus at two contrasting altitudes[J]. Botanica Helvetica,119(3): 1-6.
Trtikova M,Edwards P J,Gusewell S. 2010. No adaptation to altitude in the invasive plant Erigeron annuus in the Swiss Alps[J]. Ecography,33(3): 556-564.
Trtikova M,Gusewell S,Baltisberger M,Edwards P J. 2011. Distribution,growth performance and genetic variation of Erigeron annuus in the Swiss Alps[J]. Biological Invasions,13(3):413-422.
Wang Y,Siemann E,Wheeler G S,Zhu L,Gu X,Ding J Q. 2012. Genetic variation in anti-herbivore chemical defences in an invasive plant[J]. Journal of Ecology,100(4):894-904.
Zou J W,Rogers W E,Siemann E. 2007. Differences inmorphological and physiological traits between native and invasive populations of Sapium sebiferum[J]. Functional Ecology,21:721-730.
(责任编辑 麻小燕)

