基于逆流鞘液的微流控芯片设计及流场分析
宋飞飞,马玉婷,吴云良,裴智果,王 策
(中国科学院苏州生物医学工程技术研究所,江苏苏州215163)
0 引 言
微流控芯片[1-2]是指在微米和亚微米尺度下研究生物和化学中有关微小尺度流体中微粒相关检测和分选的多功能集成系统,被称之为“芯片实验室”。在微流控芯片中,不仅可以实现样品的聚焦[3-4],还可以实现样品的分析、分选[5-6]等功能。与常规的实验操作相比,采用微流控技术可以减少实验所需试剂,实现微米级尺度微粒的分析和分选,同时因其尺寸微小,多种功能集成在一起,具有便于携带、全操作自动化等优点。
自微流控芯片问世以来,在微生物检测[7-9]、医用分选分析[10]、细菌检测[11-12]等诸多领域越来越受到人们的重视和青睐。微流控系统的特征尺寸与细胞和其他微生物实体的尺寸在一个量级,在这样的系统中不仅能够在体外有效模拟细胞微环境,而且能够实现对单个细胞的分析和分选。具体说,在细胞分析领域,通过微流控芯片已经实现了细胞与细胞共同培养和相互作用、体外细胞微环境的构建和模拟、单细胞操控[13-14]和分析以及芯片器官等,这些都极大地促进了现代生物医学的发展。
然而,在应用于流式细胞分选的微流控芯片出口通道一般至少包括一个分选通道和废液通道,这样在两个出口通道的交叉口会形成相对于流体流动方向的凸起,在凸起区域形成流动中驻点,这种驻点的存在致使细胞或者微粒黏附上面,进而引起细胞或者微粒的聚集,导致微流体的流动状态发生改变,使分析或者分选精度下降,同时也会引起流道拥堵、样品污染、纯度下降等问题。
本文采用在微流控芯片分选出口和废液出口的中间流体驻点区域增加一路鞘液入口,该鞘液入口流动方向与主流道流动方向相反,形成逆流,避免细胞在驻点区域接触到壁面,从而防止细胞聚集阻塞流道,同时该鞘液对分选通道和废液通道中样品流再次聚焦,使样品流动更加稳定。本文还利用计算流体力学分析软件Fluent对芯片中的流场进行仿真分析,从而对这种方法的芯片流体结构进一步优化。
1 水力聚焦原理分析
在特定的流体模型中,雷诺数是一个与黏性力和惯性力之比有关的无量纲参数,

式中:ρ为液体的密度(kg/m3);D为水力直径;v为断面平均流速(m/s);μ 为液体的黏度系数(Pa·s)。雷诺数反映了在流体流动过程中黏滞力与惯性力的对比关系,其大小是判定流体的流动状态的依据。雷诺数与流体流动状态关系如下:Re<1,蠕动流;Re<2 000,层流;2 000<Re<4 000,过渡流(属于不稳定流);Re<4 000,湍流。
通过流体理论、流体断面的平均流速和芯片设计参数计算可知,微流控芯片中微流体的雷诺数很小,符合低雷诺数的流动规律,即在微通道中的相邻多层流体可以相邻流动却不会相互混合,进而对流速产生影响。同时,根据流体连续性原理,对于不可压缩定常流有
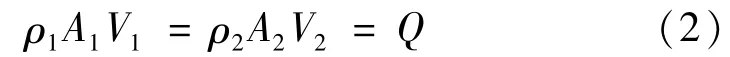
倘若鞘液与样品采用相同的截面积进行上样,保持入口流量不变,随着鞘液与样品共同进入主流道,主流道截面积变为原来的1/3,根据连续性原理,那么样品流速度增加,截面积缩短,产生聚焦作用。
2 建立几何模型并进行边界条件设定
如图1所示为再聚焦微流控芯片二维模型,主要包括进样口,宽度100 μm;两个鞘液入口,宽度100 μm;两个出口,宽度100 μm;一个鞘液逆流入口,宽度100 μm,形成了典型微流聚焦芯片结构。样品流流速v1,鞘液流流速v2,逆流鞘液流速v3。

图1 再聚焦微流控芯片二维模型
3 仿真结果分析
3.1 逆流鞘液的流动状态分析
图2是主流道中样品流在两侧鞘液的作用下进行初次聚焦,以及在有无逆流鞘液下进行再次聚焦的样品流体积分数分布。实验过程中,一般是先通入鞘液以排出芯片内部的气泡,然后再通入样品。为了与实验更加贴近,在仿真中假定微流控芯片初始状态充满鞘液,同时假定样品流进样速度为0.02 m/s,进样鞘液流进样速度为0.03 m/s,以及逆流鞘液的进样速度为0.1 m/s。
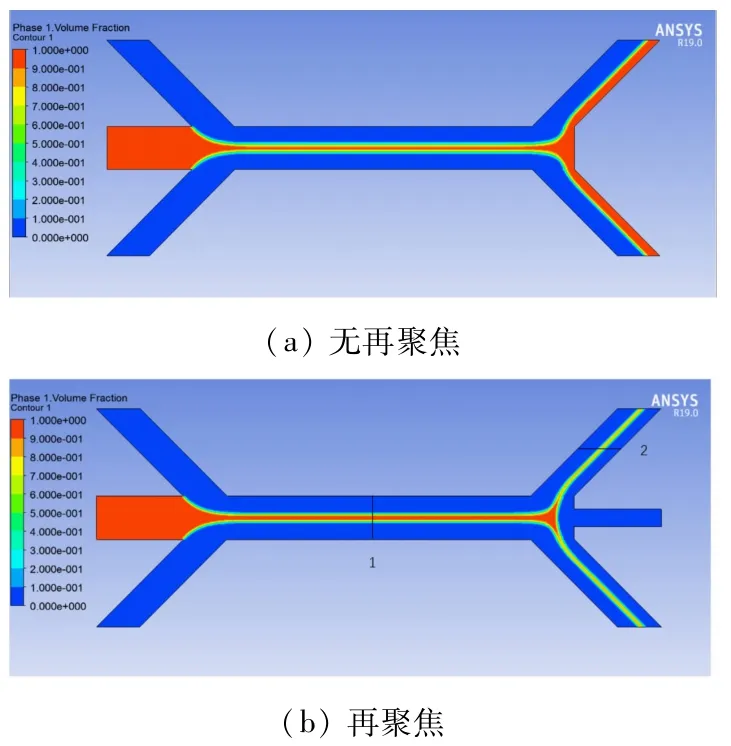
图2 不同聚集状态下样品体积分数云图
由图2可知,在有无逆流鞘液情况下,样品流的初次聚焦流动状态基本相似,即样品流在两侧鞘液作用下,慢慢汇聚并得到聚焦。这可以从两方面得到解释,首先在微通道的层流内,流体由于受到壁面的影响,不同位置流体流动速度不同,呈现中间高,两侧低的抛物线形状,因此样品流的平均流速要快于两侧鞘液,相对于鞘液来说,样品流会聚焦地更细;另一方面根据流体连续性原理,样品流和鞘液流进入同一通道,也就是说相对于样品入口来说,流道截面积变小了,而且鞘液和样品流可以认为是不可压缩流,因此必然会使流体的速度变快,根据连续性原理,聚焦后的流体截面积必然变细。
相对于无逆流鞘液来说,在微流控芯片两侧出口交界面处充满了样品流,形成明显的驻点区域,样品流在驻点区域直接与壁面接触,而在实验中细胞、微球一旦接触壁面很容易黏附在上面,进而聚集导致流道阻塞。而在有逆流鞘液再聚焦时,在驻点区域的细胞等必然在逆流鞘液的带动下远离流道壁面,流向两侧出口,防止了细胞的黏附阻塞,减小了驻点区域壁面对细胞或者微粒的影响;同时由图2(b)可知,样品流在逆流鞘液作用下会再次聚焦,并流向两侧出口,增加了样品流动的稳定性。
3.2 样品流初次聚焦流动状态分析
图3是在样品流流速不变下,进样鞘液不同流速下的样品流初次聚焦状态。由图2可知,在进样鞘液不同流速下,样品流在两侧鞘液作用下都会开始初次聚焦,样品流的宽度随着聚焦的进行也开始逐渐变小;但不同鞘液流速下,样品流的聚焦宽度不同,由图3及图2(b),即在样品流速都是0.02 m/s,进样鞘液流速从0.01变化到0.04 m/s,鞘液流与样品流流量比从1~4,样品流初次聚焦的宽度也逐渐变小,即随着鞘液流与样品流流量比的逐渐增大,样品流的聚焦宽度逐渐减小。这是因为随着两侧鞘液的增多,流体流动速度加快。根据流体连续性原理可知,流体的截面积必然缩小,所以样品流看起来更细,得到进一步聚焦。

图3 不同入口速度下样品流初次聚焦流动状态分析
图4是相同样品流速和逆流鞘液流速下,即v1=0.02 m/s和v3=0.1 m/s,不同鞘液速度即v2下样品流初次聚焦流动状态,图中曲线分别是图2(b)上1处的流体速度分布和体积分数分布。由图4(a)可知,不同鞘液流速下,主流道流速都是抛物线分布,同时随着鞘液流速的增加,抛物线分布上的流速逐渐增加。由图4(b)可知,随着鞘液流与样品流流量比的增加,样品流聚焦宽度逐渐减小,这与前面的分析基本一致。
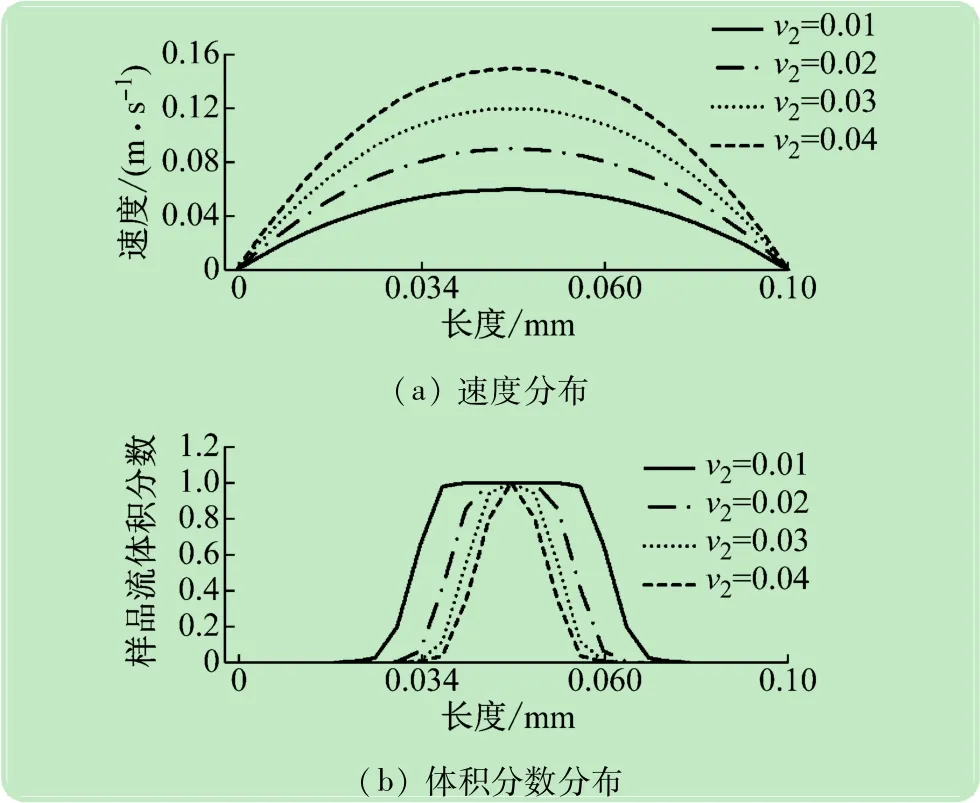
图4 不同鞘液速度下样品流初次聚焦流动状态分析
3.3 样品流再次聚焦流动状态分析
由图5可知,随着逆流鞘液流速的降低,与初次聚焦相似,再聚焦的样品流宽度逐渐增大,同时聚焦后的样品流中心位置逐渐右偏。具体地说,在逆流鞘液作用下,样品流在两侧出口的交界区域处远离壁面;由图可知,随着逆流鞘液流速的增加,样品流距离壁面越远,细胞黏附的概率越小。同时,从两侧出口样品流可以看出,逆流鞘液流速越大,样品流再聚焦宽度越小,流动更稳定,便于分选后对分选样品的检测验证。

图5 不同流速下再聚焦样品流体积分数云图
图6是相同样品流速度和鞘液速度下,即v1=0.02 m/s和v2=0.01 m/s,不同逆流鞘液速度v3下样品流再次聚焦的流动状态,图中曲线分别是图2(b)上2处的速度分布和体积分数分布。由图6(a)可知,不同逆流鞘液流速下,主流道流速都是抛物线分布,同时随着逆流鞘液流速的增加,抛物线分布上的流速逐渐增加。由图6(b)可知逆流鞘液流速越大,样品流再聚焦宽度越小,较大逆流鞘液流速可以使样品与另一侧壁面距离也越大,越不容易发生阻塞。
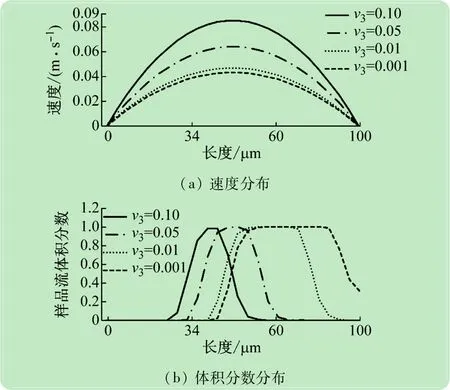
图6 不同流速比样品流再聚焦流动状态分析
4 结 语
本文提出一种新型微流控芯片,通过逆流鞘液进行再聚焦的方式,能够防止细胞聚集阻塞流道,同时对分选后样品流再次聚焦,使样品流动更加稳定。针对这种新型芯片。利用CFD软件Fluent对这种微流控芯片中的流场进行仿真分析,验证了引入逆流鞘液的可行性,同时也为下一步的实验开展提供了参考依据。

