PRMT4 在胃癌发生和发展中的作用和机制研究
窦 敏 ,郑英霞,韩 丽,赵 倩
1. 上海交通大学基础医学院病理生理学教研室,上海 200025;2. 上海交通大学医学院附属新华医院检验科,上海 200092
胃癌是消化道常见的肿瘤之一,是全世界发病率排名第四位的恶性肿瘤,其死亡率在所有癌症中排名第三位[1]。亚洲地区胃癌的发病率和死亡率较高,尤其是日本、韩国、蒙古和中国,在中国胃癌已经成为引起死亡的第二大肿瘤[2]。2015 年的统计数据[3]显示,在中国胃癌的致死率较高,有约50 万的死亡病例。胃癌发病的分子生物学因素复杂,与许多肿瘤基因、抑癌基因有关。因而揭示胃癌发生与发展的机制对诊断与治疗胃癌具有重大意义[4]。
蛋白质精氨酸甲基转移酶(protein arginine methyltransferases,PRMTs)家族是一类能够甲基化组蛋白或非组蛋白精氨酸基团的酶类。精氨酸甲基化是重要的翻译后修饰,参与各种细胞过程的调节[5]。其中PRMT4 也称为共激活蛋白相关精氨酸甲基转移酶1(coactivator-associated arginine methyltransferase 1,CARM1),能够使蛋白底物的精氨酸残基非对称性地二甲基化[6]。PRMT4 是PRMTs 家族中第一个功能上与基因转录活性有关的成员[7],参与调节许多细胞过程。PRMT4 已被证实在多种肿瘤中表达增强,如乳腺癌[8]、前列腺癌[9]、结直肠癌[10]等,其过表达不仅刺激大量致癌通路关键因子,如FOS(Fos protooncogene)、E2F1(E2F transcription factor 1)、Wnt/β-连环蛋白(β-catenin)、核受体共激活因子3(nuclear receptor coactivator 3,NCOA3,又称AIB1)等,而且为肿瘤的生长和侵袭与转移提供一个有利的微环境[11-12]。目前,有研究[13]表明,随着胃癌的进展、胃癌干细胞干性增强,PRMT4 表达量明显上调,提示PRMT4 可能促进胃癌干细胞的干性,但其确切机制不甚明了。除此之外,PRMT4在胃癌中的作用还没有得到深入的研究。
本文在胃癌临床组织标本检测的基础上,体外利用胃癌细胞株探索PRMT4 在胃癌中的表达、在胃癌生长和发展中的作用及潜在的机制,以期为胃癌的诊断和治疗提供证据。
1 材料与方法
1.1 主要仪器
ABI 7900 实时定量PCR 仪(ABI,美国)、无菌超净工作台(Labconco,美国)、倒置荧光显微镜(Olympus,JPN)、细胞培养箱(Revco,美国)、低温水平离心机(HITACHI,日本)、小型EP 管离心机(Eppendorf,德国)、生物安全柜(上海力申科学仪器,中国)、纯水仪(Merk Millipore,美国)、FACS Canto Ⅱ流式细胞仪(BD,美国)、垂直电泳仪及膜转移装置(Bio-Rad,美国)、Odyssey 双色红外荧光成像系统(LI-COR,美国)、GloMax 20/20 发光检测仪(Promega,美国)。
1.2 主要材料和试剂
人胃癌细胞株MGC-803、MKN-45、SGC-7901 均购于中国科学院上海生命科学研究院;细胞培养所用高糖DMEM 培养基、胎牛血清(fetal bovine serum,FBS)、双抗、胰酶(Gibco,美国),蛋白裂解液、一抗稀释液(碧云天,中国),RNA 提取试剂盒(Qiagen,德国),mRNA反转录试剂盒及SYBR Premix ExTaq 定量PCR 试剂盒(TaKaRa,中国),细胞转染试剂盒lipo3000(Thermo Fisher,美国),Annexin V/7-AAD 凋亡试剂盒、迁移试剂盒、侵袭试剂盒(BD,美国)。短发夹RNA(short hairpin RNA,shRNA)由上海吉凯生物设计合成,PCR引物由上海工程有限公司设计合成。
蛋白质印迹法(Western blotting)所用抗体包括:PMRT4 蛋 白、β-catenin,活 化 的β-catenin[non-phospho (active) β-catenin,ABC]、糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK3β);磷酸化糖原合成酶激酶3β(phospho glycogen synthase kinase-3β,p-GSK3β)、C-myc(cellular-myelocytomatosis viral oncogene) 蛋 白、N- 钙 黏 蛋白(N-cadherin)和β-肌动蛋白(β-actin)。抗体货号及来源如下:PRMT4(NBP2-37645,Genetex,美国),β-catenin、ABC、N-cadherin、C-myc(8480、19807、13116、18583,Cell Signaling, 美 国),GSK3β、p-GSK3β(sc-71186、sc-81496,Santa Cruz,美国),β-actin(A1978,Sigma,美国)。
1.3 实验方法
1.3.1 免疫组织化学检测 使用谷歌生物商品化的胃癌组织芯片(含32 对胃癌和癌旁组织)进行免疫组织化学实验。组织芯片置于56 ℃恒温箱烘烤2 h 后分别浸入二甲苯及无水乙醇浸泡进行脱蜡与水化;将其放入缓冲液,置于微波炉中加热,使容器内液体温度维持在92 ~98 ℃,持续10 ~15 min。取出容器,冷却10 ~20 min;封闭液封闭15 min,加入一抗,4 ℃孵育过夜;1×PBS 洗涤3 次,加入二抗,室温孵育2 h,1×PBS 洗涤3 次后加入亲和素 - 生物素 - 过氧化物酶复合物,室温孵育30 min。1×PBS 洗涤3 次,进行二氨基联苯胺(diaminobenzidine,DAB)染色,苏木精复染,脱水并封片。染色结果评分根据阳性细胞的百分率被定为:<5%,0 分;5%~25%,1分;26%~50%,2 分;51%~75%,3 分;>75%,4 分。对每对胃癌组织和癌旁组织的评分结果进行统计分析。
1.3.2 数据库分析 在UALCAN 网站上分析PRMT4在34 例正常组织和415 例胃癌组织中的表达差异。UALCAN 网站样本均来自TCGA(The Cancer Genome Atlas)数据库。在Oncomine 数据库分析了2 个样本库的胃癌组织,分别为80 例正常组织与80 例胃癌组织、19 例正常组织与31 例弥漫性胃腺癌组织。生存期分析在Kaplan-Meier Plotter 网站上进行,样本库包含1 051 例胃癌组织;总生存期分析中含有275 例低表达PRMT4 的胃癌患者和601 例高表达PRMT4 的胃癌患者信息,无病进展生存期中含有241 例低表达PRMT4 的胃癌患者和400 例高表达PRMT4 的胃癌患者信息;样本编 号 为GSE14210、GSE15459、GSE22377、GSE29272、GSE51105 和GSE62254。
1.3.3 细胞培养 细胞培养均使用DMEM 培养基在含有5% CO2的37 ℃恒温孵育箱中培养。培养基中添加10% FBS 以及100 U/mL 青霉素和100 μg/mL 链霉素。
1.3.4 质粒转染 沉默和过表达PRMT4(NM-199141)均采用质粒瞬时转染的方法。沉默PRMT4 所用质粒名称GV493,2个敲减序列分别为 ATGACTTGAGCAGTGTTAT(SH1) 和 AGAACATGATGCAGGACTA(SH2), 对 照序列为TTCTCCGAACGTGTCACGT(NC)。过表达所用质粒名称GV146,克隆位点Xho Ⅰ/EcoR Ⅰ,长度为1 874 bp。转染前1 日,将待转染的胃癌细胞接种6 孔板。第2 日,按lipo3000 试剂盒明书配制转染预混合液,室温静置20 min。去除培养基,1×PBS 洗涤2 次,加入不含抗生素、含10% FBS 的DMEM 培养液,然后加入转染预混合液,充分混匀。在含有5% CO2的37 ℃恒温孵育箱中培养过夜后,换成含抗生素和10% FBS 的DMEM 完全培养液,转染48 h 后收集细胞进行后续试验。
1.3.5 MTT 增殖实验 在MGC-803 和MKN-45 细胞中敲减PRMT4,分为SH1 组、SH2 组和NC 组;在SGC-7901 细胞中过表达PRMT4,分为过表达质粒(OVER)和空载(VECTOR)2 组;之后进行MTT 增殖实验。将处于对数期且状态良好的细胞,按每孔1 000 个接种于96孔板中,周边孔加等体积PBS,置于细胞培养箱中;24 h后,向96 孔板每孔中加入20 µL MTT 溶液,4 h 后去除培养液,每孔中加入200 µL 二甲基亚砜(DMSO),振荡5 min,使细胞内结晶充分溶解;使用酶标仪在波长490 nm 下测定吸光度。连续检测5 d,根据吸光度值绘制细胞生长曲线。
1.3.6 平板克隆形成实验 细胞分组同1.3.5。取生长状态良好的对数期的细胞,以每孔250 个接种于6 孔板中。细胞培养箱中持续培养4 ~6 周,直到形成肉眼可见的克隆后,弃培养基,用1×PBS 洗涤3 次,使用4%的多聚甲醛固定液固定细胞15 min;去除固定液,用1×PBS 洗涤3次,用0.05%结晶紫溶液染色15 min,使用1×PBS 洗涤后风干。拍照并记录所形成的细胞克隆数目。
1.3.7 细胞凋亡分析 细胞分组同1.3.5。首先用胰酶消化细胞,进行细胞计数,用1×binding buffer 稀释细胞,最终稀释成1×106个/mL 单细胞悬液。吸取100 μL 细胞悬液至流式管中,分别加入5 μL PE-Annexin V 和5 μL 7-ADD。轻轻混匀后室温避光反应15 min。最后每管中加入400 μL 1×binding buffer,并在1 h 内上机检测。分别计算早期凋亡和中晚期凋亡细胞比例。
1.3.8 细胞迁移和侵袭实验 细胞分组同1.3.5。迁移实验采用8 μm PET(聚酯)膜Corning Transwell inserts(插入式细胞培养皿),侵袭实验采用基质胶(matrigel)预包被的8 μm Corning Transwell inserts。实验前预先将Transwell inserts 从冰箱拿出至室温平衡30 min。含matrigel 的小室要预先放置在24 孔板中,上层加无血清DMEM 培养基,37℃细胞培养箱预平衡2 h。消化并洗涤细胞计数,用含1% FBS 的DMEM 培养液重悬细胞使得最终的细胞密度达到5×104个/mL。24 孔板的孔中加入750 μL 含有10% FBS 的DMEM 培养液,insert 小室中加入500 μL 细胞悬液。将24 孔板培养48 h 后,取出小室,洗涤固定以及染色,最后擦去小室内部未迁移到下面的细胞,晾干,用显微镜在200 倍下观察,随机选取5 个不同的视野拍照。
1.3.9 荧光素酶报告实验 在MGC-803 细胞中敲减PRMT4,分为SH2 组和NC 组,之后进行荧光素酶报告实验。TOP[含有野生型的T 细胞因子(T cell factor)结合序列] /FOP(含有突变的TCF 结合序列)质粒转染24 h后,将培养板取出,1×PBS 洗3 次;加入100 μL 裂解液,室温振荡孵育15 min,收集裂解液至EP 管中,4 ℃、13 000×g 离心10 min;吸取10 μL 蛋白裂解液加至50 μL萤火虫荧光素酶检测试剂中,迅速混匀,放入GloMax 20/20 发光检测仪中检测荧光强度;加入50 μL 终止液,再次检测荧光强度。根据荧光强度计算TOP/FOP 质粒荧光素酶活性比值。
1.3.10 RNA 提取和real-time PCR 检测 细胞分组同1.3.9。使用RNA 提取试剂盒抽取细胞株中RNA,反转录为cDNA。Real-time PCR 反应体系10 µL:SYBR Premix EX Taq 5 µL,PCR 上 游 引 物(10 µmol/L)0.2 µL,PCR 下游引物(10 µmol/L) 0.2 µL,Rox 参比染料0.2 µL,模板cDNA 1 µL,dd H2O 3.4 µL。反应条件:预变性95 ℃ 10 s;PCR 反 应95 ℃ 5 s,60 ℃ 20 s,72 ℃ 15 s,循 环40 次。使用ABI 7900 实时定量PCR 仪进行扩增。每组设置3 个复孔,实验重复3 次。管家基因Actin 作为内对照。使用公式2-ΔΔCT进行不同组间基因表达差异的比较。检测基因包括:PRMT4、C-myc、细胞周期蛋白D1(cyclin D1)、survivin、基质金属蛋白酶7(matrix metallopeptidase 7,MMP-7)、淋巴样增强因子-1(lymphoid enhancer binding factor 1,LEF1)、Wnt 信号通路抑制因子(Dickkopf Wnt signaling pathway inhibitor 1,DKK1)以及AXIN2。引物序列见表1。
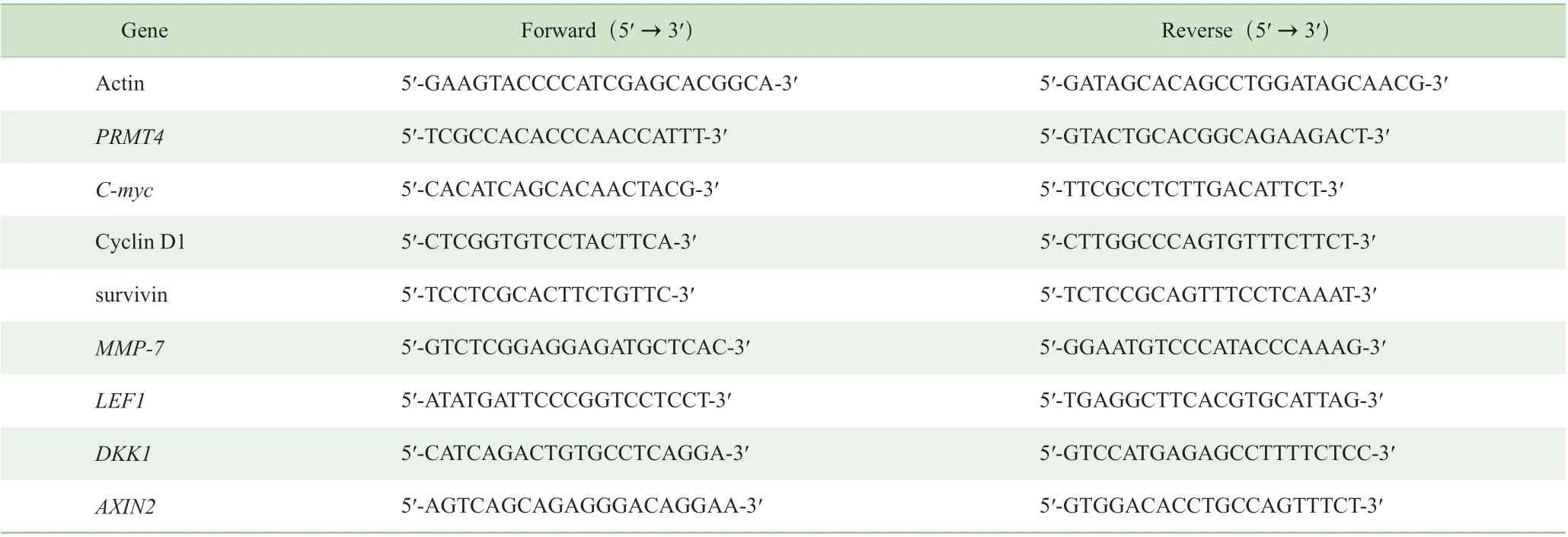
表1 Real-time PCR 检测基因引物序列 Tab 1 Forward and reverse primers of real-time PCR
1.3.11 Western blotting 在MGC-803 和MKN-45 细 胞中敲减PRMT4,分为SH2 组和NC 组;在SGC-7901 细胞中过表达PRMT4,分为OVER 组和VECTOR 组。将经过定量的蛋白与蛋白上样缓冲液按比例加好后置于沸水浴中煮5 min,12 000×g 离心5 min,将管壁上蒸发的水离心至管底,振荡混匀后上样。以恒压90 V 进行电泳直到溴酚蓝指示剂到达分离胶底部时停止。将聚偏氟乙烯(PVDF)膜用甲醇活化1 min 后,连同滤纸、电转夹板浸泡在电转液中;将电转夹板取出,从下到上按照白板、海绵垫、2 层滤纸、PVDF 膜、分离胶、2 层滤纸、海绵垫和黑板的顺序将电转夹板固定好,放入电转槽中;恒压100 V 2 h 后,将PVDF 膜用5%牛血清白蛋白(bovine serum albumin,BSA)封闭,室温置于摇床上1 h 后用一抗孵育,4 ℃过夜;回收一抗,用TBST 洗膜后用二抗室温孵育1 h;弃掉二抗并用TBST 洗膜后用Odyssey 双色红外荧光成像系统曝光。
1.4 统计学方法
2 结果
2.1 PRMT4 在胃癌中高表达且与患者生存期相关
为了研究PRMT4 在胃癌中的表达,在蛋白水平上,采用免疫组织化学技术分析了PRMT4 在32 对癌组织和癌旁组织中的表达水平,发现PRMT4 在胃癌组织中高表达(图1A)。在基因水平上,用TCGA 数据库来分析PRMT4 在胃癌中的表达,发现PRMT4 在胃癌中的表达水平较正常组织显著增高(图1B)。另外,还用Oncomine数据库分析了2 个样本库的胃癌组织(图1C),同样发现PRMT4 的表达水平在胃癌中显著增高,与正常组比较差异有统计学意义(均P=0.000)。
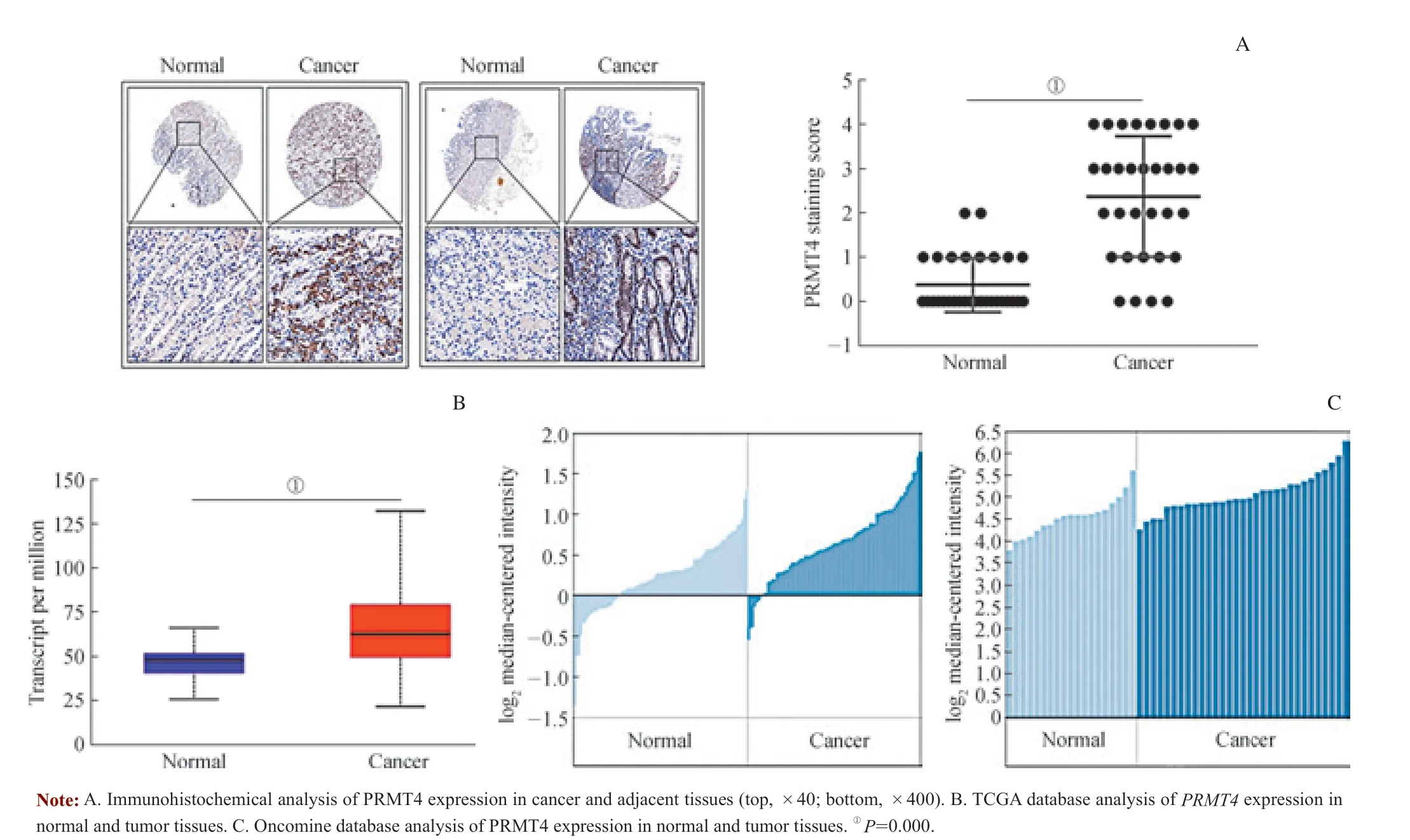
图1 PRMT4 在胃癌中的表达Fig 1 PRMT4 expression in gastric cancer
为了探究PRMT4 对胃癌患者生存期的影响,我们通过在Kaplan-Meier Plotter 网站上分析胃癌患者的生存期发现,高表达PRMT4 的胃癌患者的总体生存期(图2A)和无病进展生存期(图2B)较低表达PRMT4 的胃癌患者明显缩短,且差异有统计学意义(均P=0.000)。综上可见,PRMT4 在胃癌中高表达且高表达PRMT4 的胃癌患者生存期显著缩短。
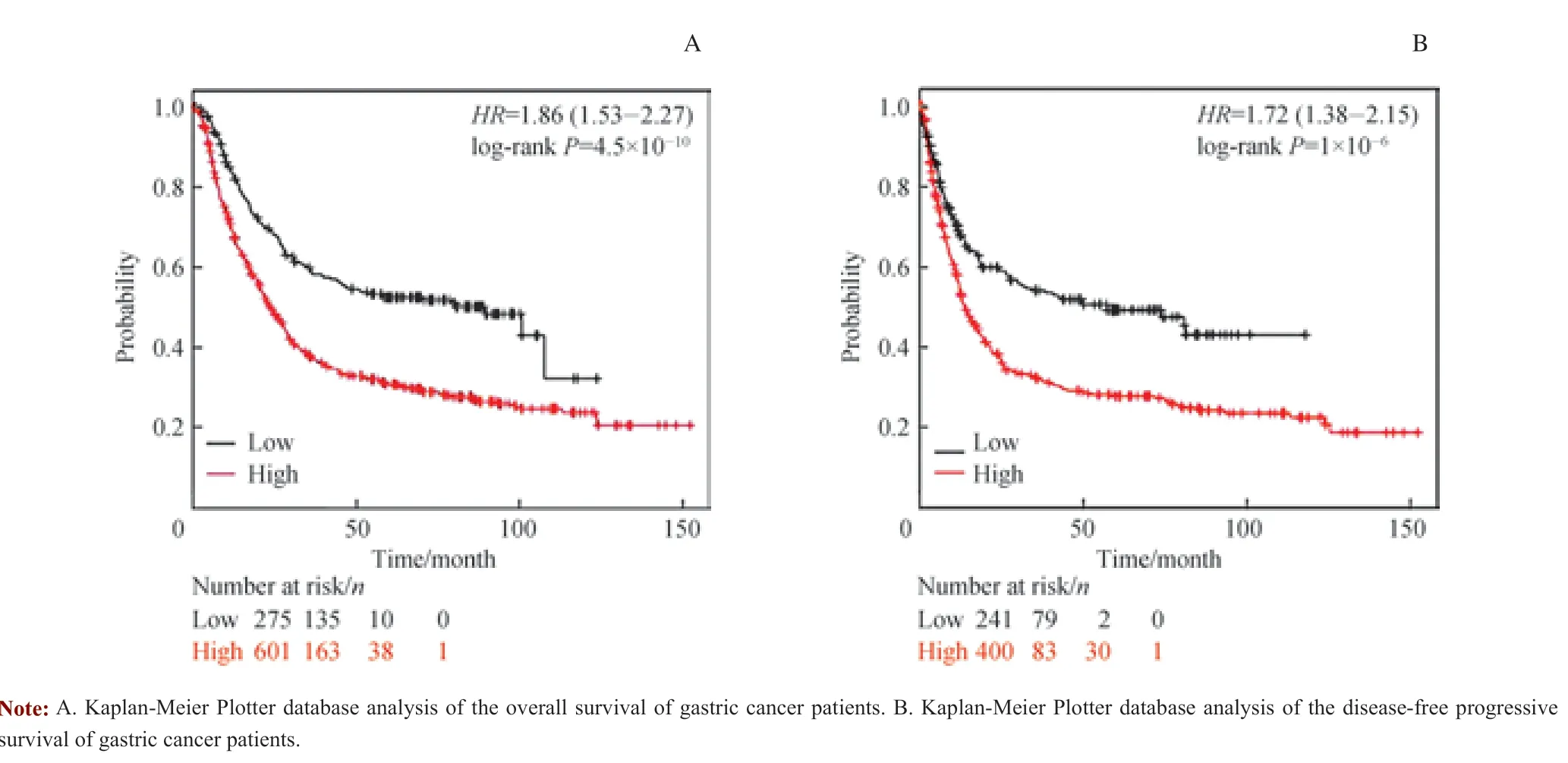
图2 胃癌患者PRMT4 表达与其生存期的关系Fig 2 Relationship between expression of PRMT4 and survival time in patients with gastric cancer
2.2 沉默PRMT4 抑制胃癌细胞的增殖
为进一步研究PRMT4 在胃癌中的生物学功能,分别在PRMT4 表达相对较高的2 个胃癌细胞株MGC-803 和MKN-45 中进行沉默实验。分别转染2 个位点的shRNAs(SH1 和SH2),shRNAs 转 染 后PRMT4 的 蛋 白 水 平 较NC 明显下降(图3A),证明利用干扰技术有效地抑制了PRMT4 的表达。在用shRNAs 敲低PRMT4 的表达后,通过MTT 实验连续5 d 检测转染后胃癌细胞的增殖情况,结果发现SH1 和SH2 转染后的细胞较NC 转染后的细胞的增殖能力显著降低(图3B)。同样用克隆形成实验也验证了这一结果,SH1 和SH2 转染后的细胞较NC 转染后的细胞形成的克隆数明显减少(图3C)。继而利用流式细胞术检测细胞的周期与凋亡情况,结果发现,沉默PRMT4对胃癌细胞的周期没有明显改变,而SH1 和SH2 转染后的细胞凋亡要明显多于NC 转染后的细胞(图3D),差异均具有统计学意义。综上可见,沉默PRMT4 抑制胃癌细胞的生长和克隆形成能力,促进胃癌细胞的凋亡。
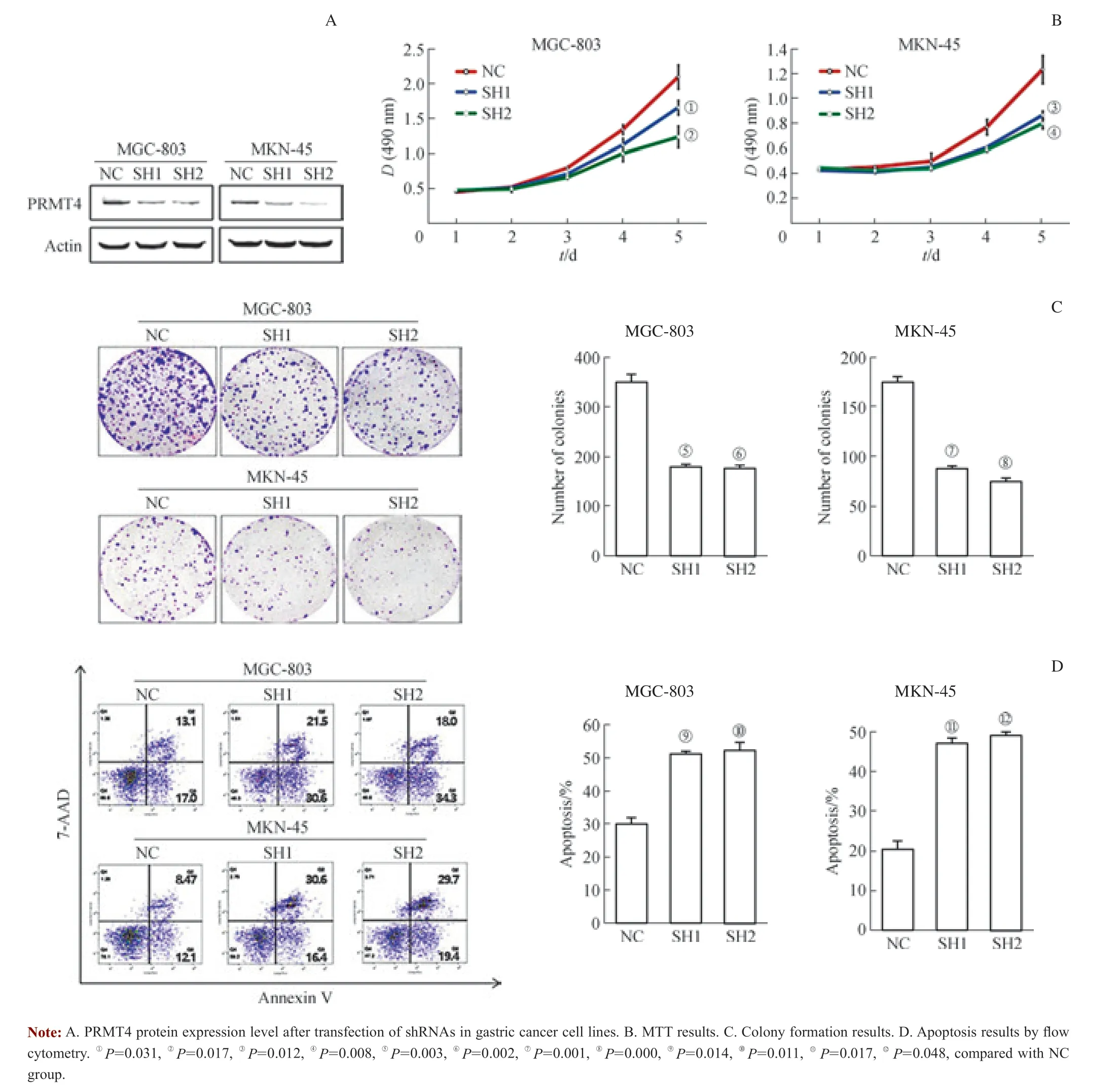
图3 沉默PRMT4 抑制胃癌细胞的体外增殖,促进胃癌细胞的凋亡Fig 3 Deletion of PRMT4 suppressed gastric cancer cell proliferation in vitro, and induced gastric cancer cell apoptosis
2.3 沉默PRMT4 抑制胃癌细胞的侵袭与转移
分别转染NC、SH1 和SH2 后,利用inserts 小室及包裹有matrigel 基质胶的inserts 小室评估胃癌细胞的转移和浸润的能力。结果表明:转染SH1 和SH2 后的胃癌细胞迁移至inserts 小室及带基质胶inserts 小室下面的数量较NC 明显减少(图4),且差异有统计学意义。说明沉默PRMT4 后,胃癌细胞转移及向周围组织浸润的能力均明显下降。
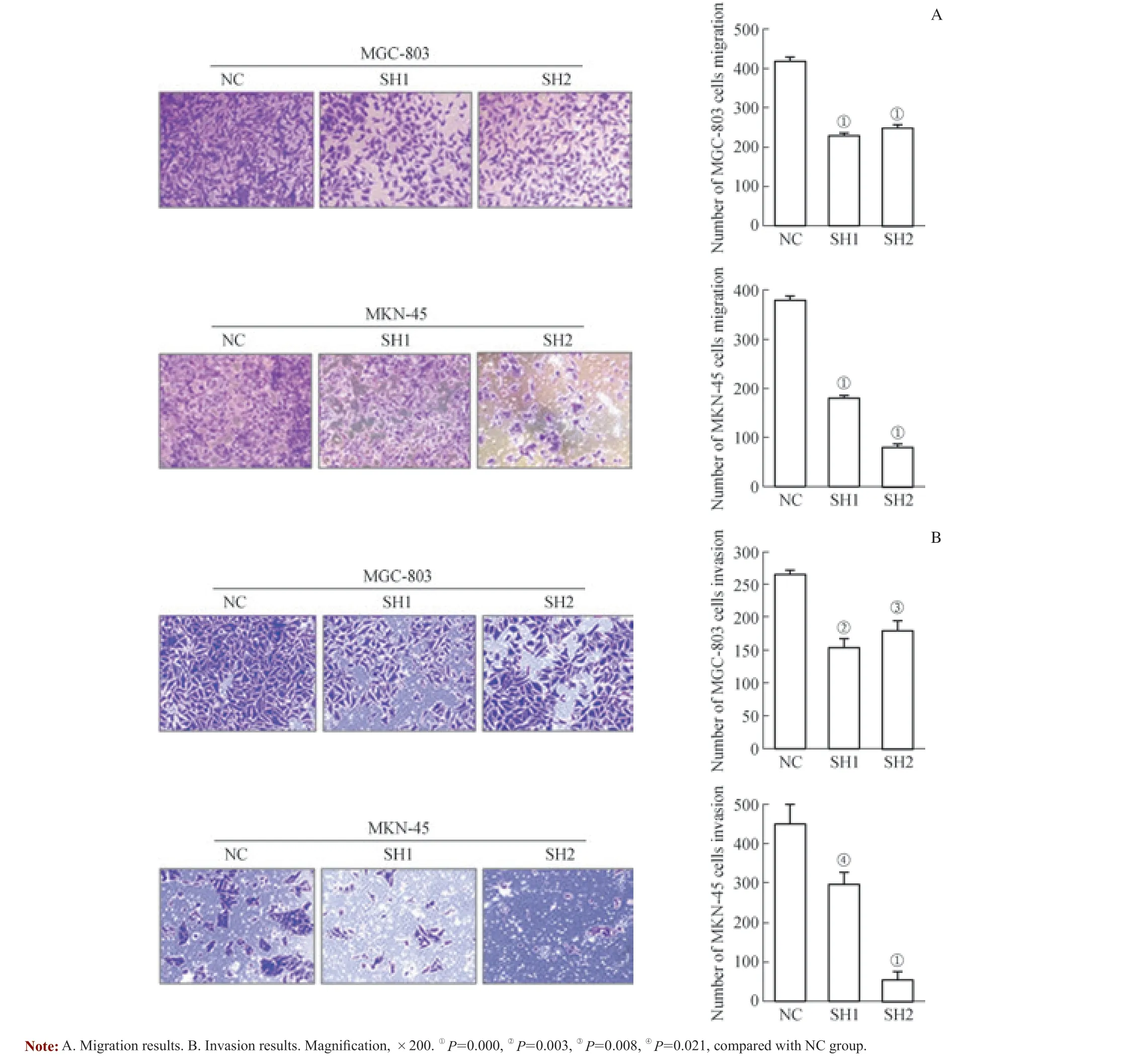
图4 沉默PRMT4 抑制胃癌细胞的体外侵袭与迁移Fig 4 Deletion of PRMT4 suppressed gastric cancer cell migration and invasion in vitro
2.4 过表达PRMT4 促进胃癌细胞的增殖、侵袭与迁移
在PRMT4 表达相对较低的胃癌细胞株SGC-7901 中进行过表达实验,过表达质粒转染有效(图5A)。MTT实验连续5 d 检测转染后胃癌细胞的增殖情况,发现过表达质粒转染后的细胞增殖能力较VECTOR 转染后的细胞显著增高(图5B)。克隆形成实验也验证了这一结果,过表达质粒转染后的细胞较VECTOR 转染后的细胞形成的克隆数明显增加(图5C)。过表达质粒转染后的细胞凋亡也明显少于VECTOR 转染后的细胞(图5D)。另外,转染过表达质粒后的胃癌细胞迁移至inserts 小室及带基质胶inserts 小室下面的数量较VECTOR 明显增加(图5E、F),差异均具有统计学意义。综上可见,过表达PRMT4促进胃癌细胞的生长和克隆形成能力,抑制胃癌细胞的凋亡,并促进胃癌细胞的侵袭与迁移能力。
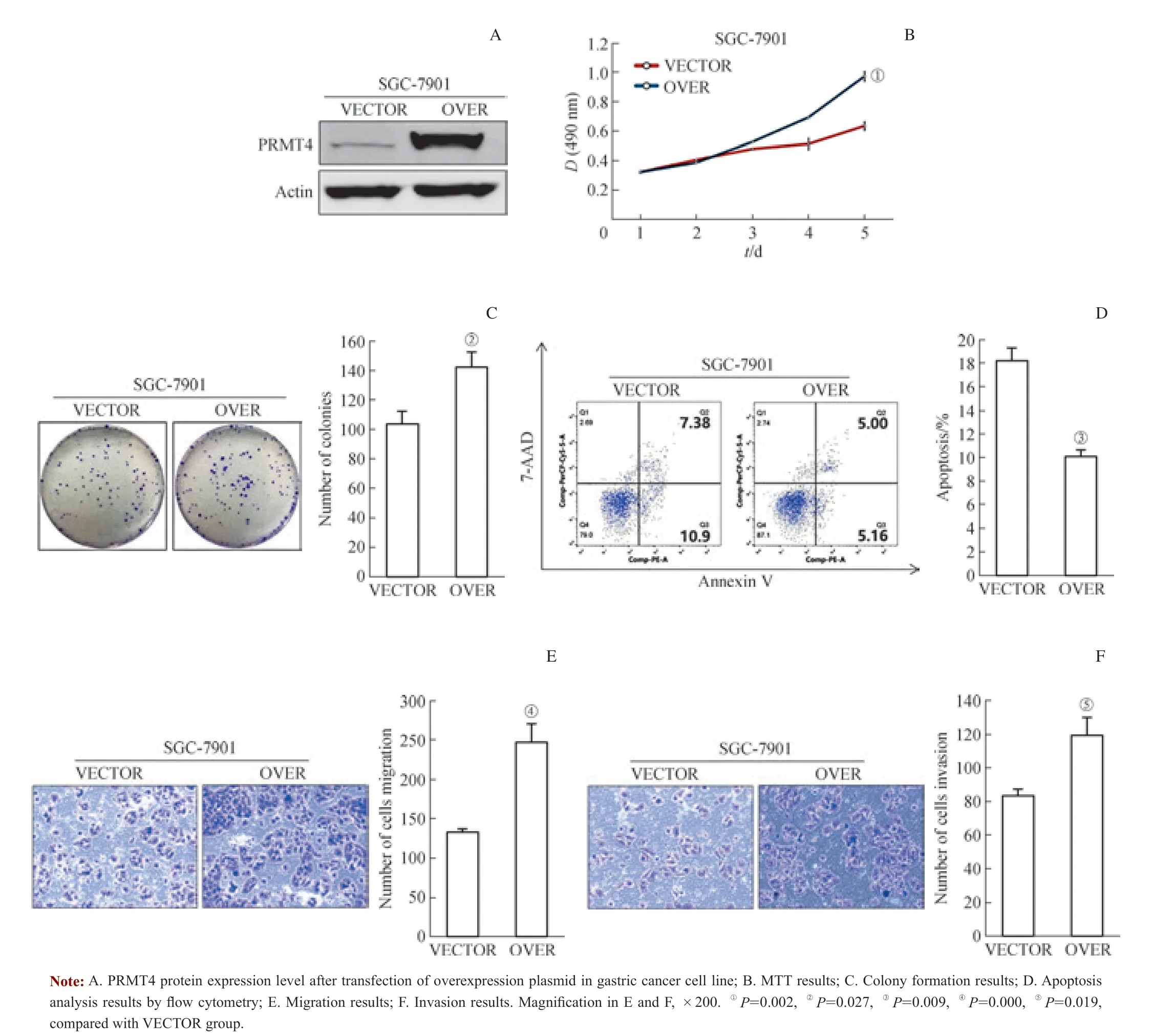
图5 过表达PRMT4 促进胃癌细胞的体外增殖、侵袭与迁移Fig 5 Overexpression of PRMT4 induced gastric cancer cell proliferation, migration and invasion in vitro
2.5 PRMT4 可能参与调控胃癌细胞的Wnt/β-catenin 信号通路
在胃癌中,Wnt/β-catenin 信号通路存在异常活化[14],从而导致胃癌的发生和发展。为了研究PRMT4 在Wnt/β-catenin 信号通路中发挥的潜在作用,首先检测了干扰PRMT4 后胃癌细胞中内源性转录因子TCF 的转录活性。干扰实验均使用MGC-803 细胞和干扰效果较好的SH2 质粒。结果发现,干扰PRMT4 可以显著抑制MGC-803 细胞中内源性TCF 的转录活性(图6A)。PCR 实验检测了干扰PRMT4 后,Wnt/β-catenin 信号通路下游靶基因的表达水平变化;结果显示:沉默PRMT4 可降低MGC-803 细胞Wnt 下游靶基因C-myc、cyclin D1、survivin、MMP-7、 LEF1 和AXIN2 的表达,升高DKK1 的表达(图6B)。Western blotting 实验检测了Wnt/β-catenin 信号通路中关键蛋白β-catenin、ABC、GSK3β、p-GSK3β 以及下游靶基因蛋白C-myc 和N-cadherin 的表达;结果显示:PRMT4可能通过影响ABC、p-GSK3β 和Wnt 下游靶基因蛋白C-myc 和N-cadherin 发挥其对Wnt/β-catenin 信号通路的调节作用(图6C)。
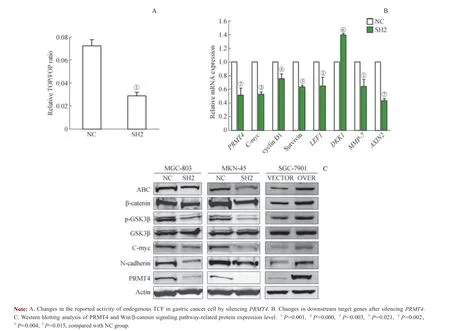
图6 PRMT4 参与调控胃癌Wnt/β-catenin 信号通路的活性Fig 6 PRMT4 regulated Wnt/β-catenin signaling pathway in gastric cancer
3 讨论
胃癌在我国具有较高的发病率和死亡率,其发生是多基因表达异常和多途径导致的。目前胃癌的发病机制尚未完全明晰,因而我们选择胃癌作为研究对象,从中挖掘与其发生发展相关的分子,以期为胃癌的诊断与治疗提供潜在的靶标。PRMT4 作为PRMTs 家族的一员,可以对多种蛋白质进行翻译后修饰,引起表观遗传学的改变,它也可以通过与多种特异的转录因子和染色质修饰酶相互作用调控多种重要的细胞信号通路。研究[15]已经证实PRMT4 在多种肿瘤组织(结直肠癌、骨肉瘤、乳腺癌等)中表达升高并且促进肿瘤细胞的生长增殖、侵袭与转移。本文拟探索PRMT4 在胃癌中的作用。
通过数据库分析发现,胃癌组织的PRMT4 表达水平显著高于正常组织,并且高表达PRMT4 的患者的总体生存期显著缩短;组织芯片检测也获得了PRMT4 在胃癌组织高表达的结果。因此,进一步研究PRMT4 在胃癌中的功能。研究发现:干扰PRMT4 抑制了胃癌细胞的体外增殖、侵袭与转移,促进了胃癌细胞的凋亡;相反,过表达PRMT4 则促进了胃癌细胞的体外增殖、侵袭与转移,抑制了胃癌细胞的凋亡。可见,PRMT4 在胃癌中扮演着癌基因的角色。
Wnt/β-catenin 信号通路是调节肿瘤细胞生长机制中较经典的信号通路,其异常活化存在于各种良性及恶性肿瘤[16],并且与患者预后有着密切的关系[17]。Wnt/β-catenin信号通路还参与表皮间质化转型(epithelial-mesenchymal transitions,EMT),且抑制Wnt 信号通路后可观察到肿瘤细胞的凋亡增加,细胞增殖、侵袭和转移受到抑制[18]。胃癌的发生和发展离不开Wnt/β-catenin 信号通路的调控。PRMT4 作为β-catenin 蛋白转录的一个重要调节器[19],已经在结直肠癌[19]、骨肉瘤[20]等中被证实其通过调控Wnt/β-catenin 信号通路影响肿瘤细胞的生长。因此我们也想了解在胃癌细胞中PRMT4 是否参与调控Wnt/β-catenin 信号通路。实验结果证实,干扰PRMT4 后显著抑制了胃癌细胞中内源性TCF 的转录活性,并且明显降低了Wnt下游靶基因的表达。C-myc[21]、cyclin D1[22]、survivin[23]和 MMP-7[22]都是比较经典的Wnt/β-catenin 信号通路靶基因,它们参与肿瘤细胞的增殖分化、凋亡[24]及侵袭与转移;而转录因子Lef1[25]和β-catenin 降解复合物成员Axin2[26]都是Wnt/β-catenin 信号通路中重要的参与者;上述分子的表达水平降低均意味着Wnt 信号通路受到了抑制。对于DKK1来说,它既是下游的靶基因,也是Wnt 信号通路的抑制因子;通常Wnt 信号受到激活时,DKK1 能够负反馈性地升高;相反Wnt 信号受到抑制时,DKK1 则降低。本研究中,我们认为干扰PRMT4 后能够抑制Wnt 信号通路,而PCR 结果显示DKK1 表达水平反而升高,这可能是由于胃癌细胞缺失了DKK1 对于Wnt 信号通路的负反馈调节,这一点还有待进一步研究。随后在Western blotting实验中发现,干扰PRMT4 后可降低ABC、p-GSK3β 以及Wnt/β-catenin 信号通路下游蛋白C-myc 和N-cadherin的表达。过表达PRMT4 后可升高ABC、p-GSK3β 以及Wnt/β-catenin 信号通路下游蛋白C-myc 和N-cadherin 的表达。同样验证了PRMT4 参与Wnt/β-catenin 信号通路的调节。C-myc 作为经典靶蛋白之一,参与肿瘤细胞的增殖分化;N-cadherin 作为β-catenin 的下游分子可以与之结合,参与EMT,促进肿瘤细胞的侵袭与转移[27]。由此可见,PRMT4 可能通过参与调控Wnt/β-catenin 信号通路,从而影响胃癌细胞的生长、增殖以及侵袭与转移。
总而言之,我们的实验结果表明了PRMT4 与胃癌的发生和发展有着重要的联系。作为一种促癌基因,其或许可以为胃癌的诊断与治疗提供新的思路。
参·考·文·献
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[3] Koh JC, Loo WM, Goh KL, et al. Asian consensus on the relationship between obesity and gastrointestinal and liver diseases[J]. J Gastroenterol Hepatol, 2016, 31(8): 1405-1413.
[4] Bilici A. Treatment options in patients with metastatic gastric cancer: current status and future perspectives[J]. World J Gastroenterol, 2014, 20(14): 3905-3915.
[5] Morales Y, Cáceres T, May K, et al. Biochemistry and regulation of the protein arginine methyltransferases (PRMTs)[J]. Arch Biochem Biophys, 2016, 590: 138-152.
[6] Feng Y, Maity R, Whitelegge JP, et al. Mammalian protein arginine methyltransferase 7 (PRMT7) specifically targets RXR sites in lysine- and arginine-rich regions[J]. J Biol Chem, 2013, 288(52): 37010-37025.
[7] El Messaoudi S, Fabbrizio E, Rodriguez C, et al. Coactivator-associated arginine methyltransferase 1 (CARM1) is a positive regulator of the cyclin E1 gene[J]. Proc Natl Acad Sci U S A, 2006, 103(36): 13351-13356.
[8] Frietze S, Lupien M, Silver PA, et al. CARM1 regulates estrogen-stimulated breast cancer growth through up-regulation of E2F1[J]. Cancer Res, 2008, 68(1): 301-306.
[9] Seligson DB, Horvath S, Shi T, et al. Global histone modification patterns predict risk of prostate cancer recurrence[J]. Nature, 2005, 435(7046): 1262-1266.
[10] Blanc RS, Richard S. Arginine methylation: the coming of age[J]. Mol Cell, 2017, 65(1): 8-24.
[11] Majumder S, Liu Y, Ford OH, et al. Involvement of arginine methyltransferase CARM1 in androgen receptor function and prostate cancer cell viability[J]. Prostate, 2006, 66(12): 1292-1301.
[12] Al-Dhaheri M, Wu J, Skliris GP, et al. CARM1 is an important determinant of ERα-dependent breast cancer cell differentiation and proliferation in breast cancer cells[J]. Cancer Res, 2011, 71(6): 2118-2128.
[13] 吴玉云, 杨泓莹, 覃勇, 等. 蛋白精氨酸N-甲基转移酶4 上调八聚体结合转录因子4 表达促进胃癌细胞的干性[J]. 第三军医大学学报, 2018, 40(8): 679-685.
[14] Song X, Xin N, Wang W, et al. Wnt/β-catenin, an oncogenic pathway targeted by H. pylori in gastric carcinogenesis[J]. Oncotarget, 2015, 6(34): 35579-35588.
[15] Poulard C, Corbo L, Le Romancer M. Protein arginine methylation/demethylation and cancer[J]. Oncotarget, 2016, 7(41): 67532-67550.
[16] Mohammed MK, Shao C, Wang J, et al. Wnt/β-catenin signaling plays an ever-expanding role in stem cell self-renewal, tumorigenesis and cancer chemoresistance[J]. Genes Dis, 2016, 3(1): 11-40.
[17] Pang Q, Hu W, Zhang X, et al. Wnt/β-catenin signaling pathway-related proteins (DKK-3, β-catenin, and c-MYC) are involved in prognosis of nasopharyngeal carcinoma[J]. Cancer Biother Radiopharm, 2019, 34(7): 436-443.
[18] Pasca di Magliano M, Biankin AV, Heiser PW, et al. Common activation of canonical Wnt signaling in pancreatic adenocarcinoma[J]. PLoS One, 2007, 2(11): e1155.
[19] Ou CY, LaBonte MJ, Manegold PC, et al. A coactivator role of CARM1 in the dysregulation of β-catenin activity in colorectal cancer cell growth and gene expression[J]. Mol Cancer Res, 2011, 9(5): 660-670.
[20] Li S, Cheng D, Zhu B, et al. The overexpression of CARM1 promotes human osteosarcoma cell proliferation through the pGSK3β/β-catenin/cyclinD1 signaling pathway[J]. Int J Biol Sci, 2017, 13(8): 976-984.
[21] He TC, Sparks AB, Rago C, et al. Identification of c-MYC as a target of the APC pathway[J]. Science, 1998, 281(5382): 1509-1512.
[22] Arya M, Thrasivoulou C, Henrique R, et al. Targets of Wnt/β-catenin transcription in penile carcinoma[J]. PLoS One, 2015, 10(4): e0124395.
[23] Chen X, Duan N, Zhang C, et al. Survivin and tumorigenesis: molecular mechanisms and therapeutic strategies[J]. J Cancer, 2016, 7(3): 314-323.
[24] Mineda A, Nishimura M, Kagawa T, et al. Resveratrol suppresses proliferation and induces apoptosis of uterine sarcoma cells by inhibiting the Wnt signaling pathway[J]. Exp Ther Med, 2019, 17(3): 2242-2246.
[25] Santiago L, Daniels G, Wang D, et al. Wnt signaling pathway protein LEF1 in cancer, as a biomarker for prognosis and a target for treatment[J]. Am J Cancer Res, 2017, 7(6): 1389-1406.
[26] Li Y, Jin K, van Pelt GW, et al. c-Myb enhances breast cancer invasion and metastasis through the Wnt/β-catenin/Axin2 pathway[J]. Cancer Res, 2016, 76(11): 3364-3375.
[27] Nadanaka S, Kinouchi H, Kitagawa H. Chondroitin sulfate-mediated N-cadherin/β-catenin signaling is associated with basal-like breast cancer cell invasion[J]. J Biol Chem, 2018, 293(2): 444-465.
——一道江苏高考题的奥秘解读和拓展

