碳酸钙基质牙膏中可溶氟保留量的理论探索
邓全富 唐伟月 张 环 董海德
(重庆登康口腔护理用品股份有限公司,重庆 江北 400025)
1 引言
牙膏作为一种辅助刷牙的膏状制剂,能够清洁牙齿、清新口气[1]。在牙膏中添加氟化物经过多年的临床证明,其良好的防蛀效果得到了公认[2]。目前牙膏中常用的氟化物主要以氟化钠和单氟磷酸钠为主,通过其游离(可溶性)氟化物巩固牙釉质来减轻龋齿的发生[3]。因此,牙膏中游离(可溶性)氟的含量决定着牙膏防蛀效果的好坏。一般认为,成人牙膏中游离(可溶性)氟离子含量在500 ~1000 ppm时,牙膏的防蛀功效较优,而保证牙膏中氟化物含量在货架期间的稳定性是含氟牙膏一项重要的工作[4]。
天然碳酸钙因在国内资源丰富且价格低廉,是牙膏最常用的磨擦剂。然而碳酸钙体系牙膏在放置过程中分解出少量钙离子易与氟化物作用生成不溶性氟化钙减少可溶氟含量从而降低防蛀效果[5]。因此,解决氟化物在碳酸钙体系牙膏中的稳定性具有很大的意义。
本研究从理论上主要讨论了碳酸钙基质牙膏中可溶氟保留量的影响因素(稳定剂种类及用量、pH值),通过对影响因素进行分析,期望对实际碳酸钙含氟配方体系的开发应用具有一定的帮助[6]。
2 实验部分
碳酸钙体系中直接添加氟化物配伍性较差,会引起牙膏中可溶氟含量的减少。一般常在牙膏中添加阻止Ca2+与F-结合的成分。常用方法有以下两种:一是在牙膏中添加螯合剂与Ca2+结合,使Ca2+与F-结合的几率降低从而提高可溶氟稳定性;二是在牙膏中添加其它成分使牙膏中Ca2+的浓度减少,当Ca2+浓度小于一定量时,氟化钙不产生沉淀也能使可溶氟稳定存在。后续讨论主要是针对第二种情况进行的。
2.1 单一稳定剂对可溶氟的影响
2.1.1 焦磷酸钠的稳氟作用
焦磷酸钠用于碳酸钙牙膏中,体系中发生的化学反应主要有(25℃、不考虑CO32-水解的影响):
Ca2++CO32-=CaCO3↓ ksp=4.96×10-9即[Ca2+]·[CO32-] = 4.96×10-9
2Ca2++P2O74-=Ca2P2O7↓ksp=3×10-18即[Ca2+]2·[P2O74-]= 3×10-18
Ca2++2F-=CaF2↓ksp= 1.46×10-10即[Ca2+]·[F-]2 = 1.46×10-10
以添加0.05g焦磷酸钠为例(100g牙膏,液料占比46g),则此时
C(Na4P2O7)始=0.05/(266×46×10-3) = 4.09×10-3mol/L

起始mol/L [P2O74-]始
反应mol/L 2([P2O74-]始-[P2O74-]) [P2O74-]始- [P2O74-]
平衡mol/L [Ca2+] [P2O74-]
离子平衡:[Ca2+]+2([P2O74-]始- [P2O74-]) = [CO32-]
设[Ca2+]为a、[P2O74-]为b,则a2b= 3×10-18,a×(a+2×4.09×10-3-2b)= 4.96×10-9
则a=6.07×10-7b=8.14×10-6
此时[F-] = (1.46×10-10/6.07×10-7)0.5=1.55×10-2mol/L≈135.56ppm
2.1.2 磷酸钠的稳氟作用
其中溶液中发生的化学反应主要有(25℃、不考虑PO43-、CO32-水解的影响):
CaCO3↓=Ca2+ + CO32-ksp=4.96×10-9即[Ca2+]·[CO32-] = 4.96×10-9
3Ca2++2PO43-=Ca3(PO4)2↓ ksp=2.07×10-33即[Ca2+]3·[PO43-]2= 2.07×10-33
Ca2++2F-=CaF2↓ ksp=1.46×10-10即[Ca2+]·[F-]2= 1.46×10-10
以添加0.05g磷酸钠为例(100g牙膏,液料占比46g),则此时
C(Na3PO4)始=0.05/(164×46×10-3) = 6.63×10-3mol/L
3Ca2++2PO43-=Ca3(PO4)2↓
起始mol/L [PO43-]始
反应mol/L 1.5([PO43-]始- [PO43-])[PO43-]始- [PO43-]
平衡mol/L [Ca2+] [PO43-]
离子平衡:[Ca2+]+1.5([PO43-]始- [PO43-]) = [CO32-]
设[Ca2+]为a、[PO43-]为b,则a3b2= 2.07×10-33,a×(a+1.5× 6.63×10-3-1.5b)= 4.96×10-9
则a=4.99×10-7b=1.29×10-7
此时[F]-=(1.46×10-10/4.99×10-7)0.5=1.71×10-2mol/L≈149.51ppm
2.1.3 磷酸氢二钠的稳氟作用
其中溶液中发生的化学反应主要有(25℃、不考虑PO43-、CO32-水解的影响):
CaCO3↓=Ca2++CO32-ksp=4.96×10-9即[Ca2+]·[CO32-] = 4.96×10-9
Ca2++HPO42-=CaHPO4↓ ksp=1.0×10-9即[Ca2+]·[HPO42-]= 1.0×10-9
Ca2++2F-=CaF2↓ ksp= 1.46×10-10 即[Ca2+]·[F-]2= 1.46×10-10
以添加0.05g磷酸氢二钠为例(100g牙膏,液料占比46g),则此时
C(Na2HPO4)始=0.05/(142×46×10-3) = 7.65×10-3mol/L
Ca2++HPO42-=CaHPO4↓
起始mol/L [HPO42-]始
反应mol/L [HPO42-]始- [HPO42-] [HPO42-]始-[HPO42-]
平衡mol/L [Ca2+] [HPO42-]
离子平衡:[Ca2+]+[HPO42-]始- [HPO42-] = [CO32-]
设[Ca2+]为a、[HPO42-]为b,则ab= 1.0×10-9,a×(a+7.65×10-3-b)= 4.96×10-9
则a=7.79×10-7b=1.28×10-3
此时[F]-=(1.46×10-10/7.79×10-7)0.5=1.36×10-2mol/L≈118.86ppm
2.1.4 碳酸钠的稳氟作用
其中溶液中发生的化学反应主要有(25℃、不考虑CO32-水解得影响):
CaCO3↓=Ca2++CO32-ksp= 4.96×10-9即[Ca2+]·[CO32-] = 4.96×10-9
Ca2++2F-=CaF2↓ ksp= 1.46×10-10即[Ca2+]·[F-]2=1.46×10-10
以添加0.05g碳酸钠为例(100g牙膏,液料占比46g),则此时
C(Na2CO3)始=0.05/(46×46×10-3) = 1.03×10-2mol/L
[Ca2+]=4.84×10-7mol/L
此时[F]-= (1.46×10-10/4.84×10-7)0.5=1.74×10-2mol/L≈151.84ppm
图1为不同单一缓冲剂各用量与牙膏中可溶氟保留量的关系图。由图1可以看出,在不考虑水解的影响下,同一用量稳定剂的稳氟能力排序为:碳酸钠≈磷酸钠>焦磷酸钠>磷酸氢二钠。且当碳酸钠用量在牙膏中含量为2%时,可溶氟含量约为1000 ppm。
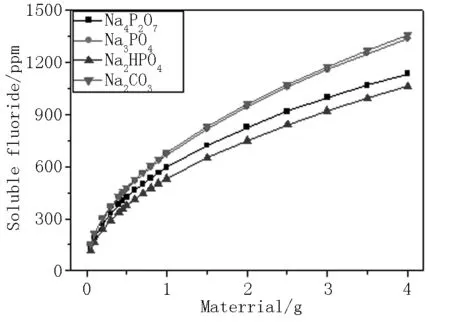
图1 各缓冲剂用量与可溶氟保留量的关系图
2.2 pH值对可溶氟的影响
前期考察了单一稳定剂用量与可溶氟保留量之间的关系,假设条件为稳定剂阴离子不水解。然而在实际牙膏体系中,稳定剂阴离子是水解的,且其水解能力与溶液pH值影响较大。因此,pH值也是可溶氟稳定的第二大影响因素。
图2为在不同pH值下,各碳酸钠用量与牙膏中可溶氟保留量的关系图。由图2可以看出,pH值越高越有利于可溶氟的稳定,且随着碳酸钠用量的增加,可溶氟保留量越大。碳酸钙型基质牙膏在pH值小于8.13时,存在酸式离解反应,体系中Ca2+浓度增大不利于可溶氟稳定[7],同时根据最新牙膏国标GB/T 8372-2017,牙膏上限pH值≤10.5[8]。当pH≥9时,可溶氟保留量上升较快;且当pH值处于9.6~10.0的范围时,可溶氟保留量上升趋势较大。pH值为10,碳酸钠用量为2%时,可溶氟含量仅约620 ppm。

图2 可溶氟保留量与pH值的关系图
3 结果与讨论
由前期信息可以看出,影响可溶氟保留量的因素强弱依次为pH>稳定剂种类>稳定剂用量。体系pH值相差1,可溶氟保留量约相差1倍。一方面低pH值会影响碳酸钙的离解,牙膏中Ca2+浓度增大,与可溶氟结合的几率增大,使得体系可溶氟保留量减少;另一方面pH影响稳定剂阴离子的水解,水解程度越大,稳定剂“有效物”含量越低,使得可溶氟保留量降低。不同稳定剂稳氟能力也有所不同,碳酸钠的稳氟效果较佳,磷酸氢二钠的稳氟效果较弱。这可能与稳氟剂自身的物质的量和与Ca2+的结合比例有关。磷酸钠的稳氟效果也不错,然而磷酸钠常见的形式为十二水化合物,达到同一稳氟效果用量较大。随着稳定剂用量的增大,稳氟效果越好。
单一稳定剂作为稳氟物质在牙膏中容易水解且体系pH值不易控制。因此,将多种稳定剂进行复配更有利于可溶氟稳定。一般常用的缓冲体系有碳酸钠/碳酸氢钠、磷酸钠/磷酸氢二钠等,两种稳定剂进行复配通过调节各物质的量能够使体系达到一恒定的pH范围,减少水解,更有利于保持可溶氟稳定。
4 结论
理论分析了碳酸钙基质牙膏中可溶氟保留量的影响因素,得到了影响因素强弱依次为体系pH>稳定剂种类>稳定剂用量。当pH值范围为9.0~10.5时,可溶氟保留量较高;同一用量稳定剂的稳氟能力依次为:碳酸钠≈磷酸钠>焦磷酸钠>磷酸氢二钠;随着同一稳定剂用量的增大,稳氟效果越好。

