无酸体系中水合肼和尿素反应合成联二脲动力学
孙 冲,吴 嘉
浙江大学化学工程与生物工程学系,浙江 杭州 310027
ADC发泡剂是一种广泛使用的发泡剂。在ADC发泡剂的生产过程中,联二脲是一种重要的中间体,其生产状况直接影响ADC发泡剂的生产和市场前景。目前工业上联二脲的生产主要采用酸法工艺,即低浓度的水合肼和尿素在酸性条件下合成联二脲[1-3]。从广义酸碱理论观点看,酸法合成联二脲的反应可以视为Lewis双取代反应,肼可提供两个电子对,尿素的酰胺基可接受一个电子对[4],反应方程式如下:

酸法工艺合成联二脲的收率可高达97%[5],主要原因是Lewis双取代反应一步完成,副反应较少。刘汴玲等[5]研究了在酸性条件下,肼与尿素反应制取联二脲过程中pH值、肼与尿素投料比、反应温度、反应时间和加酸顺序等因素对产物收率的影响。陈勇等[6]研究了酸性条件下,由水合肼和尿素缩合制取联二脲过程中水合肼浓度、肼/尿素比值、反应釜夹套温度、出料温度、洗水温度、升温方式、加酸种类及反应液pH值等的影响,确定了最佳工艺条件。这些研究为酸法工艺奠定了良好的理论基础,使酸法工艺成为工业生产联二脲和ADC发泡剂的成熟工艺。
尽管酸法工艺表现出了收率高的优势,但该工艺中的酸性介质严重腐蚀设备[7],对设备材质的要求较高;原料粗水合肼带有大量的氯化钠等盐分、反应过程中产生的铵盐[8]和反应后洗涤废水回调pH时产生的盐分,以及未反应完全的随废水排出的尿素等,使得废水的化学需氧量(COD)、氨氮浓度较高,处理难度非常大;而且产生的洗涤水废水量很大(30~50 m3/t联二脲)[9],废水处理成本高;因此酸法工艺有悖于清洁生产工艺的理念和可持续发展的战略方针。
Curtius等[10-12]提出的碱法合成联二脲反应路线可以有效避免上述不足。碱法工艺是利用高浓度的水合肼和尿素在无酸环境下反应缩合制取联二脲,第一步由水合肼和尿素合成氨基脲,第二步由氨基脲和尿素合成联二脲。其反应历程为:
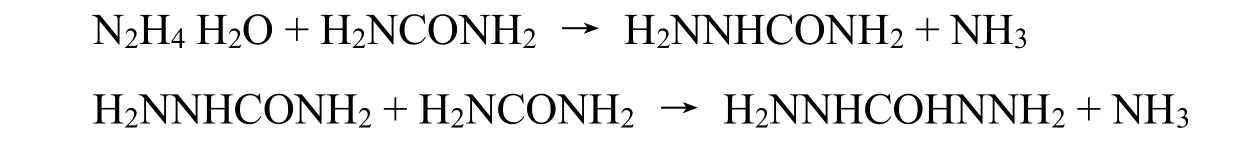
由于该工艺使用经过除杂和浓缩处理的水合肼,因此反应产物中的盐分极少,产物联二脲的纯度高;反应产物的洗涤水含有一定的水合肼,可以返回至水合肼浓缩塔,减少了废水产生量。同时,在碱性条件下,反应釜的设备材质要求大大降低,这些因素在客观上为联二脲的连续化生产创造了有利的条件。李奇勇[13]模拟分析了该工艺过程,但由于缺少精确的反应数据,无法定量分析工艺的环境经济可行性及可能存在的技术缺陷。石庆斌等[9]通过大量的小试实验,设计出一条碱法制取联二脲的工艺路线,可避免产生废水,并可提高联二脲的质量。吴嘉等[14]开发了无酸环境下振荡流管式反应结晶器合成联二脲的连续生产方法,可控制产物联二脲的粒径。胡宗贵等[15]研究了不同温度和浓度下的反应速率。然而,由于缺乏对碱法合成联二脲反应规律的理解,尤其是对其复杂的动力学行为的研究,使该工艺在工程化时缺少反应器设计和优化的定量计算依据,同时让后续的分离工艺也仅停留在可行性分析上。碱法联二脲合成反应实际是气-液-固三相反应,反应过程会析出联二脲颗粒以及氨气。本研究将考察无酸条件下水合肼和尿素缩合制取联二脲过程中联二脲颗粒以及氨气溶解度对反应的影响,并建立反应的动力学模型,为后续工程化应用的优化设计提供基础数据。
1 实验部分
1.1 动力学实验
按一定质量比将尿素(分析纯)、水合肼(质量分数85%)与去离子水置于密封的搅拌釜(140 mL)中,用氮气置换反应器内的空气。通过油浴加热反应器至设定温度,搅拌下反应至设定时间,记录反应器内部压力,并快速冷却至常温,取反应釜内上清液5 mL,经稀释后用碘标准溶液滴定确定水合肼的残余浓度。过滤反应母液得到联二脲固体,洗涤及烘干后称量固体质量。
1.2 联二脲在水中的溶解度测定
溶解度测定在如图1所示的可开启式90°弯管中进行。圆筒C1和C2通过活接连接。首先在C1中放入足够量的固体联二脲,倒入一定量的去离子水,关上活接,将其放置于恒温油浴中。12 h后将C1中经充分溶解的联二脲饱和溶液流入C2中。打开活接,称量C2与饱和溶液的总质量(m1),蒸干后称量C2与固体的质量(m2)以及C2的质量(m3)。

图1 联二脲溶解度测定装置Fig.1 Schematic drawing of solubility measurement device for biurea.
联二脲在水中的质量溶解度(S)定义如下:

实验测得的不同温度下联二脲在水中溶解度的结果见表1。cs为计算得到的溶液中联二脲的溶解度。

表1 不同温度下联二脲在水中的溶解度Table 1 The solubility of biurea in water under different temperatures
由表1可知,联二脲在水中的溶解度随着温度的升高而增大。采用最小二乘法进行溶解度和温度之间的非线性关系拟合,得到联二脲在水中的溶解度和温度之间的规律如式(2)所示。
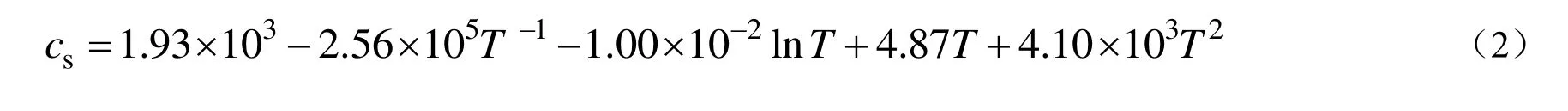
2 结果与讨论
2.1 动力学实验结果
反应在液相中进行,液相体积受温度影响较小,因此假定反应恒容。实验测定了水合肼(A)浓度和联二脲质量随时间的变化。考虑了联二脲在水中的溶解度,故生成的联二脲固体量即为称量值和溶解度之和。液相中的游离氨浓度采用ELECNRTL活度系数法在ASPEN PLUS中计算得到。其余各组分的浓度均由物料衡算得到。不同温度下,尿素(B)、氨基脲(C)、游离氨(D)和联二脲(E)的浓度随时间的变化如图2所示。
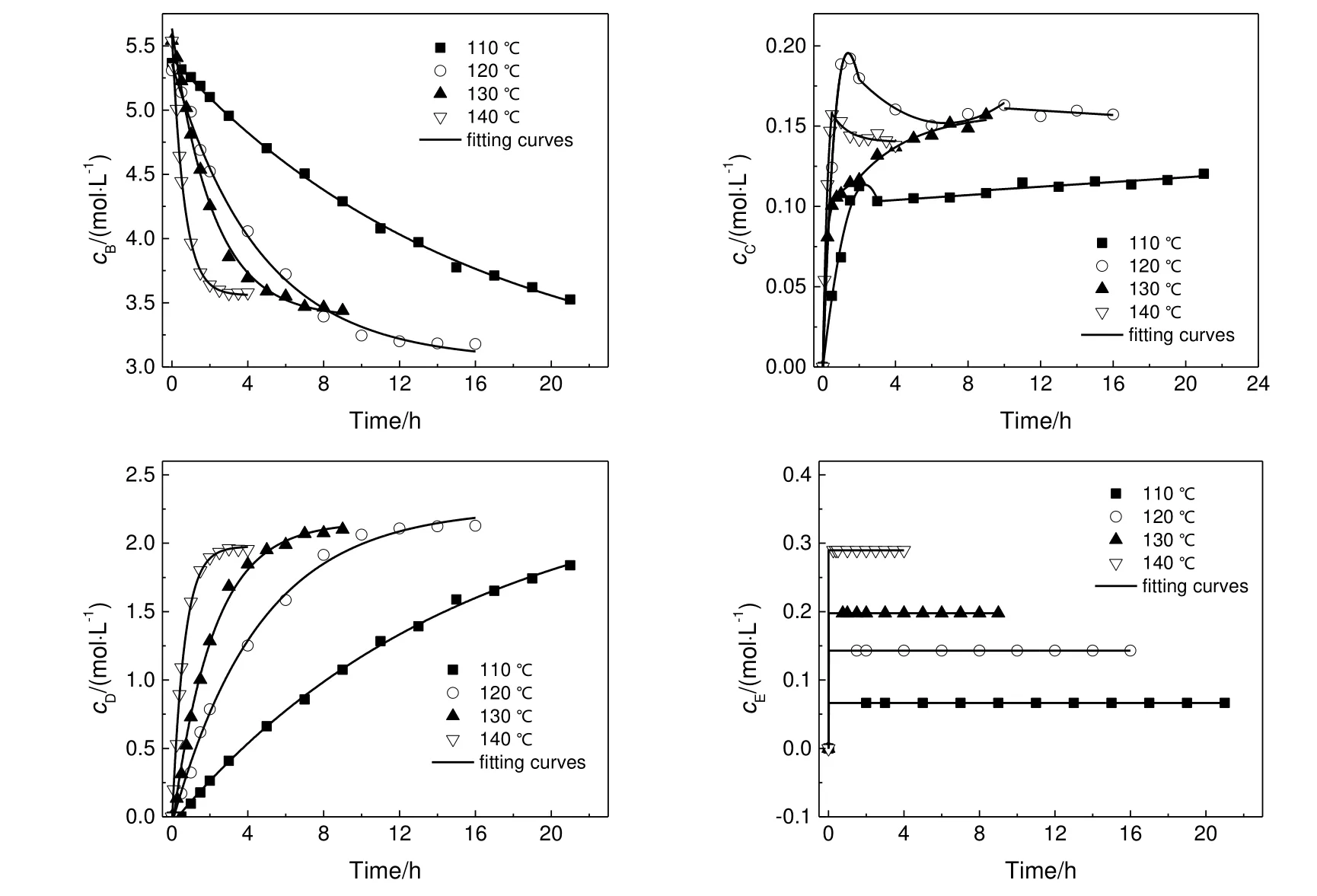
图2 不同温度下各组分浓度随反应时间的变化Fig.2 The change of component concentrations with reaction time at different temperatures
在反应过程中,氨基脲合成和联二脲合成均不断生成氨气。随着氨气产生量的增加,氨气在液相中的溶解度也将随之增大。由图2可以看出,液相中的游离氨浓度逐渐增大,但增大的速度随着反应时间的延长而逐渐减小。与此同时,联二脲质量增加的速度也随着反应时间的延长逐渐减小。游离氨浓度和联二脲质量均有趋向平衡的趋势。而中间产物氨基脲的浓度也表现出趋向稳定的可能,反应物水合肼和尿素的浓度具有相同的变化趋势。因此,氨基脲合成和联二脲合成都具有可逆反应的特性。随着反应的进行,氨气和联二脲的生成量越来越大,氨气在液相中的溶解度也越来越大,因而游离氨可与溶解在水中的联二脲逆向反应,对正向反应产生抑制作用。
对实验得到的所有组分浓度与反应时间的关系进行了拟合,结果见表2。拟合方程计算得到的浓度曲线也示于图2,结果表明两者的吻合较好。

表2 各组分浓度与时间的拟合方程Table 2 Fitting equations of all components concentrations versus time
2.2 动力学模型建立
第一步氨基脲合成反应为水合肼(A)和尿素(B)缩合得到氨基脲(C),同时逸出氨气(D)。第二步联二脲合成反应为氨基脲(C)和尿素(B)缩合得到联二脲(E),同时逸出氨气(D)。

两步反应都为可逆反应,速率可分别表示为:
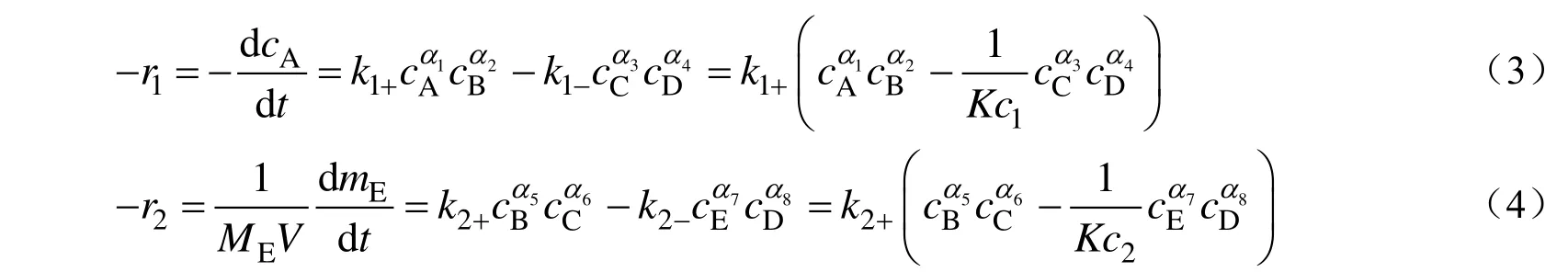
式中:ci为组分i的浓度,mol/L;αi为对应组分i反应级数;ki+、ki-分别为正反应、逆反应的速率常数,mol(1-αm-αn)·L(αm+αn-1)·h-1;Kc1、Kc2分别为第一步和第二步反应的平衡常数;mE为联二脲的质量,g;ME为联二脲的摩尔质量,g/mol;V为液相反应体积,L。
2.3 平衡常数确定
因氨基脲和联二脲的合成反应均表现出可逆反应的性质,因此经过无限长的时间,各组分均应达到平衡浓度。氨基脲和联二脲合成反应的平衡常数分别为:

式中:cieq为组分i的平衡浓度。采用表2中各组分的浓度与时间的关系可以计算得到各组分的平衡浓度以及平衡常数,结果如表3所示。
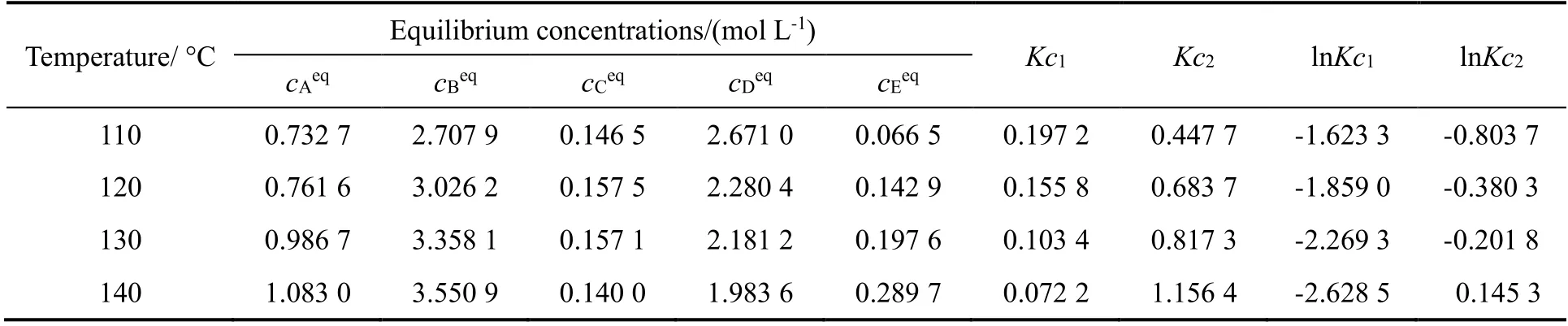
表3 各组分的平衡浓度及反应平衡常数Table 3 Equilibrium concentrations for all components and equilibrium constants
并采用最小二乘法对平衡常数与温度的关系进行了非线性拟合,结果如下:
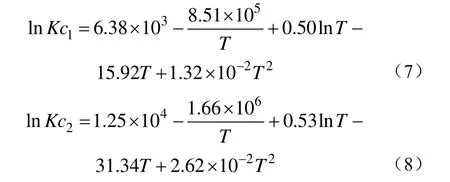
平衡常数的实验结果与计算值的比较见图3,两者的平均相对误差分别为0.73%和3.26%。

图3 平衡常数的实验值及计算值比较Fig.3 Comparison of experimental and calculated results
2.4 反应级数及速率常数的确定
分别对式(3)和式(4)分离变量并进行积分,可得:
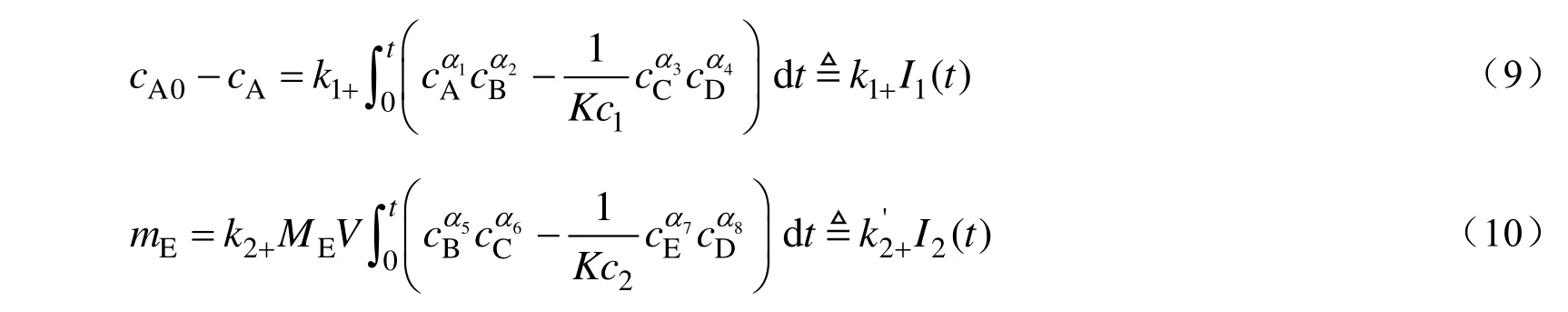
假设氨基脲合成和联二脲合成反应对各组分都表现出一级反应特性,即:αi=1,i=1~8,则(cA0-cA)与I1(t)、mE与I2(t)均应呈现出过原点的线性关系。根据图2的实验结果,采用梯形积分法计算得到的积分结果如图4所示。从图4可观察到,(cA0-cA)与I1(t)、mE与I2(t)之间确有良好的线性关系,表明假设成立,即氨基脲和联二脲合成反应中所有组分都表现出一级反应特性。
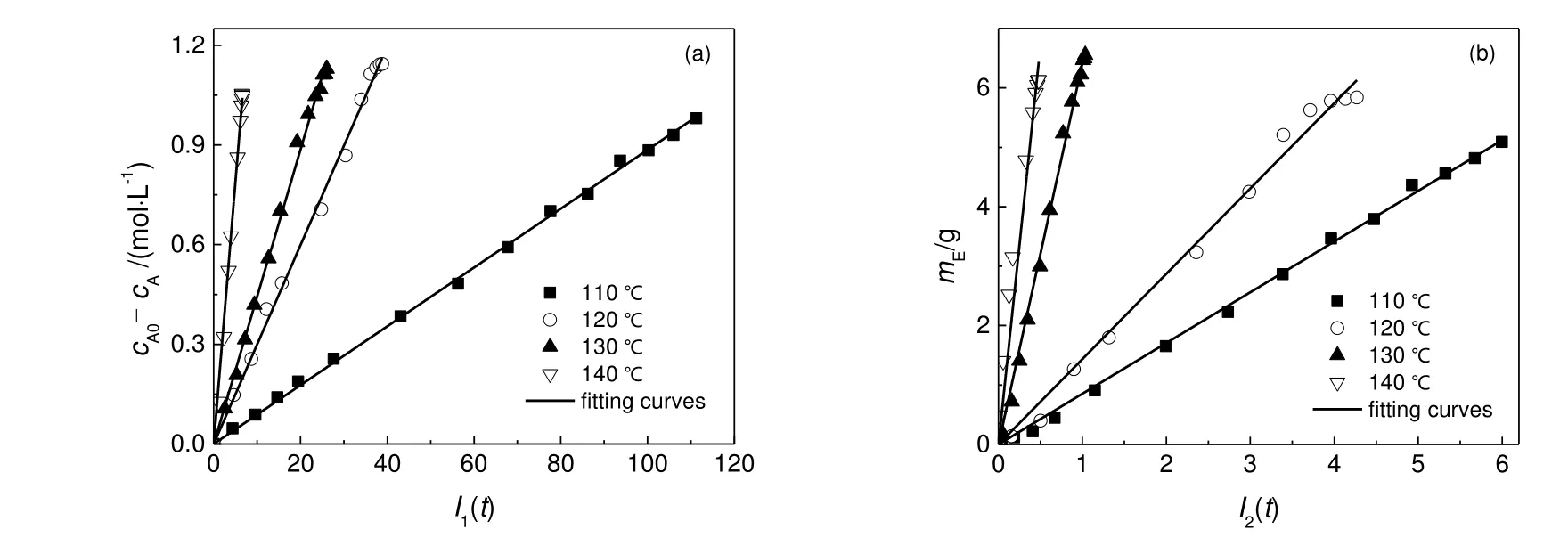
图4 不同温度下水合肼浓度及联二脲质量的变化Fig.4 Changes of hydrazine concentration and biuret mass at different temperatures
图4中的斜率即为式(9)和式(10)中的k1+和+,则不同温度下氨基脲合成的反应速率常数(k1+)和联二脲合成的反应速率常数(k2+)如表5所示。

表5 不同温度下氨基脲合成和联二脲合成的反应速率常数Table 5 Rate constants of semicarbazide synthesis and biurea synthesis at different temperatures
以修正的阿伦尼乌斯方程拟合正反应速率常数与温度T的关系,得到如式(11)和式(12)所示的结果。
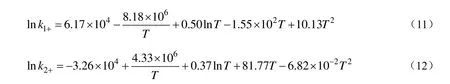
实验值和拟合公式的计算结果见图5。

图5 反应速率常数的实验值及计算值比较Fig.5 Comparison of experimental and calculated rate constants
2.5 动力学验证
为了验证动力学模型的准确性和可靠性,根据所获得的动力学方程,在MATLAB中计算了不同温度下水合肼浓度和联二脲质量随时间的变化,实验值与计算值的对比如图6所示。由图6可知,计算值与实验值吻合良好。水合肼浓度、联二脲质量的预测值和实验值之间的平均相对误差分别为1.31%和4.40%,说明获得的动力学模型及参数能准确地预测反应的动力学行为。

图6 计算值和实验值比较Fig.6 Comparison of experimental data and calculated values
3 结 论
研究了无酸环境下水合肼和尿素缩合制取联二脲的反应规律。在修正了反应液中游离氨浓度以及联二脲溶解度的基础上,建立了氨基脲合成和联二脲合成的可逆反应动力学模型。得到了不同温度下的反应平衡常数、反应速率常数和动力学模型参数。结果表明氨基脲合成和联二脲合成对所有组分均表现为一级反应。
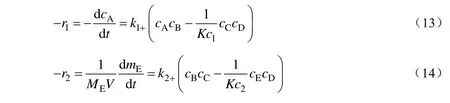
由获得的动力学方程能准确地预测水合肼浓度和联二脲质量随时间的变化,表明该动力学方程可以较好地预测反应的动力学行为,为后续工程化奠定基础。

