碱提条件对麸皮阿拉伯木聚糖组成、理化性质、流变学特性的影响
鲁振杰,李 娟,陈正行*,李 诚,王 莉,李亚男
(江南大学食品学院,江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
小麦麸皮是我国小麦制粉工业的主要副产品,年产量可达3 000万 t以上[1-2]。近年来,关于小麦麸皮高附加值利用一直是谷物精深加工领域的研究热点。小麦麸皮含有丰富的碳水化合物、蛋白质、矿物质和维生素等营养素,具有重要的利用价值。
阿拉伯木聚糖(arabinoxylan,AX)是小麦细胞壁多糖的主要成分,主要集中在小麦麸皮中,占麸皮干基质量的20%以上[3-4]。AX是谷物中重要的非淀粉多糖,是小麦膳食纤维的主要组成成分。Izydorczyk等[5]于1992年提出了AX的结构,它是由阿拉伯糖(arabinose,Ara)和木糖(xylose,Xyl)2 种单糖组成的,以(1,4)-β-D-吡喃木糖残基单元聚合为线型主链,通过C(O)-2、C(O)-3或C(O)-2,3-糖苷键连接α-L-阿拉伯呋喃糖基取代物,AX中Xyl主链上的Ara残基通常是单取代和双取代并存,且Ara残基以单体的形式取代,Ara/Xyl值表示AX的支链化程度,比值越大表明支链化程度越高。根据AX的溶解性,一般将其分为两大类:水溶性阿拉伯木聚糖(waterextractable arabinoxylan,WEAX)和水不溶性阿拉伯木聚糖(water-unextractable arabinoxylan,WUAX),两类AX的组成、结构基本相似,其结构的差异主要表现为聚合度、取代程度、取代方式以及阿魏酸含量[6-7]。小麦麸皮中WEAX约占总AX的25%~30%,而WUAX约占总AX的70%~75%,造成这一现象的主要原因是,麸皮中90%的AX与细胞壁中的木质素、纤维素、蛋白质等组分存在着较多的以阿魏酸连接的共价酯键,使其难以溶解[8]。在碱性条件下(NaOH溶液、饱和Ba(OH)2溶液、Ca(OH)2溶液等),这种共价酯键被打断,有利于AX的分离提取,WUAX变为WEAX,因此碱液通常被用作小麦麸皮、米糠等AX的提取剂[9]。基于AX的结构特性,其应用前景非常广泛,现有研究表明,AX不仅具有良好的生理功能特性,如抗氧化、降血糖、调节肠道功能等;还具有凝胶特性,被用于制备面团改良剂、水凝胶、膜材料等[10-11]。
目前,关于AX提取研究的报道较多,主要有水热提取法、酶解提取法和碱提取法。Aguedo等[12]采用碱提取法、酶处理法和水热法提取麦麸AX。结果表明,碱法和水热法能高效提取AX,而酶法提取得率和纯度均较低;张晓娜等[13]采用酸水洗结合碱法工艺提取麦麸AX,最高得率可达到20.89%;Ayalasoto等[14]研究提取时间、温度和NaOH浓度对玉米纤维AX得率的影响。结果表明,较长的提取时间和较高的温度下,AX得率较高,最高可达到36.6%。在已有AX的提取研究报道中,主要是围绕优化提取工艺以获得较高的提取得率,而很少关注提取过程中不同提取条件所得AX的单糖组成、纯度及理化性质的差异。杨莎等[15]采用不同碱溶液提取麦麸AX发现,采用NaOH(含0.88% H2O2)溶液所得AX纯度较高,侧链取代度较低;而采用饱和Ba(OH)2溶液所得AX纯度最高,侧链取代度和分子质量也较大。袁建等[16]通过分析不同提取时间、pH值和温度对AX分子质量分布的影响,发现提高pH值和温度可以获得富含多种高分子质量的AX。因此,对不同碱提取条件所得AX的性质进行分析有助于指导AX在实际生产中的开发和应用。本实验以小麦麸皮为原料,探讨不同碱提取条件对AX的组成成分、纯度、分子质量和溶液黏度的影响,以期为小麦麸皮AX的开发和应用提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
小麦麸皮 中粮集团有限公司;液体高温淀粉酶(≥250 U/g)、液体碱性蛋白酶(≥2.4 U/g) 美国Sigma公司;葡萄糖(Glu)、Xyl、Ara、葡聚糖标准品中国药品生物制品检定所;无水乙醇、硫酸、盐酸、氢氧化钠、碳酸钙、硫酸铜、硫酸钾、硝酸钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SYF系列多功能干湿法粉碎机 瑞安善源机械有限公司;MPG-100H超级恒温循环酶解罐 上海一恒科学仪器有限公司;C-MAG HS 7磁力搅拌器 德国IKA仪器有限公司;Beta2-8 LD plus冷冻干燥机 德国Marin Christ公司;Avanti J26XP高速冷冻离心机 美国Beckman Coulter公司;1200高效液相色谱仪 安捷伦科技(中国)有限公司;1525高效液相色谱仪(配2410示差折光检测器和Empower工作站)、DHR-3流变仪 美国沃特世公司。
1.3 方法
1.3.1 麦麸预处理
将麦麸粉碎并过80 目筛,按料液比1∶10(g/mL)加入去离子水,于酶解罐中升温至93 ℃,每100 g麦麸加入0.6 mL高温淀粉酶原液,搅拌酶解3 h,降温至碱性蛋白酶最适温度63 ℃,每100 g麦麸加入0.8 mL碱性蛋白酶原液,搅拌酶解3 h,酶解过程结束后升温至100 ℃,保温10 min灭酶,酶解液以4 000 r/min离心10 min,将所得沉淀用去离子水洗涤3 次,冻干制得去淀粉、脱蛋白的麦麸[17]。
1.3.2 AX的提取
取1.3.1节处理麦麸,以料液比1∶20(g/mL)与一定浓度NaOH溶液混合,在酶解罐中维持恒定温度,在搅拌条件下反应一定时间。反应结束后,冷却至室温后以4 000 r/min离心10 min,沉淀物用去离子水洗涤3 次,收集所有上清液,用6 mol/L盐酸溶液将上清液调至pH 4.3,以13 000 r/min离心15 min,取上清液加入3 倍体积无水乙醇以沉淀多糖,使乙醇溶液终体积分数为75%,4 ℃静置过夜。醇沉后倒去上清液,用75%乙醇溶液洗涤3 次,所得沉淀挥发除去过量乙醇,冷冻干燥制得AX样品[18]。
1.3.3 不同提取条件AX的制备
分别以NaOH浓度、提取温度和提取时间为单因素自变量,在一定的变量范围内考察不同提取条件对AX性质的影响。
分别在NaOH浓度0.1、0.25、0.5、0.75、1、1.25 mol/L条件下,固定提取温度85 ℃、提取时间120 min、料液比1∶20(g/mL)等条件提取AX。
分别在提取温度45、55、65、75、85、95 ℃条件下,固定NaOH浓度0.5 mol/L、提取时间120 min、料液比1∶20(g/mL)等条件提取AX。
分别在提取时间60、90、120、150、180、210 min条件下,固定NaOH浓度0.5 mol/L、提取温度85 ℃、料液比1∶20(g/mL)等条件提取AX。
1.3.4 AX单糖组成测定
采用高效液相色谱法测定不同提取条件下AX的单糖组成。
样品制备:称取10 mg样品于15 mL样品瓶中,加入0.3 mL 72% H2SO4,于30 ℃水浴锅中水解1 h,期间搅拌数次。加入8.4 mL去离子水,于121 ℃高温水解1 h,冷却至室温。取3 mL于离心管中,称取130 mg碳酸钙分数次加入中和,离心取上清液,经0.22 μm滤膜过滤后进行分析。标准曲线:配制Glu、Xyl、Ara质量浓度分别为1.5、1、0.5 mg/mL的标准溶液,以0.5、5、10、15、20 μL的梯度进样,作3 种单糖的标准曲线。
色谱条件:Hi-Plex H色谱柱(300 mm×7.7 mm);柱温55 ℃;示差折光检测器;检测温度30 ℃;流动相为超纯水,流速0.6 mL/min;分析时间20 min[19-20]。
AX样品的纯度表示为Xyl和Ara的含量之和,即AX含量;AX样品提取得率按下式计算:

蛋白质含量测定采用GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法。
1.3.5 AX分子质量分布测定
采用高效凝胶过滤色谱法[21],从不同NaOH浓度、提取温度和提取时间3 个因素中分别选择具有代表性的3 个水平进行测定。样品制备:用流动相溶解不同提取条件的AX样品,配制成质量浓度为10 mg/mL溶液,离心后过0.22 μm滤膜,进行分析。标准曲线:取已知分子质量的葡聚糖标准品(Glu 180 g/mol,mw2 700、9 750、135 030、300 600、2 000 000 g/mol),经与上述相同处理后,绘制标准曲线。
色谱条件:1525高效液相色谱仪(配2410示差折光检测器和Empower工作站);Ultrahydrogel™ Linear色谱柱(300 mm×7.8 mm);柱温、检测器温度35 ℃;流动相为0.10 mol/L硝酸钠溶液,流速0.8 mL/min。
1.3.6 流变分析
取不同提取条件的AX配成质量浓度0.02 g/mL溶液,在25 ℃条件下测定样品的剪切黏度,流变仪模具为40 mm平板,测定间隙为800 μm,在剪切速率1~1 000 s-1范围内进行剪切黏度的测定[22]。
1.4 数据处理
采用Origin软件进行数据作图处理,采用SPSS软件对数据进行ANOVA方差分析、Duncan多重比较,P<0.05,差异显著。每组实验重复3 次,结果以 ±s表示。
2 结果与分析
2.1 碱提取条件对AX单糖组成的影响
本实验所提取AX样品中阿拉伯半乳糖、鼠李糖等单糖含量较少[23],因此主要对样品中Glu、Xyl、Ara 3 种主要单糖进行考察,分析不同碱提取条件对其含量变化的影响规律。麦麸经预处理后,淀粉基本被除去,而麦麸中的蛋白质部分是结合蛋白[18],因此蛋白酶前处理只能除去部分蛋白质,其蛋白质质量分数由(15.78±0.02)%下降至(10.33±0.14)%,所得处理后麦麸原料的得率为53.65%。
2.1.1 NaOH浓度对AX单糖组成的影响
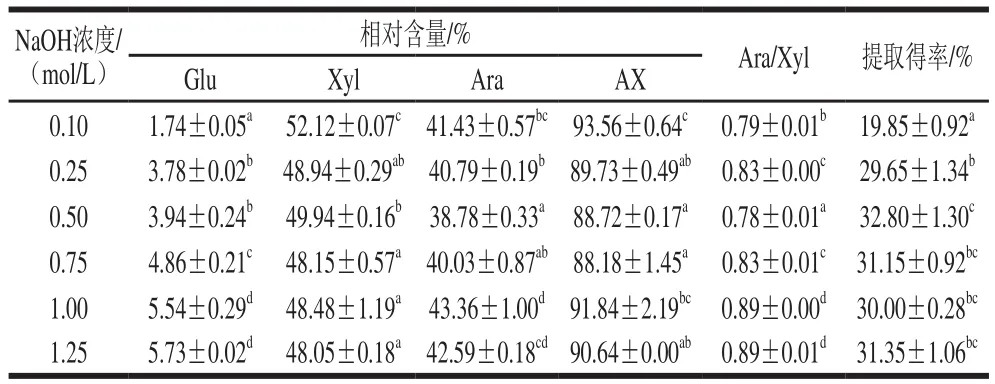
表1 不同NaOH浓度下AX单糖组成及得率Table 1 Monosaccharide composition and yield of arabinoxylan obtained at different alkali concentrations
由表1可知,随NaOH浓度的增加,样品中Glu相对含量显著增加,表明随麦麸结构破坏程度的增加,AX分子结合的纤维素等物质被溶解出来,在测定单糖组成的强酸环境中被分解为Glu而检测出[24]。Xyl相对含量随NaOH浓度的增加而减少,而Ara却有所增加,Ara/Xyl值也随之增大,说明高NaOH浓度下能溶解出支链度高的AX分子,表明所提取的AX分子的支链化程度与其在麦麸中的结合程度呈正相关。此外,部分支链度低的AX分子在高NaOH浓度下易被分解。
AX纯度随NaOH浓度的增加呈现先下降后上升的趋势,在较低NaOH浓度时AX样品的纯度较高,但其得率较低,表明较低NaOH浓度的处理作用较弱,只能溶解出与木质素、纤维素等其他麦麸成分结合程度较低的部分,而不足以完全破坏麦麸的结构,以溶解出较多的AX[25]。当NaOH浓度达到0.5 mol/L时,能获得较高的提取得率,说明此NaOH浓度条件下,麦麸中的AX组分已能被完全溶解出,但其纯度降低,表明所得样品中部分AX分子是以与其他物质相结合的形式存在。当NaOH浓度高于0.75 mol/L时,其纯度增大,说明高NaOH浓度能将上述以结合形式存在的AX分子溶解出,从而提高其纯度,同时也有少量AX分子在高NaOH浓度下被分解,导致提取得率降低。因此,在提取温度85 ℃和提取时间120 min条件下,当NaOH浓度达到0.5 mol/L时,可获得较高提取得率的AX,其得率和纯度分别为32.8%和88.72%。
2.1.2 提取温度对AX单糖组成的影响

表2 不同提取温度下AX单糖组成及得率Table 2 Monosaccharide composition and yield of arabinoxylan obtained at different extraction temperatures
由表2可知,随提取温度的升高,AX样品中Glu相对含量显著减少[26],当提取温度达到85 ℃时不再减少,表明较高的温度能将部分结合的纤维素等降解为Glu,在醇沉时随上清液被除去。Xyl和Ara相对含量均随温度的升高而增加,但Ara的增加速率高于Xyl,从而Ara/Xyl值随温度的升高而增加,支链化程度增大,表明在高温条件下结合程度高的AX也易被溶解出,也说明高支链度AX分子的结合结构在高温下易被破坏[24],与上述高NaOH浓度所得AX的支链度高的结论相似。
随提取温度的升高,AX纯度及提取得率均显著增加,当温度达到75 ℃时,其提取得率基本不再增加,但其含量仍在增加,在85 ℃时其提取得率和含量均随温度的升高而变化较小,表明在NaOH浓度0.5 mol/L和提取时间120 min条件下,提取温度为85 ℃时能提供足够的反应温度以获得较高提取得率和纯度的AX样品。
2.1.3 提取时间对AX单糖组成的影响
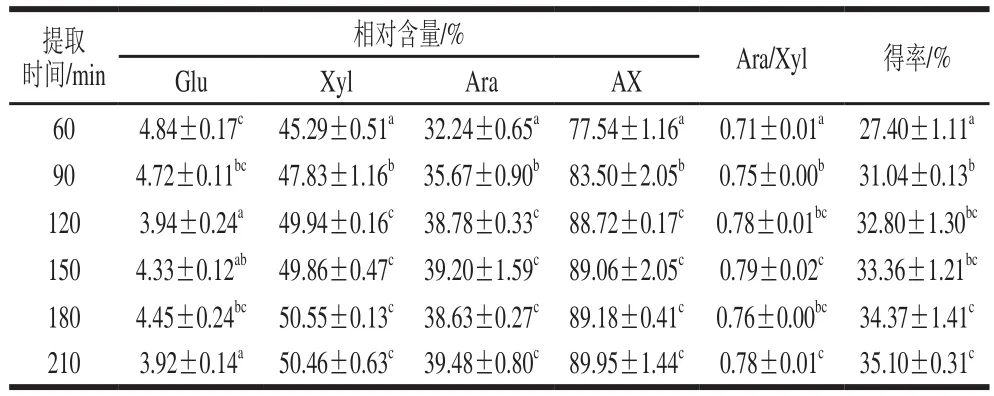
表3 不同提取时间下AX单糖组成及得率Table 3 Monosaccharide composition and yield of arabinoxylan obtained at different extraction times
由表3可知,AX样品中Glu相对含量随提取时间的延长而减小,是由于提取时间的延长,样品中结合的纤维素等被逐渐分解为Glu而在醇沉时被除去。Xyl和Ara相对含量均随提取时间的延长而增加,Ara/Xyl值也有所增加,表明提取时间的延长有利于溶解出高支链度的AX分子,可通过控制提取时间制备高支链度的AX样品。
随提取时间的延长,AX相对含量及提取得率均增加,当提取时间达到120 min时,其含量基本稳定,而提取得率在提取时间由120 min延长到180 min时仍有增加,说明少部分结合程度高的AX分子需较长的提取时间才能被溶解出来,但时间的延长也会造成AX分子的降解[14]。因此,在NaOH浓度0.5 mol/L和提取温度85 ℃条件下,提取时间120 min可认为足够。
2.2 碱提取条件对AX分子质量分布的影响
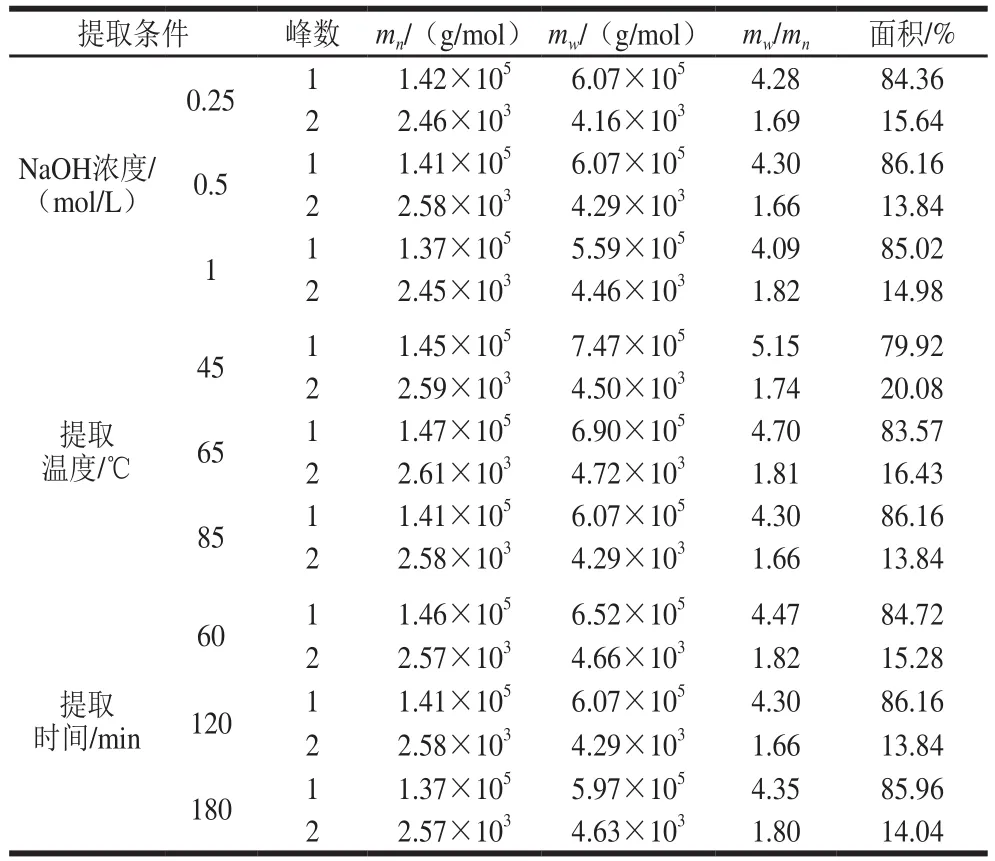
表4 不同提取条件下AX分子质量分布Table 4 Relative molecular mass distribution of arabinoxylan obtained at different extraction conditions
mw/mn表示高聚物混合物分子质量的分布宽度,其比值越大,说明分子质量分布越宽,分子链长短不均匀程度越高[16]。如表4所示,本实验所提取AX的分子质量分布均有2 个峰,峰1为较大的分子质量分布峰,峰2为较小的分子质量分布峰,其中峰1的面积所占比例均在80%以上,表明所提取AX的分子质量分布具有较好的均一性。
当NaOH浓度由0.25 mol/L增加到1 mol/L时,所得样品峰1的mw有所减小,而峰2的mw有所增加,表明高碱浓度条件下,部分高分子质量的AX分子被分解,导致峰1的mw/mn值减小,而峰2的mw/mn值增加。当NaOH浓度由0.25 mol/L增加到0.5 mol/L时,峰1的面积增加,而峰2的面积减小,表明在此变化区间内,低分子质量分子的分解程度大于高分子质量分子[27];而NaOH浓度由0.5 mol/L增加到1 mol/L时,峰1的面积减小,而峰2的面积增加,说明此条件对高分子质量分子的分解程度较大[15]。
随提取温度的升高,峰1的mw显著减小,峰面积却显著增加,表明在较高提取温度下,AX分子会发生严重的分解作用,将高分子质量的分子分解为中等分子质量和较小分子质量的分子,从而使峰1的mw/mn值显著减小,分子链的长短均匀性更好。峰2的mw随提取温度的升高变化较小,而峰面积却显著减小,说明高温对低分子质量分子的分解作用更强,使其分解为更小的分子或糖单元,在醇沉中由于分子质量过小,不产生沉淀而被除去[12]。
提取时间由60 min延长到120 min时,峰1和峰2的mw及mw/mn值均减小,而峰1的峰面积有所增加,表明提取时间的延长对低分子质量分子的分解程度大于高分子质量分子;而提取时间由120 min延长到180 min时,AX的分子质量变化较小;表明提取时间的延长可增加高分子质量分子的含量,但相比于NaOH浓度和提取温度,提取时间对分子质量的影响较小,该结果和袁建等[16]对AX分子质量分布的研究结果相似。
2.3 提取条件对AX溶液黏度的影响

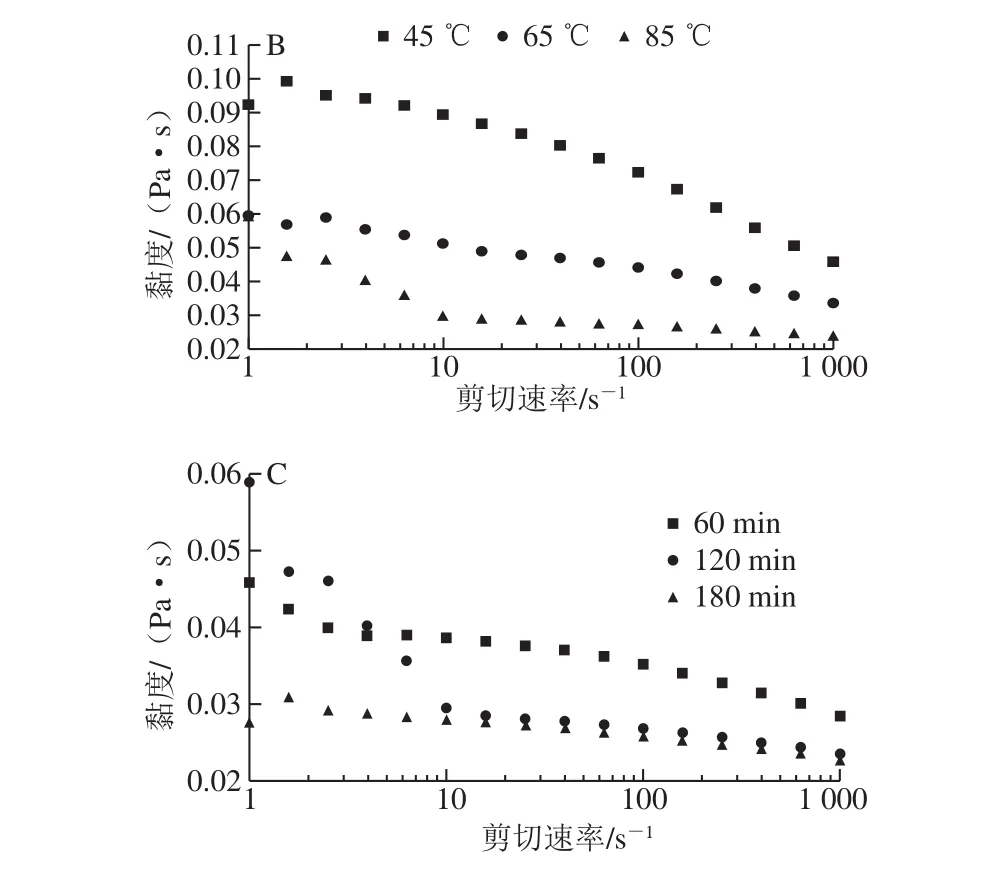
图1 NaOH浓度(A)、提取温度(B)和提取时间(C)对AX溶液剪切黏度的影响Fig. 1 Shear viscosities of arabinoxylan solutions obtained at different NaOH concentrations (A), extraction temperatures (B), and extraction times (C)
由图1A可知,碱提取AX溶液具有剪切变稀的性质,为非牛顿流体。随提取NaOH浓度的增加,在线性区域的溶液剪切黏度随之增大。结合前面单糖组成及分子质量变化的分析,NaOH浓度由0.25 mol/L增加到0.5 mol/L时,溶液剪切黏度的增加是由于后者的高分子质量AX分子含量的增加,分子间相互缠绕增加,使分子间作用力增大,而具有较大的剪切黏度;当NaOH浓度为1 mol/L时,所得样品具有较高的支链度和纯度,高支链度有利于分子间的相互缠绕,使分子间的作用力较强,形成具有较大剪切黏度的溶液[28]。
由图1B可知,随提取温度的升高,AX溶液在线性区域的剪切黏度随之减小。提取温度为45 ℃和65 ℃时,所得样品溶液的剪切黏度随剪切速率均匀减小,而85 ℃的样品溶液在剪切速率为10 s-1时具有明显的拐点,表明此时样品溶液达到最大剪切应力[29]。提取温度由45 ℃升高至65 ℃时,溶液剪切黏度明显减小,由单糖组成及分子质量分布分析可知,65 ℃时高分子质量AX分子的含量及支链度增加,但其分子质量却显著减小,说明分子质量减小对溶液黏度的影响较大[28]。当提取温度升高至85 ℃时,溶液剪切黏度也具有明显的减小,主要是由于高温作用对AX分子具有较强的分解作用,使其分子质量显著减小,从而使溶液的剪切黏度较小。
由图1C可知,AX溶液在线性区域的剪切黏度随提取时间的延长而减小。由单糖组成及分子质量分布可知,提取时间由60 min延长至120 min时,由于分子质量的显著减小,即使其高分子质量分子的含量及支链化程度有所增加,溶液的剪切黏度仍明显减小;当提取时间延长至180 min时,溶液剪切黏度较120 min的样品减小较少,主要是由于提取时间的延长使AX分子发生部分降解,导致剪切黏度的降低。
3 结 论
NaOH浓度、提取温度和提取时间对AX的单糖组成、分子质量分布和溶液黏度均有显著的影响。通过控制碱提取条件可获得不同纯度和支链度的AX样品,在NaOH浓度、提取温度和提取时间分别为0.5 mol/L、85 ℃和120 min时可获得纯度和提取得率分别为88.72%和32.8%的AX样品。通过增强提取反应的条件可获得低分子质量的AX,其中提高温度对其分子质量分布具有较大的影响;AX溶液的黏度随提取NaOH浓度的增加而增大,随提取温度和时间的增加而明显减小。

