等电点沉淀提取蛋白和漂洗鱼糜蛋白的高温胶凝特性
石 柳,章 蔚,2,周俊鹏,2,汪 兰,李 新,丁安子,熊光权,杨 宏*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北省农业科技创新中心农产品加工研究分中心,湖北 武汉 430064;2.湖北工业大学生物工程与食品学院,湖北 武汉 430068;3.华中农业大学食品科技学院,湖北 武汉 430070)
蛋白质是鱼肉的重要组成成分和营养成分,鱼肉蛋白的提取及特性研究对于食品业的发展具有重要意义。等电点沉淀法(isoelectric solubilization precipitation,ISP)是根据肌肉蛋白在极酸极碱条件下溶解度不同的原理,通过改变溶液pH值诱导原料中蛋白质溶解或沉淀进行分离提取的方法[1]。相较于传统漂洗法,ISP法具有操作简单、蛋白质得率高、去脂效果好等优势[2-3]。目前,该技术已成功应用于提取鲱鱼、岩鱼、鲶鱼、鲢鱼等鱼类肌肉蛋白质,被认为是一种提取鱼肉蛋白质的高效方法[4-8]。
不同的提取方法或酸碱处理都会导致鱼肉蛋白组成和结构的变化,直接影响蛋白质的功能特性,从而影响鱼肉蛋白的加工过程和产品品质[9-10]。鱼肉蛋白具有诸多功能特性,如水合性、乳化性、成膜性、胶凝性等。其中,胶凝特性是鱼肉蛋白最重要的功能特性,目前关于鱼肉蛋白热诱导凝胶的机理研究较多,加热温度主要集中在100 ℃以下。马瑶兰等[11]研究发现在40~90 ℃条件下,非二硫共价键是形成鲢鱼鱼糜凝胶网络的主要作用力之一。郑昇阳等[12]通过研究发现大黄鱼鱼糜的凝胶强度和质构特性随着凝胶化温度的升高而降低,在35 ℃时制得的鱼糜凝胶产品特性较好。张梦玲等[13]研究发现鲢鱼糜在40 ℃保温1 h后90 ℃加热30 min条件下可以形成较高凝胶强度的鱼糜凝胶,同时发现在100 ℃以下热诱导形成的凝胶需贮藏在4 ℃,且保质期较短。而100 ℃以上热处理形成的凝胶保质期得到延长,但蛋白质在高温下品质也发生较大的变化。张莉莉[14]研究发现在100~120 ℃温度范围内,阿拉斯加狭鳕鱼糜凝胶的凝胶强度随着加热温度的升高而显著降低。韩静文[15]研究不同热加工条件的鱼糜凝胶特性变化,同样发现随着加热温度的升高,鱼糜凝胶的凝胶强度、弹性、持水性等相关指标的下降速度加快。Belibagli等[16]研究发现,鱼糜在温度超过85 ℃的条件下,热特性发生变化,并认为是高温处理破坏了其鱼糜凝胶结构所致。但目前关于ISP提取蛋白质的高温胶凝特性研究还鲜见报道。因此,本实验以白鲢为原料,采用漂洗法和ISP法提取蛋白质,对比研究ISP提取蛋白质与漂洗鱼糜蛋白质的高温胶凝特性的差异,以期为常温即食ISP提取蛋白凝胶制品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
新鲜白鲢(Hypohthalmichthyx mitrix) 华中农业大学菜市场;冷冻白鲢鱼糜(AAA级,添加6%蔗糖和0.3%三聚磷酸盐为抗冻剂) 洪湖井立水产食品有限公司。冷冻鱼糜切分300 g左右小块,真空包装,-80 ℃冻藏备用。
氢氧化钠、盐酸、氯化钠、氯化钾、磷酸二氢钠、磷酸氢二钠、考马斯亮蓝G-250、山梨醇、蔗糖、尿素、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、磷酸 国药集团化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、四甲基乙二胺、冰醋酸、丙烯酰胺、蛋白质标准品、过硫酸铵、甲叉双丙烯酰胺、考马斯亮蓝R-250 美国Bio-Rad公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、8-苯胺-1-萘磺酸 美国Sigma公司;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB) 瑞士Fluka公司。所有试剂均为分析纯。
1.2 仪器与设备
812绞肉机 美国Biro公司;ZM-100反压蒸煮消毒锅 广州标际包装设备有限公司;HH-6恒温水浴锅中国欣灵电气股份有限公司;Avanti-JE高速冷冻离心机美国Beckman Coulter公司;T18高速分散均质机 德国IKA公司;UMC5真空斩拌机(配RB 0006C真空泵)美国Stephan Machinery公司;TA-HDi质构仪 美国Texture Technologies Corp公司;CR-400色差仪 日本Minolta Camera司;722s可见分光光度计 上海精密科学仪器有限公司;818 pH计 美国奥立龙公司;Mini电泳系统、XR凝胶扫描仪 美国Bio-Rad公司。
1.3 方法
1.3.1 ISP提取蛋白质的制备
参考Abdollahi等[17]的方法并作适当调整。白鲢在4 ℃解冻12 h,称取860 g样品,与冷却蒸馏水以料液比1∶6(g/mL)混合,均质10 min,用1 mol/L NaOH溶液调节均质液pH值至11.5,继续均质10 min,4 ℃、10 000×g离心10 min。离心后均质液出现分层,表层为漂浮的脂质组分,底层为不溶性物质组分,中间层为可溶性蛋白。8 层纱布过滤获得中间层的可溶性蛋白溶液,用8 mol/L HCl溶液调节溶液的pH值至5.5,轻微搅拌10 min,4 ℃、10 000×g离心10 min。离心后倾倒上清液,收集的沉淀即为ISP提取蛋白质组分。
1.3.2 蛋白凝胶的制备
参考张瑞婷等[18]的方法,将冷冻白鲢鱼糜(漂洗蛋白)和ISP提取蛋白在室温下解冻30 min,切成小块后于真空斩拌机中低速空斩1 min;加入质量分数2%的NaCl,低速斩拌1 min;加入0.5%谷氨酰胺转胺酶(transglutaminase,TGase),加入冰水调节水分质量分数至78%,低速斩拌1 min;最后在真空(50 kPa)条件下高速斩拌3 min。整个过程中控制斩拌机内温度在1~4 ℃。将斩拌好的鱼糊手动灌入塑料肠衣(直径约20 mm)中,用卡口机两端封口。蛋白凝胶经低温凝胶化(40 ℃水浴加热60 min)后在不同高温(100、110、120 ℃)条件下加热不同时间(15、30、60 min)。以40 ℃水浴加热60 min后90 ℃水浴加热30 min的样品为对照。加热完成后,迅速用冰水冷却至室温,于4 ℃冰箱放置过夜,待次日进行指标检测。
1.3.3 质构特性的测定
参考王蒙娜等[19]的方法,将蛋白凝胶于室温恒温2 h后,切成2 cm长的圆柱体,采用P/0.25s球形探头进行穿刺实验。测试参数:触发力5 g,测前速率5 mm/s,测中速率1 mm/s,测后速率5 mm/s,穿刺距离15 mm。记录破断力(g)和凹陷深度(mm)。
1.3.4 持水性的测定
参考Yin等[20]的方法,将蛋白凝胶切成约3 mm厚的薄片,称质量(m1),用两层滤纸包裹后,于3 000×g室温离心10 min,再称量凝胶的质量(m2)。持水性的计算如式(1)所示:

1.3.5 色度的测定
参考周俊鹏等[21]的方法,将蛋白凝胶于室温恒温2 h后,切成2 cm长的圆柱体,用色度仪检测其横截面的亮度值(L*)、红度值(a*)和黄度值(b*)。白度(W)的计算如式(2)所示:

1.3.6 化学作用力的测定
参考Zhang Longteng等[22]的方法略作修改。称取2 g蛋白凝胶样品,加入10 mL 0.05 mol/L NaCl溶液(A),混合均质后于4 ℃放置1 h,10 000×g、4 ℃离心15 min,过滤后取沉淀;向沉淀中加入10 mL 0.6 mol/L N a C l溶液(B),混合均质后于4 ℃放置1 h,10 000×g、4 ℃离心15 min,取上清液,采用考马斯亮蓝法测定蛋白质质量分数,即为离子键质量分数,过滤后取沉淀;向沉淀中加入10 mL 0.6 mol/L NaCl和1.5 mol/L尿素混合溶液,混合均质后于4 ℃放置1 h,10 000×g、4 ℃离心15 min,取上清液测定蛋白质质量分数,即为氢键质量分数,过滤后取沉淀;向沉淀中加入10 mL 0.6 mol/L NaCl和8 mol/L尿素混合溶液,混合均质后于4 ℃放置1 h,10 000×g、4 ℃离心15 min,取上清液测定蛋白质质量分数,即为疏水键质量分数。
1.3.7 总巯基含量的测定
参考贾丹[23]的方法,称取8 g蛋白凝胶样品,加入22 mL 0.02 mol/L Tris-HCl缓冲液(pH 7.0,含0.6 mol/L KCl和0.01 mol/L EDTA),均质,6 000×g离心10 min,取上清液,调节上清液蛋白质质量浓度为2 mg/mL,取0.5 mL上溶液,加入4.5 mL 0.2 mol/L Tris-HCl 缓冲液(pH 7.0,含0.01 mol/L EDTA、8 mol/L尿素和20 mg/mL SDS和0.5 mL 1 mg/mL DTNB,混合均匀后于40 ℃水浴25 min,412 nm波长处测定吸光度。总巯基含量的计算如式(3)所示:

式中:A412nm为412 nm波长处吸光度;ε为摩尔消光系数13 600 L/(mol·cm);B为蛋白质质量浓度/(mg/mL)。
1.3.8 SDS-PAGE分析
参考朱萌等[24]的方法,样品采用5% SDS溶液加热溶解,离心后取上清液,调节上清液蛋白质浓度至2 mg/mL,加入上样缓冲液。采用40 mg/mL和100 mg/mL的浓缩胶和分离胶进行电泳,用0.125% R-250考马斯亮蓝固定和染色,然后用50%甲醇和10%冰乙酸脱色。蛋白质条带的分子质量通过蛋白质标准品确定。
1.4 数据处理
实验数据使用Excel进行处理,采用SPSS 20.0进行差异显著性分析和相关性分析,用GraphPad Prism 5.0进行作图。
2 结果与分析
2.1 凝胶强度分析
如图1所示,在相同热处理条件下,ISP提取蛋白凝胶的破断力低于漂洗蛋白凝胶,而凹陷深度高于漂洗蛋白凝胶,表明ISP蛋白凝胶硬度较小而弹性更高。鱼肉蛋白的热诱导聚集是鱼肉肌原纤维蛋白结构和功能特性变化的复杂物化过程。在加工过程中,蛋白质展开,暴露蛋白质内部的功能团。这些功能基团在随后的分子内和分子间的交联作用下形成三维网络结构。在蛋白质结构快速展开和随后慢速聚集条件下,热变性蛋白通过有序排列形成致密的网络结构,凝胶强度高[25]。而在ISP加工过程中,蛋白部分变性,表面疏水性增加,结构未充分展开的蛋白质在加热前部分聚集,降低凝胶强度。另外,ISP蛋白凝胶破断力的降低还可能与内源性蛋白酶在加热过程中降解鱼肉蛋白有关。内源性蛋白酶为水溶性的肌浆蛋白,在漂洗过程中大部分被除去,而在ISP加工中部分被回收。

图1 高温热处理对漂洗蛋白凝胶和ISP蛋白凝胶质构特性的影响Fig. 1 Effects of high temperature treatments on the texture properties of washed surimi gels and ISP protein gels
在高温加热过程中,漂洗蛋白凝胶的破断力随着温度的升高先增加后降低,而ISP提取蛋白凝胶的破断力逐渐降低,漂洗蛋白凝胶和ISP蛋白凝胶获得最高破断力的热处理温度分别是110 ℃和100 ℃。而Zhang Lili等[26]报道漂洗法生产的阿拉斯加狭鳕鱼糜的凝胶强度随着加热温度的升高(100~120 ℃)而逐渐下降,与本实验研究结果不同,其原因可能与不同的鱼种和加热模式有关。阿拉斯加狭鳕生长在低温水域,蛋白质热稳定较差,在高温下易降解;而白鲢生长环境温度较高,蛋白质热稳定性相对较高,因此适宜的最高加热温度相对较高。在加热过程中,有2 种相反的现象(内源性蛋白酶裂解蛋白质和内源性TGase催化肌球蛋白交联)共同影响蛋白凝胶的质地,取决于哪种作用在一定的加热条件中处于主导地位,使凝胶强度被增强或者减弱。本实验中,在高温加热前,鱼肉蛋白先进行低温凝胶化(40 ℃加热60 min),TGase催化反应基本完成,提高加热温度有利于快速通过凝胶劣化区间(55 ℃左右,蛋白酶活力高),增加凝胶强度。但当最终加热温度过高时,肌球蛋白和肌动蛋白分子被热降解,巯基和二硫键发生裂解,离子键和疏水相互作用减弱,凝胶强度下降[14]。随着加热时间的延长,漂洗蛋白凝胶和ISP蛋白凝胶各热处理组的破断力和凹陷深度均逐渐降低,这与Zhang Lili等[26]的研究一致。张莉莉[14]报道在100 ℃加热温度下,直径为30 mm的鱼肠中心温度从15 ℃加热到90 ℃的时间约为20 min。在本实验中,鱼肠的直径为20 mm,其在20 min内中心温度可以达到设定的最高加热温度。因此,与提高加热温度会影响鱼肠的升温速率不同,延长加热时间只会增加鱼肉蛋白的降解程度。
2.2 持水性分析

图2 高温热处理对漂洗蛋白凝胶和ISP蛋白凝胶持水性的影响Fig. 2 Effects of high temperature treatments on the water holding capacity of washed surimi gels and ISP protein gels
如图2所示,漂洗蛋白凝胶的持水性在110 ℃加热30 min时取得最大值,其整体趋势是随着加热时间的延长持水性降低;ISP蛋白凝胶的持水性各组之间无显著性差异;ISP蛋白凝胶的持水性整体上低于漂洗蛋白凝胶。凝胶强度高的蛋白凝胶一般具有均匀致密的三维网络结构,能截留更多的水分。因此,蛋白凝胶的持水性的变化趋势基本与质构特性的变化趋势相一致。
Zhang Lili等[26]报道了在相同加热时间下(10 min),阿拉斯加狭鳕鱼糜凝胶的持水性在加热温度超过115 ℃时开始显著下降,其原因是凝胶网络结构在120 ℃加热时受到一定程度的破坏。陈斌等[27]报道了罗非鱼鱼糜在相同加热温度下(121 ℃),随加热时间的延长持水性显著降低,其原因是高温加热导致疏水基团暴露,原有的网络结构遭到破坏,凝胶的持水性。卢彦宇[28]通过研究发现当加热温度到达120 ℃时,鱼糜凝胶的持水性显著下降,这与形成鱼糜凝胶的肌原纤维蛋白结构在高温情况下被破坏有关。
2.3 色度分析
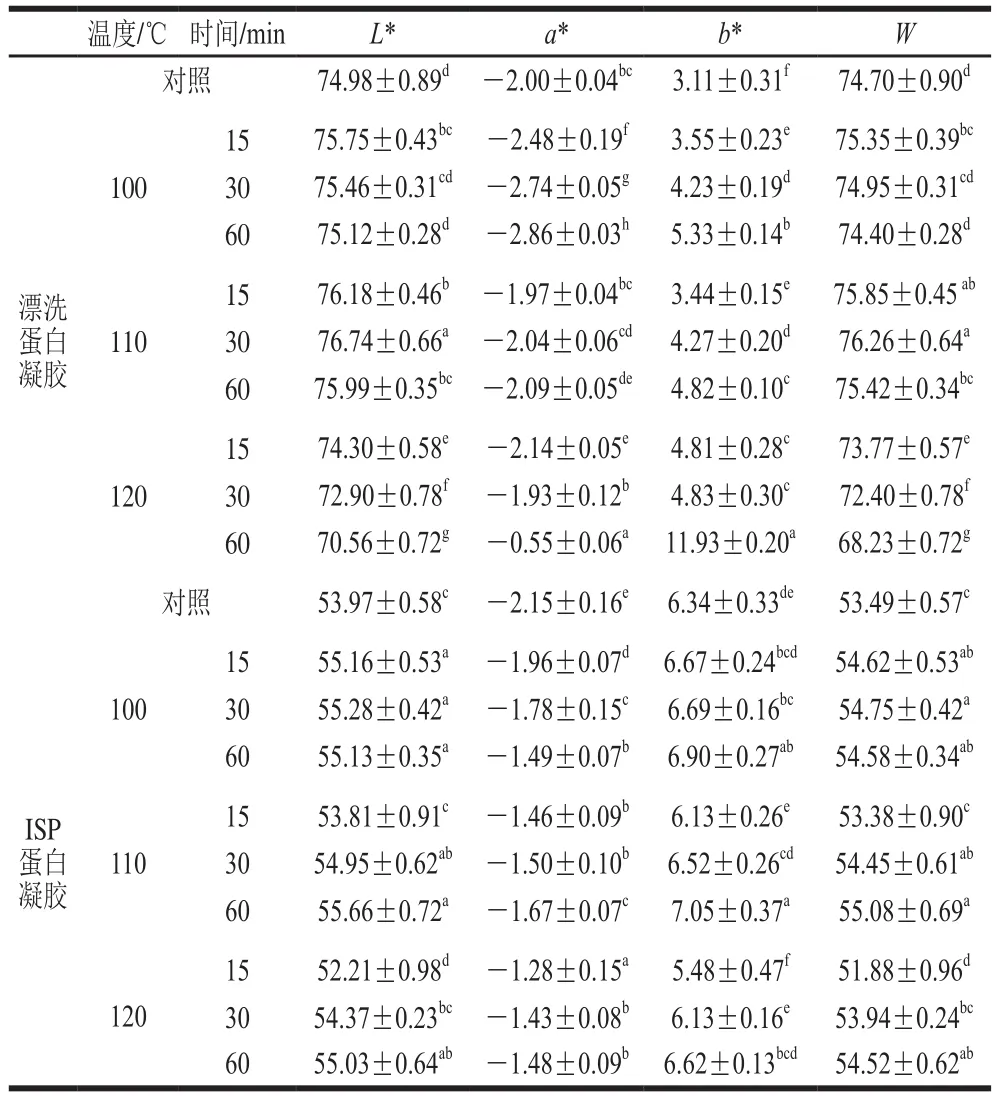
表1 高温热处理对漂洗蛋白凝胶和ISP蛋白凝胶色度的影响Table 1 Effects of high temperature treatments on the color parameters of washed surimi gels and ISP protein gels
如表1所示,漂洗蛋白凝胶的L*值和W值整体上高于ISP蛋白凝胶,a*值和b*值整体上低于ISP蛋白凝胶。随着加热时间的延长,所有热处理组的b*值均呈上升趋势;漂洗蛋白凝胶的L*值和W值呈下降趋势,ISP蛋白凝胶呈相反趋势。漂洗蛋白凝胶100 ℃和110 ℃热处理组的L*值和W值均显著高于对照组,120 ℃热处理组显著低于对照组。除120 ℃加热15 min处理组外,ISP蛋白凝胶的
L*、b*值和W值均显著高于对照组,且在100 ℃热处理组L*值和W值取得最大值。在漂洗过程中色素蛋白(血红蛋白和肌红蛋白)随肌浆蛋白被去除,而在ISP加工过程中,色素蛋白在碱的作用下发生变性和氧化[29],与鱼蛋白结合在一起,使ISP提取蛋白呈现相对较高的a*值和b*值。L*值表示为从凝胶表面反射的总能量的高低,与凝胶的网络结构有关,凝胶结构越均一致密,L*值越高。ISP提取蛋白在加热过程中可能形成了簇状的蛋白质聚集体,漂洗鱼糜蛋白在加热过程中形成了更均一的凝胶结构,因此漂洗蛋白凝胶的L*值更高。凝胶的W值与L*值呈正相关,因此漂洗蛋白凝胶的W值也相对较高。高温热处理通过影响凝胶中水分子的重新排列,而影响凝胶的折光性和透明度[15]。高温使蛋白质氧化,因此凝胶的b*会随着加热时间的延长而增加;同时高温使色素蛋白发生热降低而褪色,因此a*逐渐降低。
2.4 化学作用力分析
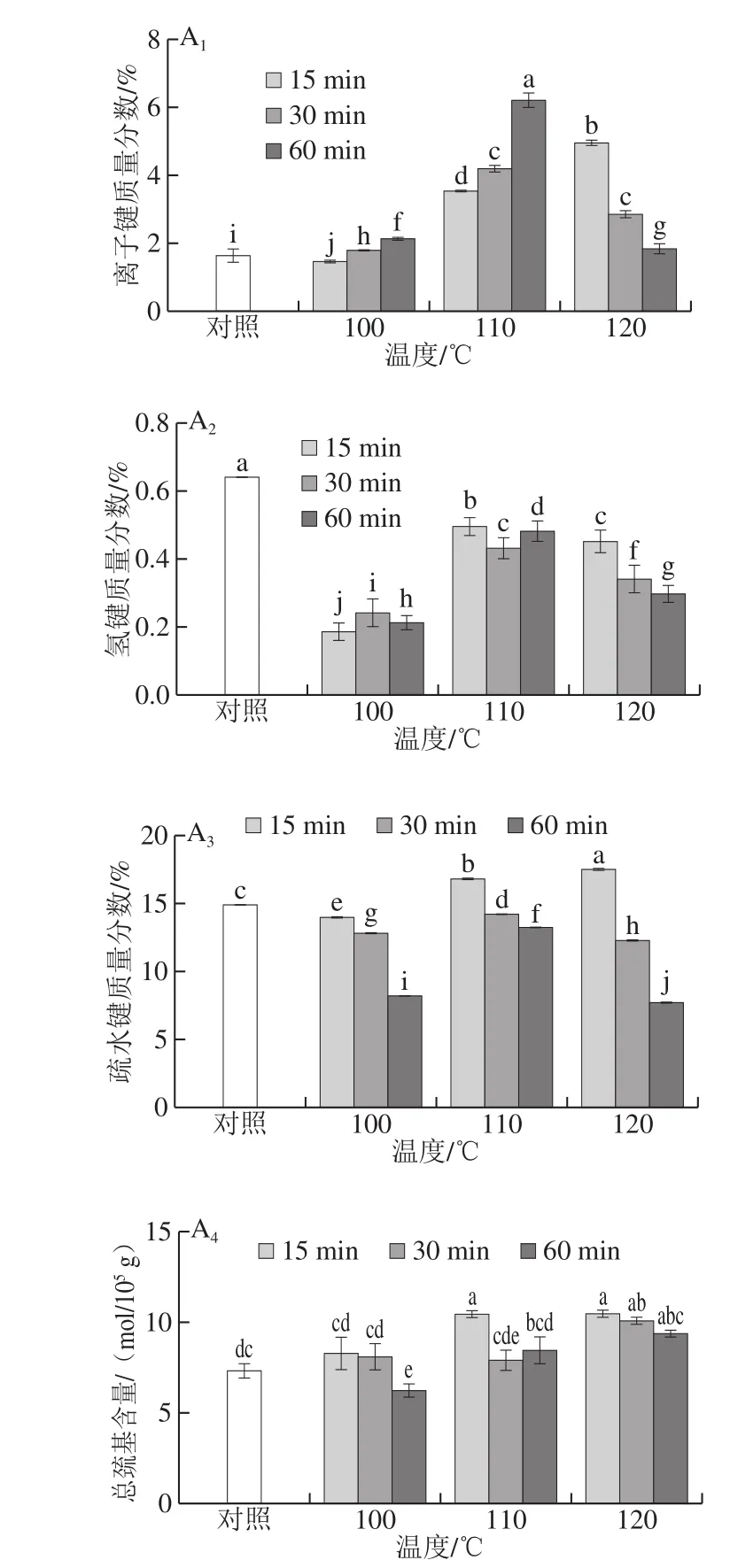

图3 高温热处理对漂洗蛋白凝胶和ISP蛋白凝胶化学作用力的影响Fig. 3 Effects of high temperature treatments on the chemical bond content of washed surimi gels and ISP protein gels
如图3所示,在不同热处理条件下,ISP蛋白凝胶的离子键质量分数低于漂洗蛋白凝胶,但2 种蛋白凝胶离子键的变化趋势相同。在100 ℃和110 ℃条件下,2 种蛋白凝胶的离子键质量分数随着加热时间的延长而增加。而在120 ℃加热温度下,离子键质量分数随着加热时间的延长而降低。漂洗蛋白凝胶的离子键在110 ℃加热60 min处理组取得最大值,ISP蛋白凝胶的离子键质量分数在120 ℃加热15 min处理组取得最大值,与对照组相比均显著上升。ISP蛋白氢键与其离子键的变化趋势一致。漂洗蛋白凝胶的氢键质量分数在110 ℃加热15 min处理组取得最大值,ISP蛋白凝胶的氢键质量分数在120 ℃加热15 min处理组取得最大值,和对照组相比漂洗蛋白凝胶的氢键质量分数显著下降。漂洗蛋白凝胶的疏水相互作用和总巯基含量随加热时间的延长呈下降趋势,ISP蛋白凝胶的疏水相互作用和总巯基含量随加热温度和时间的增加呈下降趋势。离子键、氢键、疏水键和二硫键是维持蛋白凝胶的主要化学作用力。在鱼肉蛋白斩拌过程中,盐的加入使肌原纤维蛋白溶解,水合作用增强,离子键和氢键含量升高。在加热过程中,肌球蛋白结构展开,其内部疏水基团暴露出来,在疏水相互作用下蛋白质发生聚集。一般认为凝胶中巯基含量降低是因为巯基氧化形成了二硫键,因此用总巯基含量的变化表征二硫键的含量[30]。本实验中,漂洗蛋白凝胶的离子键、氢键和疏水键质量分数都在110 ℃热处理组取得较大值,而在120 ℃热处理组随着加热时间延长而显著降低,其趋势与凝胶强度的结果一致。ISP蛋白凝胶的离子键和氢键的变化趋势与漂洗蛋白凝胶类似,而疏水相互作用和总巯基含量在100 ℃热处理组取得最大值,与凝胶强度的结果一致。张莉莉[14]认为在加热过程中疏水相互作用的减弱和二硫键含量的增高表明蛋白质的三维网络结构中分子间侧链之间的缔和减少,而分子链内部的聚合增多,但其推测有待进一步证实。
2.5 SDS-PAGE分析

图4 高温热处理对漂洗蛋白凝胶和ISP蛋白凝胶蛋白质模式的影响Fig. 4 Effects of high temperature treatments on the protein pattern of washed surimi gels and ISP protein gels
漂洗蛋白凝胶(图4A)和ISP提取蛋白(图4B)的主要蛋白条带是肌球蛋白重链(myosin heavy chain,MHC)、肌动蛋白(actin,AC)和原肌球蛋白(tropomyosin,TM);与漂洗蛋白凝胶相比,ISP提取蛋白在45~70 kDa和25 kDa附近出现蛋白条带。在高温的作用下,各热处理组的MHC完全消失,AC、TM、肌钙蛋白(troponin,TN)、肌球蛋白轻链(myosin light chain,MLC)和溶解酵素(lysozyme,LYS)蛋白条带强度逐渐降低,位于10~25 kDa和50~100 kDa的蛋白条带强度逐渐增加,其结果与张莉莉[14]的报道一致。
肌球蛋白、AC、TM和TN同属肌原纤维蛋白。TM是细肌丝中与AC的结合蛋白,TN和TM共同调节AC和肌球蛋白的相互作用。漂洗造成鱼肉蛋白水溶性肌浆蛋白损失,而ISP提取蛋白质的组成与鱼肉的蛋白质组成基本相似。高温使MHC和AC等发生热降解而生成小分子质量的蛋白和寡肽,并且随着加热温度的升高和加热时间的延长,降解现象逐渐明显。MHC和AC在高温下降解是造成凝胶强度下降的主要原因。
3 结 论
经过低温凝胶化(40 ℃水浴加热60 min)的白鲢ISP提取蛋白质与漂洗鱼糜蛋白在不同高温(100、110、120 ℃)下加热不同时间(15、30、60 min),在高温加热过程中,漂洗蛋白凝胶的破断力随着温度的升高先增加后降低,而ISP提取蛋白凝胶的破断力逐渐降低。漂洗蛋白凝胶的持水性随着加热时间的延长而降低,并在110 ℃加热30 min时取得最大值;ISP蛋白凝胶的持水性各组之间无显著性差异。漂洗蛋白凝胶的L*和W随加热时间的延长而下降,ISP蛋白凝胶则呈相反趋势,同时所有热处理组的b*均呈上升趋势。漂洗蛋白凝胶的离子键在110 ℃加热60 min处理组取得最大值,ISP蛋白凝胶的离子键在120 ℃加热15 min处理组取得最大值,和对照组相比均显著上升。漂洗蛋白凝胶的氢键在110 ℃加热15 min处理组取得最大值,ISP蛋白凝胶的氢键在120 ℃加热15 min处理组取得最大值,与对照组相比漂洗蛋白凝胶的氢键显著下降。漂洗蛋白凝胶的疏水相互作用和总巯基含量随加热时间的延长呈下降趋势,ISP蛋白凝胶的疏水相互作用和总巯基含量随加热温度和时间的增加呈下降趋势。漂洗蛋白凝胶和ISP提取蛋白的主要蛋白条带是MHC、AC和TM;在高温的作用下,各热处理组的MHC完全消失,AC、TM、TN、MLC和LYS蛋白条带强度逐渐降低,位于10~25 kDa和50~100 kDa的蛋白条带强度逐渐增加。ISP提取蛋白凝胶的破断力、持水性、L*值、W值、离子键含量均显著低于漂洗蛋白凝胶,同时ISP提取蛋白在45~70 kDa和25 kDa附近出现蛋白条带。ISP提取蛋白和漂洗鱼糜蛋白以上特性的差异与2 种蛋白质的组成和蛋白结构显著相关。ISP提取蛋白在加工过程中,蛋白质结构在酸碱的作用下部分展开,内部疏水基团暴露,使其凝胶特性降低,后期可通过添加合适的外源性添加物来加强其胶凝特性,从而进一步开发常温即食ISP提取蛋白凝胶制品。

