荞麦蜂花粉破壁扫描电子显微镜分析及黄酮模拟消化释放
沈志燕,高云涛*,张海芬,蒋琼芳,熊华斌
(云南民族大学化学与环境学院,云南省跨境民族地区生物质资源清洁利用国际联合研究中心,生物基材料绿色制备技术国家地方联合工程研究中心,云南 昆明 650500)
蜂花粉是工蜂采集花粉,用唾液和花蜜混合后形成的物质[1],因其含有丰富的黄酮类化合物、氨基酸、不饱和脂肪酸和多糖等营养物质,被称为天然的“微型营养库”[2-4]。在诸多蜂花粉中,荞麦蜂花粉具有消炎、治疗和预防前列腺疾病等功能[5-7]。黄酮是荞麦蜂花粉的主要活性成分,研究表明蜂花粉黄酮具有抗氧化、降糖、降脂等生物活性[8-12],但由于花粉细胞外部有一层以孢粉素为主要成分的外壁,壁厚且具有耐温、耐压、耐酸、耐碱以及良好的抗胃酸和消化道酶特性,其中的有效成分难以被人体消化系统吸收利用[13-15]。阮征等[16]研究证实,破壁蜂花粉提取的总黄酮量较未破壁有明显增加。
体外消化具有简单、快速、成本低等优点,可用于替代体内消化实验而被广泛应用[17-18]。
目前花粉破壁过程研究及破壁率计算通常以光镜观察为主,扫描电子显微镜(scanning electron microscopy,SEM)分辨率远高于光学显微镜,有更大的景深和视野,在花粉微观形态研究中展现了良好的应用前景。因此,本实验拟建立蜂花粉破壁率的SEM测定方法,并利用体外消化模型测定了破壁对黄酮类化合物释放的影响,探讨破壁率与模拟胃肠液中黄酮类化合物释放关联关系,旨在建立1 种SEM和体外消化模型联合研究方法,为蜂花粉破壁的深入研究及蜂花粉开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
荞麦蜂花粉 山西忻州五台山蜂业有限公司蜂业基地;胃蛋白酶、胰蛋白酶 北京索莱宝科技有限公司;芦丁标准品 天津市一方科技有限公司;磷酸二氢钾、硝酸铝、亚硝酸钠等其他试剂均为国产分析纯。
1.2 仪器与设备
NOVA NANOSEM-450型场发射SEM 美国FEI公司;TU-1950型紫外-可见分光光度计 北京普析通用仪器有限责任公司;SJIA-2012聚能式超声波细胞粉碎机(工作频率:19~21 kHz,功率50~1 500 W可调)、变幅杆超声换能器(钛合金变幅杆+Φ20长钛合金圆柱状工具头(直径29.4 mm、高71.9 mm));DC-2006循环式低温恒温槽(温度控制-20~100 ℃,冷阱容量50~600 mL,冷媒:乙醇) 宁波市鄞州双嘉仪器有限公司。
1.3 方法
1.3.1 聚能超声破壁
称取1.00 g研磨均匀的荞麦蜂花粉样品,放于100 mL烧杯中,加入一定量的蒸馏水,置于低温恒温槽外置冷阱中,冷阱中加入乙醇,设定烧杯中样品的初始温度,将变幅杆超声换能器与超声波细胞粉碎机连接,工具头置入烧杯样品中,采用脉冲处理方式,固定其他条件,设置超声功率(100、200、300、400、500 W)、超声时间(10、20、30、40、50 min)、通断比(1∶1、1∶2、1∶3、1∶4、2∶1、2∶2、2∶3、2∶4)和初始温度(0、5、10、15 ℃)进行超声破壁处理,制得破壁蜂花粉溶液。
1.3.2 SEM分析
将2 μL超声分散后的破壁花粉溶液滴加点在抛光单晶硅片上,60 ℃干燥,用双面胶将该硅片固定于SEM载物台,用离子溅射仪对破壁花粉样品进行喷金处理,喷镀电流10 mA,喷镀2 次,每次50 s,用SEM观察制备样品的表面形貌。
1.3.3 体外肠胃消化模拟
参照文献[19-20]方法,将1.0 g胃蛋白酶溶解于50.0 mL蒸馏水中,加入1.65 mL 10% HCl溶液,定容至100.0 mL,制得人工胃液。
称取0.68 g磷酸二氢钾溶于50.0 mL蒸馏水,用0.1 mol/L NaOH溶液调节pH 6.8,加入1.0 g胰蛋白酶,定容至100.0 mL,制得人工肠液。
取一定量破壁蜂花粉溶液,用1.0 mol/L的HCl溶液调节pH 2.0,加入20.0 mL人工胃液,于恒温水浴摇床中37 ℃振摇70 min,消化结束后,取消化液4 000 r/min离心10 min,分离上清液,用NaOH调节pH 8.0,一份-20 ℃条件下保存待分析,另一份继续进行肠液消化。
取上述胃消化液,用1.0 mol/L的NaOH溶液调节pH 8.0,加20.0 mL的人工肠液,于恒温水浴摇床中37 ℃继续模拟消化2 h,4 000 r/min离心10 min,分离获得上清液,-20 ℃保存备用。
1.3.4 样品总黄酮释放量和胃肠消化液吸收率测定
灭酶胃肠消化液中黄酮含量测定采用NaNO2-Al(NO3)3比色法[21-22]。以芦丁为标准品,黄酮含量以每克蜂花粉中所含芦丁当量表示,单位为mg/g,根据灭酶胃肠消化液中黄酮含量计算破壁蜂花粉黄酮释放量,如式(1)所示:
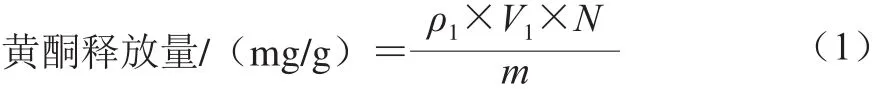
式中:ρ1为灭酶胃肠消化液中总黄酮质量浓度/(mg/mL);V1为灭酶胃肠消化液总体积/mL;N为稀释倍数;m为荞麦蜂花粉样品质量/g。
破壁蜂花粉黄酮释放率按式(2)计算:

式中:W1为胃肠液中黄酮的释放量/(mg/g);W2为原蜂花粉中黄酮含量/(mg/g)。
1.3.5 正交试验
在单因素试验的基础上选取超声时间(A)、超声功率(B)、通断比(C)和料液比(D)4 个因素,设置3 个水平,以蜂花粉破壁率为考察指标,设计L9(34)正交试验优化荞麦蜂花粉破壁工艺条件。因素与水平见表1。
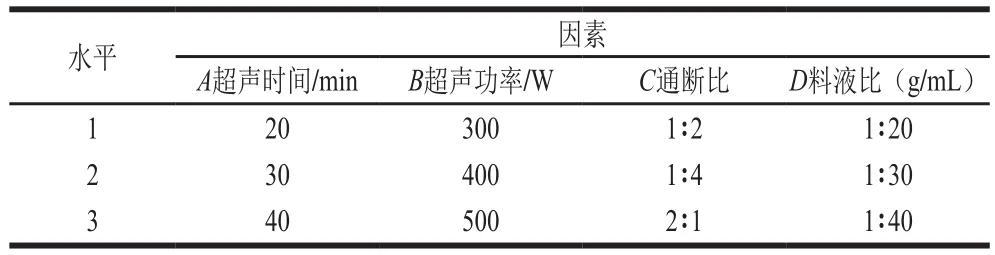
表1 正交试验因素与水平Table 1 Factors and levels used in orthogonal array design
1.4 数据分析
采用Origin 8.5软件进行相关曲线拟合,得出线性方程及相关系数;通过Excel 2010软件计算实验结果以表示。
2 结果与分析
2.1 荞麦蜂花粉破壁的SEM及破壁率测定结果
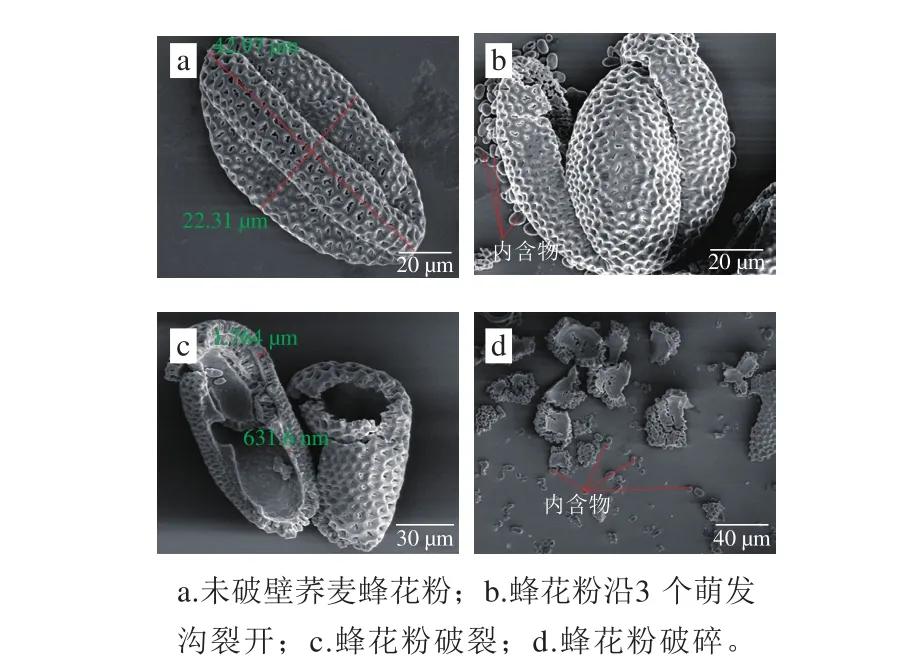
图1 荞麦蜂花粉破壁前后的SEM图Fig. 1 SEM images of buckwheat bee pollen before and after wall breakdown
从图1a可看出,荞麦蜂花粉呈长椭球形,极轴方向分布有3 条萌发沟,萌发沟细长直达两极,花粉粒外壁纹饰由呈网状网脊与穴(或沟)构成三维结构,网穴具有沟状孔。测量20 个荞麦蜂花粉粒极轴长度(P)和赤道轴长度(E),计算其平均值,结果P为42.97 μm,E为22.31 μm,形态指数P/E反映了花粉的形状,P/E越趋近于1,花粉越趋向于球形,P/E在1.2~1.6为椭球形,P/E高于1.6为长椭球形,荞麦蜂花粉P/E为1.93(相对标准偏差(relative standard deviation,RSD)为1.24%),说明其荞麦花粉为典型长椭球形形态,长椭球形形态是虫媒花粉的特征[23]。
从图1b~d可知,通过低温聚能超声破壁处理,荞麦蜂花粉的破壁经历了3 个过程:一是开裂,在外加聚能超声作用下,花粉沿3 个萌发沟裂开(图1b);二是破裂,花粉继续沿裂开的位置破裂成两个部分(图1c),最后是破碎,在聚能超声进一步作用下,花粉破碎成若干碎片(图1d)。从破壁后的蜂花粉(图1b、c)可看出,荞麦蜂花粉细胞具有由孢粉素、纤维素等致密物质构成[24],外壁质地坚固,但3 条萌发沟是其外壁结构的薄弱点。结合图1b~d,提出花粉的聚能超声破壁机理是在聚能超声变幅杆工具头空化作用下,反应器液体中的气泡急剧崩溃产生强大冲击力,导致花粉从结构薄弱的萌发沟开裂、进而破裂和破碎的过程。
破壁率是评价花粉破壁效果的关键指标,光镜视野中破壁笼统指花粉细胞破碎过程。但从SEM结果可知,在聚能超声作用下,蜂花粉细胞经过开裂、破裂和破碎3 个阶段,从图1b可以看出,在开裂阶段,花粉部分内含物质开始从裂口处向外溢出,肠胃消化液已可以通过破裂口进入花粉细胞内,吸收利用其内含有效成分,破裂和破碎阶段(图1c和图1d),花粉内物质已几乎完全从蜂花粉残留块释放,因此,从人体肠胃系统利用角度看,开裂的花粉细胞可视为已经破壁。

图2 样品SEM图Fig. 2 SEM images of samples
从图2可看出,在不同的破壁处理条件下,破壁率不同,但每个视野中花粉细胞均出现如图1的4 种形态,未破壁和沿萌发沟开裂的仍然保留荞麦蜂花粉完整的3 瓣式结构,沿萌发沟破裂保留有2 瓣式结构,破碎通常保留完整的1 瓣或或少于1 瓣多个碎片结构。依据前述,视开裂的花粉细胞为已破壁,对于1 个视野,则:
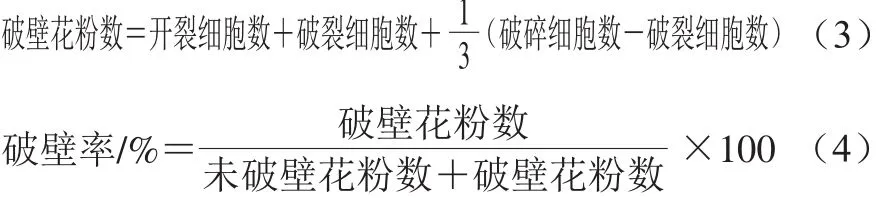
为保证测定结果的准确可靠,破壁率的计算应选取多于5 个视野的平均结果,并计算RSD。
SEM的分辨率(低于1 nm)远高于光学显微镜的分辨率(约200 nm),可观察花粉细胞的亚显微结构[25-27]。同时,SEM的景深较光学显微镜大几百倍,视野更大,成像富有立体感,可更好观察花粉细胞表面的细微结构,获得更多破壁过程的微观信息,更深入地认识花粉破壁机理。针对SEM视野中破壁蜂花粉细胞呈现的多种形态,本实验亦提出了更加精准的破壁率计算方法。
2.2 初始温度对破壁率的影响
蜂花粉具有异常坚韧抗化学腐蚀的细胞外壁[28],为释放其黄酮等活性成分,并更好观察内部结构。采用变幅杆聚能超声破壁的方式,超声能量集中在较小的面积,为避免聚能超声导致体系高温对黄酮等热敏物质的破坏,采取低初始温度及脉冲式超声作用方式。首先研究了初始温度对破壁的影响,结果见图3,较低温度有利于花粉破壁,初始温度的升高可导致花粉破壁率呈线性下降,变化幅度约为-1%/℃,原因在于低温可使蜂花粉细胞壁变脆,有利于破壁[29],反之,较高温度可使花粉细胞壁弹性和韧性增加[30]。考虑到温度降低至0 ℃以下,可致体系结冰不利于操作,选择初始温度为0 ℃。
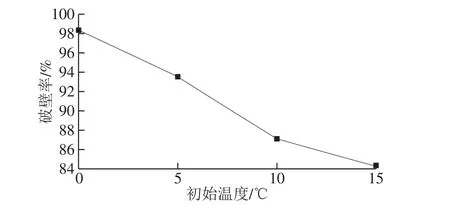
图3 初始温度对破壁率的影响Fig. 3 Effects of initial temperatures on wall breakdown
2.3 超声条件对破壁率的影响
基于上述研究,固定其他条件,改变超声功率,破壁率随着超声功率增加而增加,400 W时破壁率达到最大,但超声功率超过400 W时,破壁率反而降低,可能的原因是超声功率过大体系升温速率较快使花粉细胞壁弹性和韧性增加不利于破壁,选择超声功率为400 W。在前述选择条件下,进一步研究超声作用时间对破壁率的影响,随着超声作用时间延长,破壁率逐渐增大,但因为聚能超声作用方式可导致体系升温速率过快,终点温度较高,对释放的黄酮存在一定破坏作用,因此超声时间应该控制在50 min之内。
当超声功率400 W、样品量1.00 g、料液比1∶30(g/mL)、施加功率相当于400 W/g(以样品质量计)、超声时间30 min,进一步研究超声脉冲方式的影响,脉冲作用大于2 s,样品溶液升温较快,而脉冲作用为1 s,当通断比≤1∶4(脉冲作用1 s,休止4 s)时,破壁率低于70%,尚不能获得最佳破壁效果,当通断比为1∶2(脉冲作用1 s,休止2 s)时,破壁率已大于85.91%接近最佳,且终点温度较低,当通断比大于2∶3时,破壁率虽大,但终点温度明显较高,因此,选择脉冲作用1 s,通断比为1∶2。
2.4 正交试验结果

表2 正交试验设计及结果Table 2 Orthogonal array design with experimental results
由表2可知,4 个因素影响主次顺序依次为:C>B>A>D,即通断比>超声功率>超声时间>料液比。正交试验结果显示荞麦蜂花粉破壁的最佳条件为A2B2C3D2,该条件下终点温度较高,对释放的黄酮有一定破坏作用,因此,选择蜂花粉破壁的最佳条件为A2B2C1D2,即初始温度0 ℃、超声功率400 W、脉冲通断比1∶2、超声时间30 min、料液比1∶30(g/mL),在此条件下,蜂花粉破壁率达到(98.33±4.02)%。
2.5 不同条件荞麦蜂花粉破壁及黄酮在模拟肠胃液中的吸收

图4 不同条件荞麦蜂花粉破壁SEM图Fig. 4 SEM images showing different degrees of wall disruption of buckwheat bee pollen
在单因素及正交试验研究的基础上,通过控制初始温度,选取强度不同的破壁条件(表3)(破壁率由低到高)对荞麦蜂花粉破壁处理,破壁条件由弱至强分别为a<b<c<d,随着破壁强度增加,蜂花粉破裂程度依次增强,结果见图4。在低倍率500 倍进行SEM分析,计算5 个视野下的破壁率,结果见表3,在4 个不同强度的破壁条件下考察破壁率与蜂花粉黄酮在模拟肠胃液中释放量的关联关系,从表3可以看出,随着破壁率的增加,黄酮在模拟肠胃液中的释放量依次增加,表明蜂花粉破壁更有利于花粉中营养物质的释放,且不同强度的破壁率所对应的RSD均在5%以内,精密度较好。

表3 破壁率测定结果及黄酮在模拟肠胃液中的释放量(n=5)Table 3 Wall disruption rate and amount of flavonoids released when incubated in simulated gastrointestinal fluid (n= 5)
在表3基础上,根据式(2),进一步计算上述破壁条件下模拟肠液和模拟胃液对破壁荞麦蜂花粉中黄酮的释放率,不同破壁条件下模拟肠液和模拟胃液的释放率与破壁率的关系见图5,不同的破壁条件下,蜂花粉中黄酮的释放率不同,随着破壁率的增加,花粉中黄酮在模拟肠液和模拟胃液中的释放率和总释放率依次增加,破壁率与模拟肠液和模拟胃液中的释放率和总释放率具有很好的线性关系,破壁率与总释放率线性方程为y=0.363 8x+27.172,R2=0.999 7,表明破壁能有效促进蜂花粉细胞内营养成分在肠胃液中的释放。

图5 破壁率与黄酮释放率的线性关系Fig. 5 Linear correlation between wall disruption rate and flavonoids release rate
3 结 论
本实验采用SEM法研究荞麦蜂花粉低温聚能超声破壁微观过程,提出聚能超声变幅杆工具头空化作用产生的冲击力,使荞麦蜂花粉结构薄弱的萌发沟开裂、进而破裂和破碎的破壁机理;从结果可知,相对于传统的光镜,SEM分辨率高,能清晰观察物体的表面结构,立体感强、图像直观,可获得更多花粉破壁过程的微观信息,有助于对花粉破壁机理进行更深入的研究。针对破壁过程蜂花粉细胞呈现的开裂、破裂和破碎等多种微观形态导致破壁率难以准确计算的问题,提出SEM视野中破壁蜂花粉复杂微观形态下的破壁率计算方法,使破壁率计算结果更加精准(RSD<5%,n=5);由单因素及正交试验优化得到破壁最佳条件,发现较低初始温度有利于花粉破壁,破壁率与蜂花粉细胞内黄酮在模拟肠胃液中的释放量具有较明显的关联关系,破壁有效促进了蜂花粉中营养物质的释放。本实验对研究花粉破壁提出了一种新颖的思路,具有较好的应用前景。

