芍药苷对巨噬细胞炎症因子表达的影响
刘子菁 张嘉文 姜沛彧 尹 智 刘韵祎刘乙萱 王小燕 刘文涛 许 阳
1南京医科大学第一附属医院皮肤科,南京,210029;2南京医科大学基础医学院药理学,南京,211100
玫瑰痤疮是一种慢性炎症性皮肤病,世界范围内各国报道发病率不一,总体在2%~22%。其典型临床表现为面中部阵发性潮红、持久性红斑、毛细血管扩张、丘疹、脓疱、水肿、增生肥大等不同表型的组合,影响患者日常生活及社交[1]。目前认为玫瑰痤疮发病机制与遗传、微生物感染、神经血管失调、免疫系统失衡等有关。近来,越来越多研究着重于探讨玫瑰痤疮中的天然免疫,有研究发现玫瑰痤疮皮损中存在大量天然免疫细胞浸润,包括巨噬细胞、肥大细胞和中性粒细胞[2]。其中不同研究提示玫瑰痤疮皮损处巨噬细胞显著增多,与玫瑰痤疮炎症反应密切相关[3-5]。芍药苷(paeoniflorin,PF)是一种具有抗炎作用的中药成分,其对于巨噬细胞的炎症反应的作用提示其是否可能为玫瑰痤疮潜在的治疗药物选择。
本研究拟通过组织病理及免疫组化探讨玫瑰痤疮中巨噬细胞相关炎症分子表达,并在细胞水平初步探讨芍药苷对于脂多糖诱导的巨噬细胞炎症反应的影响。
1 材料与方法
1.1 组织、细胞及试剂 9例玫瑰痤疮皮肤组织来源于南京医科大学第一附属医院皮肤科经临床及组织学诊断为肉芽肿型玫瑰痤疮患者皮肤活检标本。巨噬细胞为小鼠单核细胞系Raw 264.7细胞(ATCC号:TIB-71)。DMEM高糖培养基购自美国ThermoFisher Scientific公司,10%胎牛血清购自美国Gibco公司;芍药苷购自MCE公司;LPS购自sigma公司;CCK8试剂盒购自上海东仁化学科技有限公司;兔抗鼠SOCS3、p38、ASK1购自美国CST公司,兔抗鼠Tlr2、LL37、CD68、IL-1β购自美国Abcam公司,小鼠单抗β-actin购自Santa Cruz公司。HiScript II Select qRT SuperMix和SYBR Premix Ex TaqII购自南京诺唯赞生物科技有限公司。石蜡包埋机、石蜡切片机购自武汉俊杰电子有限公司,倒置显微镜购自日本尼康公司。
1.2 方法
1.2.1 组织病理学及免疫组化染色 皮肤组织标本经甲醛固定、石蜡包埋、切片、脱蜡后行HE 染色,光学显微镜下观察形态学特征并采集图像。另取空白切片采用CD68、SOCS3、LL37和IL-1β行免疫组化染色(1∶1000稀释),光学显微镜下采集图片并分析皮损及非皮损区域阳性染色区域差异。
1.2.2 巨噬细胞及分组 将2×105Raw 264.7细胞在含10%胎牛血清无钙DMEM培养基于37℃和5%CO2培养箱中培养至细胞融合度达70%时进行下一步实验。将不同浓度(10-9~10-2mol/L)PF加入Raw 264.7细胞培养基后16 h检测细胞增殖活性,筛选出不影响巨噬细胞增殖的合适PF实验浓度。此后Raw 264.7细胞分为三组,包括对照组、LPS诱导组(培养基中加入1μg/mL LPS,即为LPS组)以及干预诱导组(预先加入10-5mol/L PF培养4 h后,再加入1μg/mL LPS,即PF+LPS组),继续培养Raw 264.7细胞12h以上进行后续实验。
1.2.3 巨噬细胞形态学检测及增殖活性测定 在倒置显微镜下观察对照组、LPS组以及PF+LPS组细胞形态学改变并采集图片。细胞增殖活性采用CCK-8试剂盒按说明进行操作测定。
1.2.4 qRT-PCR检测炎症因子基因表达 引物序列如表1所示,具体采用△Ct 法进行数据分析,以Actin为内参对照,计算三组Raw 264.7细胞中Camp、Tlr2和p38炎症因子基因相对表达量。
1.2.5 Western Blot检测炎症因子蛋白表达 提取对照组、LPS组以及PF+LPS组Raw 264.7细胞蛋白后经Western blot分别检测SOCS3、p38、ASK1、Tlr2(1∶1000稀释)蛋白表达,提取上清蛋白检测LL37(1∶1000稀释)蛋白表达,β-actin为对照。
1.2.6 统计学方法 免疫组化图像根据阳性细胞数×染色强度,进行IRS评分分析[6]。Western Blot蛋白条带采用imageJ软件分析灰度,采用SPSS17.0统计软件进行统计分析,计量资料的两组间比较采用t检验,多组间比较采用方差齐性检验及单因素方差分析 (ANOVA),所有分析均采用双侧检验,P<0.05为有统计学差异。

表1 RAW细胞引物序列表
2 结果
2.1 玫瑰痤疮组织标本中巨噬细胞及炎症因子 皮肤组织经HE染色镜下可见真皮内大量炎症细胞浸润,多为淋巴细胞,另可见结节样分布的上皮样细胞肉芽肿(图1)。CD68免疫组化染色可见皮损区大量棕色颗粒,较皮损周边区域显著增强,提示玫瑰痤疮皮损区有大量巨噬细胞浸润,另皮损区LL37、IL-1β和SOCS3表达较周边增强,即提示玫瑰痤疮皮损区域炎症因子中LL37、IL-1β和SOCS3表达增高,且较周边非皮损区存在统计学差异(图2)。
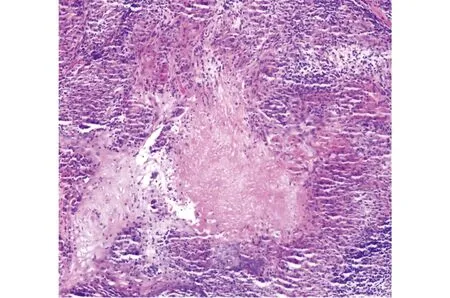
图1真皮内大量炎症细胞浸润,多为淋巴细胞,另可见结节样分布的上皮样细胞肉芽肿(HE,×100)
2.2 PF对LPS诱导巨噬细胞活化及合成炎症因子的影响
2.2.1 无细胞毒性PF实验浓度的筛选 不同组Raw 264.7细胞培养基中加入10-9~10-2mol/L 不同浓度PF后培养16 h检测细胞增殖活性,发现与10-2mol/L及10-3mol/L PF共同培养的Raw 264.7细胞增殖活性较空白对照组细胞显著下降(P<0.05),而不高于10-5mol/L PF则对Raw 264.7细胞增殖活性无显著影响(图3)。

图2玫瑰痤疮皮损组织免疫组化染色 a~c,d~f,g~i,j~k分别为CD68,LL37,IL-1β和SOCS3免疫组化染色及其对应的阳性染色率IRS定量分析图,N=9,*P<0.05(a,d,g,j:×100;b,e,h,k:×400)
2.2.2 PF对LPS诱导巨噬细胞活化的影响 倒置显微镜下正常Raw 264.7细胞呈大小均一的圆或类圆形,无明显树突状反应,LPS诱导后的Raw 264.7细胞则出现胞体增大,细胞周边伪足伸出,细胞形状变不规则而呈树突状改变。而LPS+PF组中Raw 264.7细胞镜下可见树突状改变细胞比例较LPS组明显减少,仍多呈圆或类圆形细胞(图4)。
2.2.3 PF可抑制LPS诱导的巨噬细胞合成LL37 培养基中加入1μg/mL LPS的Raw 264.7细胞培养12 h后qRT-PCR结果提示LL37基因camp mRNA表达较对照组明显增高,而10-5mol/L芍药苷处理组Raw 264.7细胞加入LPS后LL37基因camp mRNA表达较对照组增高,较LPS组下降(P<0.05)。Western Blot检测细胞上清液LL37蛋白结果趋势与之类似(图5)。
图3不同浓度PF对Raw 264.7细胞增殖的影响(N=3,与对照组比,10-2mol/L及10-3mol/L PF预处理组细胞增殖存在统计学差异,*P<0.05)
2.2.4 PF对LPS诱导的巨噬细胞炎症因子的影响 培养基中加入1μg/mL LPS的Raw 264.7细胞培养12 h后qRT-PCR结果提示Tlr2和p38表达较对照组明显增高,而PF预处理则可缓和这一改变,PF+LPS组Tlr2和p38基因表达较对照组增高,而较LPS组为低。Western Blot检测对照组、LPS组和 PF+LPS组胞内蛋白,结果趋势与mRNA结果类似,LPS组Raw 264.7细胞ASK1、TLR2和p38表达增加,SOCS3表达降低,而PF的预处理则可缓和LPS诱导的炎症因子改变,PF可抑制LPS诱导的Raw 264.7细胞的ASK1、TLR2和p38表达增加及SOCS3表达降低(P<0.05),见图6。
3 讨论
玫瑰痤疮是临床常见慢性炎症性皮肤病,依据典型表现,玫瑰痤疮常分为四种临床亚型,包括红斑毛细血管扩张型(erythematotelangiectatic rosacea,ETR)、丘疹脓疱型(papulopustular rosacea,PPR)、肥大增生型(phymatous rosacea,PhR)和眼型(ocular rosacea,OR),但由于亚型间存在症状重叠并可相互转化,故近年来逐步采用表型描述取代了临床分型[7]。
玫瑰痤疮具体发病机制仍不清楚,可能是在一定遗传背景基础上,多因素诱导的以天然免疫和血管舒缩功能异常为主导的慢性炎症性疾病。有文献认为玫瑰痤疮与天然免疫细胞包括巨噬细胞、肥大细胞和中性粒细胞密切相关[2],而其中巨噬细胞是重要的免疫调节细胞。

图4不同组Raw 264.7细胞显微镜下形态 a:对照组,×400;b:LPS组,×400;c:LPS+PF组,×400

图5 PF可抑制LPS诱导巨噬细胞合成camp基因和LL37蛋白(N=3,与对照组相比,*P<0.05,与LPS组相比,# P<0.05)
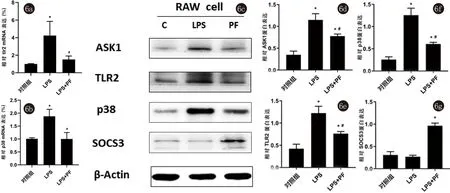
图66a~6g:PF可抑制LPS诱导巨噬细胞合成Tlr2和p38基因,并抑制LPS诱导的巨噬细胞ASK1、TLR2和p38表达增加及SOCS3表达降低(N=3,与对照组相比,*P<0.05;与LPS组相比,#P<0.05)
Buhl等[3]发现ETR、PPR及PhR三种临床亚型的玫瑰痤疮皮损中均存在显著巨噬细胞和肥大细胞浸润。Smith等[5]同样在20例玫瑰痤疮皮损样本中发现类似的显著巨噬细胞局部浸润,同时伴有血管内皮细胞因子(vascular endothelial growth factor,VEGF)、VEGF受体(vascular endothelial growth factor receptor,VEGFR)1和VEGFR2的高表达。Georgala等[4]研究有类似结果,并推测增多的巨噬细胞可能与局部毛囊蠕形螨过度增殖有关。近有研究证实在玫瑰痤疮患者皮损及LL37诱导的玫瑰痤疮样小鼠模型皮损中解聚素金属蛋白酶家族癸蛋白1(Disintegrin Metalloprotease ADAM-like Decysin-1,ADAMDEC1)均表达增高,且细胞学实验进一步证实ADAMDEC1可通过促进巨噬细胞经典活化而参与玫瑰痤疮炎症反应[8]。经典活化的巨噬细胞可由LPS或Th1细胞因子等诱导,进而分泌大量促炎因子和趋化因子包括白介素-1β(interleukin-1β,IL-1β)、IL-6、IL-12和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)而参与炎症反应[9]。这些结果均提示巨噬细胞的活化与玫瑰痤疮炎症反应密切相关,且抑制巨噬细胞经典活化的分子或成分可能是治疗玫瑰痤疮的潜在药物选择。
人抗菌肽LL37是玫瑰痤疮致病过程中的重要因子,皮内注射LL37是诱导玫瑰痤疮小鼠模型的经典方法[10]。玫瑰痤疮患者皮损处角质形成细胞高表达的TLR2可通过促进KLK5的合成及活性,进而使LL37表达上调[11]。Toll样模式识别受体(Toll-like receptor,TLR)可表达于角质形成细胞、巨噬细胞表面。TLR2识别皮表微生物如表皮葡萄球菌、痤疮丙酸杆菌产物如LPS促发炎症反应,LL37、TNF-α、IL-1β等炎症因子升高,进而诱发玫瑰痤疮相关的血管扩张、增生及炎性皮疹表现。已有研究证实玫瑰痤疮患者皮肤中TLR2和LL37表达明显增高[2]。
我们实验中玫瑰痤疮皮损组织病理提示皮损区显著炎症细胞浸润,免疫组化结果提示巨噬细胞浸润明显,且炎症因子LL37、IL-1β表达显著增高,与此前文献报道结果均相符合。
TLR2介导的p38和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)活化对于链球菌M1蛋白[12]、表皮葡萄球菌LP01脂肽[13]等刺激皮肤后产生的炎症和抗菌反应过程密切相关。p38蛋白激酶是细胞丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)家族中控制炎症反应最重要的成员,可进一步激活与炎症反应相关的蛋白激酶和转录因子。Wladis等[14]发现眼型玫瑰痤疮患者较正常健康人群眼睑皮肤组织活化的p38和ERK表达增高。Yamasaki等[10]研究发现LL37可促进玫瑰痤疮皮肤炎症反应,而抑制p38则可选择性抑制LL37所诱导角质形成细胞合成IL-36γ[15]。细胞凋亡信号调节激酶 1(Apoptosis signal-regulating kinase 1,ASK1)是细胞丝裂原活化蛋白激酶(mitogen-activated protein kinase kinase kinase,MAP3Ks)家族成员之一。活性氧(reactive oxygen species, ROS)可经ASK1进而激活p38诱导巨噬细胞表达人β防御素(humanβ-defensins,hβD)1-3和LL37促进炎症反应[16]。这些结果均提示TLR2、ASK1和p38在抗菌肽介导的玫瑰痤疮皮肤炎症中具有重要作用。
细胞因子信号抑制蛋白3(suppressor of cytokine signaling3, SOCS3)是一种常见的抑制性信号调节蛋白,参与负反馈调节MAPK等多条重要的信号通路。但多种细胞因子如IL-2、INF-γ、IL-6等可反馈性促进SOCS3表达[17,18]。
PF是一种单萜类糖苷化合物,为白芍总苷的主要成分,具有一定抗炎和免疫抑制作用。在银屑病模型小鼠中的研究[19]发现PF可减少银屑病皮损中嗜中性粒细胞和巨噬细胞的浸润,并进而减少相关炎症因子表达。我们的细胞学实验结果发现PF的预处理可缓解LPS诱导的巨噬细胞合成TLR2、ASK1、p38的增高和SOCS3的降低,提示PF可抑制LPS诱导的巨噬细胞炎症反应。而在玫瑰痤疮组织病理中,我们研究发现玫瑰痤疮皮损区较周边区域SOCS3表达明显增高,推测可能因玫瑰痤疮皮损中多种炎症因子增高反馈性促进抑炎因子SOCS3表达有关。
我们的研究进一步验证了玫瑰痤疮皮损中存在大量巨噬细胞浸润,且炎症因子LL37、IL-1β和SOCS3表达增强,并在细胞学水平初步探讨了PF对于LPS诱导的巨噬细胞炎症反应的影响,发现PF的抑制作用通过减缓TLR2、ASK1、p38表达增高和SOCS3表达降低而实现,但实验亦存在一定不足,如能在玫瑰痤疮小鼠模型中进一步验证我们的结果为最佳。
综上所述,玫瑰痤疮与巨噬细胞及炎症因子密切相关。芍药苷通过影响TLR2、SOCS3、ASK1和p38炎症分子的表达可抑制脂多糖诱导的巨噬细胞炎症反应,可能是潜在治疗玫瑰痤疮的药物选择。

