一株鸡源发酵乳杆菌益生菌的分离鉴定
卢冰霞 周英宁 梁家幸 赵硕 蒋冬福 陈忠伟 何颖秦毅斌 李斌 段群棚 刘磊,3 赵武*
(1. 广西兽医研究所/广西兽医生物技术重点实验室,南宁 530001;2. 广西大学动物科学与技术学院,南宁 530005;3. 广西农业职业技术学院,南宁 530007)
抗生素被广泛使用于动物疾病的防治中,然而大量使用会导致药物残留从而威胁人类健康。“生物药物”是替代抗生素的理想选择之一[1]。在动物体内广泛存在的乳酸杆菌可抑制肠致病菌的增殖,参与胃肠道微生态的平衡,调节胃肠道功能[2]。目前已成为养殖业替抗类益生菌制剂中的主要菌株。乳酸菌在我国是34 种可添加于动物饲料中的益生菌[3]。鸡微生态制剂中的乳杆菌可提高鸡免疫力并减少抗生素使用。
由于不同来源的益生菌常因在动物消化道内定殖难而不能发挥其作用[4]。目前来源于鸡的乳酸菌菌种还较少,因此迫切需要开展本动物源益生菌的筛选与研发。本研究从某市场购买健康鸡的肠道中分离获得一株乳酸杆菌,并鉴定了其种属及部分生物学特性,为下一步开发禽用微生态制剂提供安全高效菌种资源和理论支撑。
1 材料与方法
1.1 样品
健康肉鸡和20 g左右实验小鼠分别购自养鸡场及广西医科大实验动物中心。
1.2 主要试剂
MRS(乳酸菌细菌培养基)、LB(溶菌肉汤培养基)、明胶液化,糖醇发酵、蛋白水解用于鉴定细菌生化特性培养基。V-P试剂(2酰甲基甲醇试剂)。
1.3 乳酸菌的分离鉴定
1.3.1 样品采集 健康肉鸡,用2%戊二醛消毒溶液进行体表消毒,割断劲动脉放血致死,无菌操作取出其肠道,使用无菌的PBS小心冲洗黏膜层后,用无菌刀片刮下肠黏膜上皮,置于灭菌三角烧瓶中,加20mL 灭菌MRS 液体培养基混匀,以1000r/min 离心10min,取上清液进行细菌分离。
1.3.2 细菌分离 取1.3.1上清液10倍连续稀释,取各稀释度划线接种MRS平板,每组设3个重复,37℃培养48h。挑单菌落,分别接种LB及MRS平板进行纯培养,24h后挑菌革兰氏染色镜检。
1.3.3 生理生化鉴定 按照《乳酸细菌的分类鉴定与实验方法》及《常用细菌系统鉴定手册》进行初步鉴定。
1.3.4 分子生物学鉴定 按核酸提取试剂盒说明书进行分离菌DNA 提取并PCR 扩增其16SrDNA。引物信息见表1,反应体系见表2,扩增程序见表3。
对PCR 阳性产物序列测定,用Meglin 6.0 对序列进行核苷酸同源性分析,并运用MAGA6.06 进行系统进化树构建,确定分离菌株的种属。

表1 引物信息

表2 PCR反应体系
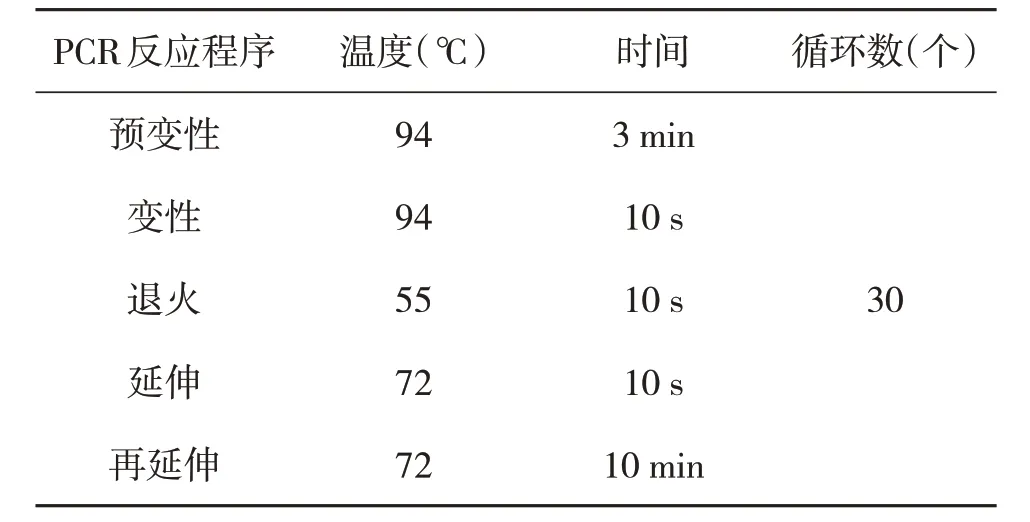
表3 PCR反应程序
1.4 发酵乳杆菌的生物学特性研究
1.4.1 耐酸性研究 使用pH值从9.0递减至1.5,共计13个酸碱度的MRS肉汤分别接种分离菌(接种后分离菌浓度约为1×106CFU/mL),37℃培养24h 后检测其OD600值。
1.4.2 耐胆盐性研究 将分离菌(接种后分离菌浓度约为1×106CFU/mL)接种于含牛胆盐0.05%、0.10%、0.20%、0.30%、0.40%、0.50%、0.60%、0.70%、0.80%、0.90%及1.00%的MRS肉汤中,37℃培养24h后检测其OD600值。
1.4.3 耐热性能研究 将菌株接种于MRS 液体培养基活化(活化后分离菌浓度约为2×108CFU/mL),后分别置于37至80℃共计7个温度梯度的水中放置1h,然后按照1:200 的比例分别转管接种于MRS 肉汤中,37℃培养24h后检测其OD600值。
1.5 动物安全性试验
设置试验组和对照组,每组5 只小鼠。试验组灌胃分离菌液1 mL(分离菌含量约为2×107CFU),每周两次;对照组灌胃生理盐水。连续4 周观察小鼠的状况并记录。
2 结果与分析
2.1 形态特征及染色结果
在MRS平板上从鸡盲肠中分离培养出的菌落均呈圆形,乳白色,边缘整齐,表面湿润有光泽,容易挑起。革兰氏染色镜检,呈单个、成对或者成链状排列的革兰氏阳性杆菌,无芽孢和鞭毛。符合乳酸菌的特征。

图1 分离菌在MRS平板上的菌落形态
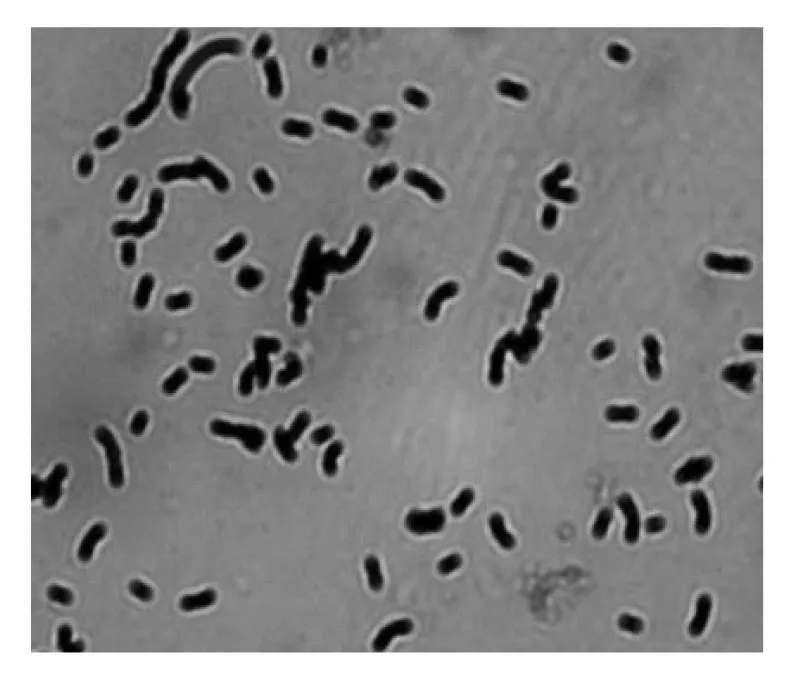
图2 分离菌油镜下的菌体形态
2.2 生理生化鉴定结果
按《乳酸细菌的分类鉴定与实验方法》及《常见细菌系统鉴定手册》,分离菌株生化试验结果见表4,初步判断为乳酸杆菌,命名为J4。
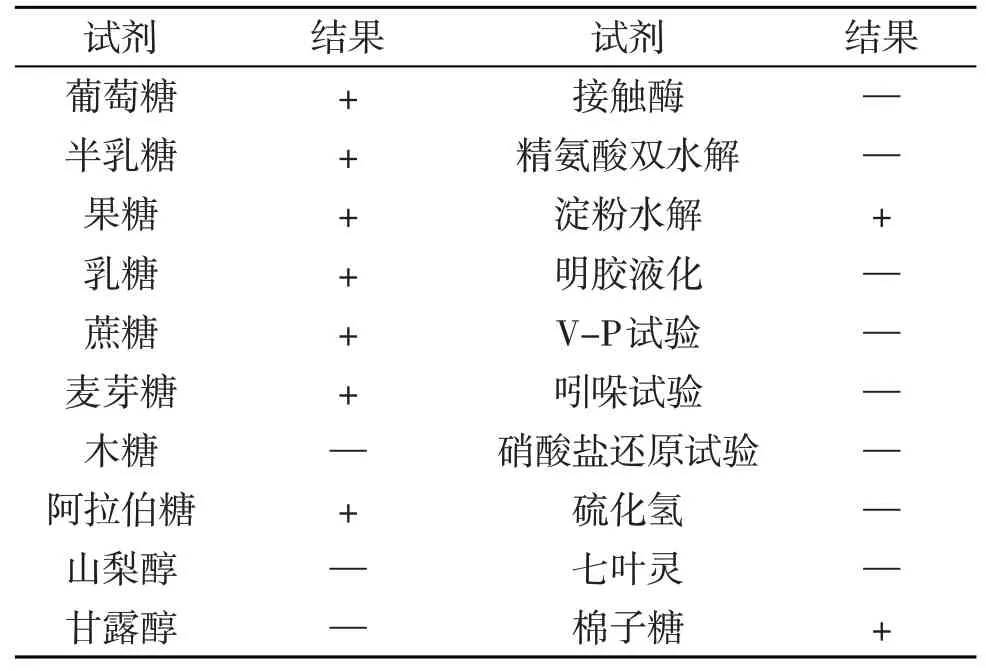
表4 鸡肠道分离菌生理生化试验结果
2.3 分子生物学鉴定结果
扩增产物大小约1466bp(见图3)。核苷酸同源性比对显示,分离菌与发酵乳杆菌同源性为99.70%。用MEGA6.06 软件构建遗传进化树,结果显示,其与发酵乳杆菌(KT780434 和LC065036)亲缘关系最近,在同一进化树分支上(见图4)。因此鉴定分离菌J4株为发酵乳杆菌。
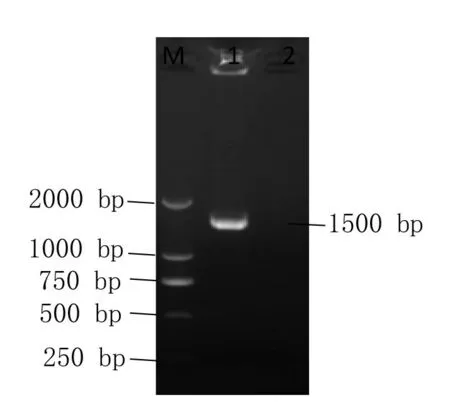
图3 菌株J4 16SrDNA PCR扩增电泳图

图4 菌株J4 16SrDNA遗传进化树
2.4 生物学特性研究
2.4.1 耐酸性 从图5 可见:菌株J4 在pH 值为2~8的MRS 培养基中均能生长,其中适宜pH 值为5~7,在pH值为2~5之间菌株J4 OD600nm值随着pH值降低而明显降低,表明低pH 值对菌株J4 的活性有较大影响,但其仍能有少量细菌生长,表明菌株J4 具有较强的耐酸性能。

图5 发酵乳杆菌J4在不同pH值MRS培养基中培养后的OD600nm值
2.4.2 耐胆盐性 从图6 可见:菌株J4 的OD600nm值随着胆盐质量分数的增加而下降,但浓度为1.0%时仍有细菌增殖,显示分离菌J4株耐胆盐能力较强。

图6 发酵乳杆菌J4在不同质量分数胆盐MRS培养基中培养后的OD600nm 值
2.4.3 耐热性 从图7 可见:菌株J4 在37,40,50,60,65,70,80℃水浴1 h 后再进行37 ℃培养24 h 的OD600nm值随着水浴温度的增加而下降,且70℃处理后仍有细菌生长,表明菌株J4具有较强的耐热性能。

图7 菌株J4在不同温度处理后培养的OD600nm值
2.5 动物安全性试验结果
两组小鼠实验过程中精神状态良好、采食正常,两组小鼠无明显差异。表明分离菌J4 株安全性良好。
3 讨论
直接从动物的消化道分离是获得乳酸杆菌的常用手段[5]。本试验获得的J4株乳酸杆菌分离于健康肉鸡盲肠,其细菌学综合鉴定结果与杜志琳[6]、刘鸽[7]等报道研究结果相符,为发酵乳杆菌。分离菌J4 株具有生长快速,耐热(70℃);耐酸(pH 值2);耐胆盐(耐0.6%胆盐)的能力,具备优良益生菌的条件。
益生菌作为安全高效的新型替抗产品,是解决养殖业中滥用抗生素的一种有效手段[4],但实际临床应用时往往遇到很多难题,其中最为主要的是异源菌株在动物肠道内定植难或者定殖后不分泌活性物质而不能发挥其作用[8]。章文明[9]等的研究表明,必须添加同源益生菌才能很好的发挥其益生效应,且其还应具有安全性好和较低免疫原性等优点。因此,从鸡肠道内分离、筛选出高效、安全的益生菌菌株是目前鸡饲料添加剂研究的研究方向[10]。目前养鸡场使用抗生素防治细菌病的现象十分普遍,但抗生素的大量、长期使用不仅使病原菌的耐药率升高,还影响肠道内的正常菌群平衡而影响生产效益以及造成药物残留威胁人类健康。鸡源益生菌的使用能有效减少抗生素的使用,有助于维持鸡的肠道菌群平衡[11],使鸡的自身免疫力得到提高[12]。同时,肠道菌群得到优化后,肠道内的有害菌显著减少,从而减轻肠道损伤,使鸡生长性能得到明显提升[13]等。另外,鸡肠道中存在胆盐且pH 值较低,因此在鸡肠道中定植和发挥作用的益生菌必须耐酸、耐胆盐。本试验分离获得的菌株具有耐热、耐酸、耐胆盐等特点,同时对动物机体安全无毒,可作为鸡源发酵乳杆菌益生菌的优良候选株。
4 结论
本试验分离获得的J4 株乳酸杆菌为发酵乳杆菌,具有耐热、耐酸、耐胆盐,安全无毒等特点,为鸡源微生态制剂的研制提供了优良候选株。

