从江香猪两个群体的血液基因组甲基化水平比较研究
陈 彬,刘 畅,冉雪琴*,王嘉福*
(1. 贵州大学 动物科学学院/生命科学学院/农业生物工程研究院,贵州 贵阳,550025;2. 遵义医科大学口腔疾病研究特色重点实验室,贵州 遵义,563003)
从江香猪是贵州特有的微型优良地方猪品种,平均产仔数7头左右[1]、体型矮小,其生长和繁殖一直是人们关注的重点。从江香猪因气候、生长环境和地理位置的影响,繁殖能力低是其显著特点[2]。且由于产仔数性状表现较晚,相关的遗传力较低,采用常规的选择培育方法进展缓慢。近年来,随着分子生物学和遗传学的发展,对动物经济性状多基因构成的遗传分析研究成为热点,尤其对猪的高繁殖性能研究更是主攻方向。多仔基因的筛选、遗传标记和分子标记等相关研究的涌现,使得从分子水平上研究繁殖性状成为重要趋势。DNA甲基化(DNA methylation)是最早发现的基因修饰调控方式之一,是表观遗传学的研究热点。DNA甲基化的主要作用是在不改变基因组密码子序列的情况下,对基因片段进行修饰,包括编码区、非编码区、启动子/操纵子,通过甲基化修饰的改变,可能影响到基因的转录和表达,影响家畜的表型性状或生理功能[3]。目前还不清楚香猪品种中这些生长和繁殖特点与其基因组的甲基化程度之间是否存在直接的联系。本试验以血液基因组为样品,研究香猪基因组总体甲基化变化规律,以期为后续分子育种提供理论参考,最终结合常规育种手段,提高从江香猪繁殖性能,推动从江香猪高繁殖力品系的选育,促进贵州这一特有珍稀小型猪品种的合理保护、开发和利用。
1 材料与方法
1.1 试验材料
65头雌性成年香猪的血液样本采自从江县(刚边乡平中村、秀塘乡卡机村、下熬村、交顶村、从江县原种猪场),挑选32头进行生长繁殖相关指标测定和甲基化检测,其余33头备用,并用于差异基因检测和验证。血样以EDTA-Na2抗凝,-80 ℃保存备用。TIANamp Blood DNA Kit 血液基因组DNA提取试剂盒和胶回收试剂盒购自北京天根生物有限公司。酶和载体购自大连宝生物有限公司。引物由上海英潍捷基有限公司合成。
1.2 试验方法
1.2.1 香猪生长繁殖相关性状的测定指标与方法 从江香猪的体型、体尺以及毛色等性状参照《种猪测定原理与方法》[4]进行测定。体高为鬐甲顶点至地面的垂直高度;体长从两耳连线中点沿背线到尾根处距离;体宽为肩胛后角左右两垂直切线间的距离;胸围为沿肩胛后角量取的胸部周径;腹围为腹部最大处的周径;管围为左前肢管部上三分之一最细处的水平周径。
1.2.2 甲基化敏感扩增多态性(MSAP)试验方法
①基因组的提取:试剂盒提取血液基因组DNA,OD260/OD280约为1.8,均分为两等份,每份500 ng。②酶切:同时设置两种酶切组合:EcoRⅠ+HpaⅡ组,EcoRⅠ+MspⅠ组,将buffer、水、基因组DNA等预混,37 ℃温浴0.5 h,再加EcoRⅠ、HpaⅡ、MspⅠ各10 IU,于37 ℃水浴中酶切8 h,1%的琼脂糖凝胶检测。③接头连接:取65 ℃灭活的酶切产物1.5 μL,加50 pmol的H-M接头、5 pmol的E接头(表1),T4 DNA连接酶0.5 μL,10×buffer 2 μL,补充水至10 μL,16 ℃连接过夜,1%琼脂糖凝胶检测。④预扩增:连接产物1.5 μL,2×Taq PCR Master Mix 12.5 μL,引物(表1)(HM+1,E+1)各50 ng。加双蒸水补充体积至25 μL。PCR反应条件:94 ℃预变性3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。1.5%琼脂糖凝胶电泳检测,如在500 bp以下有清晰条带和弥散条带,提示预扩增效果较好。⑤选择性扩增采用touchdown方法:94 ℃预变性3 min;94 ℃ 30 s,65 ℃基础上每个循环递减0.7 ℃,30 s,72 ℃ 1 min,13个循环;94 ℃ 30 s ,56 ℃ 30 s ,72 ℃ 1 min,27个循环;72 ℃保温10 min。用6%的变性聚丙烯酰胺凝胶电泳(含7 mol/L尿素)检测[5-8]。

表1 MSAP分析接头和引物序列Table 1 Sequence of adapters and primers used for MSAP analysis
1.2.3 甲基化水平分析方法 参照文献[5]确定血液基因组的甲基化修饰程度。在PAGE图谱中,相同位置上,将EcoRI+HpaII酶切并经两轮扩增得到的泳道记为H泳道,EcoRI+MspI酶切得到的泳道记为M泳道。当H泳道有条带、对应位置的M泳道无条带,为半甲基化;H泳道无条带、M泳道有条带为全甲基化,H泳道、M泳道均有条带为非甲基化。按下列公式计算基因组半甲基化水平、全甲基化水平和总甲基化水平:
DNA半甲基化水平/%=半甲基化位点数/(半甲基化位点数+全甲基化位点数+非甲基化位点数) ×100
DNA全甲基化水平/%=全甲基化位点数/(半甲基化位点数+全甲基化位点数+非甲基化位点数) ×100
DNA总甲基化水平/%=(半甲基化位点数+全甲基化位点数)/(半甲基化位点数+全甲基化位点数+非甲基化位点数) ×100
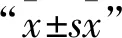
2 结果与分析
2.1 香猪的体尺性状和繁殖指标
选取从江香猪32头,经产大于8头的香猪为高产个体,经产小于等于8头的香猪为低产个体,对其体尺性状和繁殖指标进行统计整理(表2)。结果显示高产香猪在体长、体宽和胸围上较低产香猪差异显著(P<0.05)。

表2 香猪体尺及繁殖指标统计Table 2 Body measurement and reproduction index of Xiang pigs
注:同列数据肩标为相同字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
Notes: In the same column, values with the same or no letter superscripts mean insignificant difference (P>0.05), while different lowercase superscripts mean significant difference (P<0.05).
2.2 基因组甲基化水平分析
选取从江香猪32头,对其血液基因组DNA甲基化水平进行检测(图1),结果表明从江香猪基因组的平均半甲基化水平为10.5%、全甲基化水平15.2%,总甲基化水平25.7%(表3)。
2.3 血液基因组甲基化水平与香猪生长繁殖性状之间的相关性分析
对32头香猪血液基因组的平均半甲基化、全甲基化、总甲基化水平,与香猪的生长和繁殖等指标之间进行相关性分析,得出香猪血液基因组的总甲基化水平和全甲基化水平与最高产仔数和第三胎产仔数呈显著正相关(P<0.05),与其它指标之间的相关关系较弱(表4)。
2.4 血液基因组甲基化差异基因片段的克隆、测序分析与差异分布
用Quantity One 软件分析香猪高产群和低产群甲基化的PAGE图谱,统计变性聚丙烯酰胺凝胶电泳的条带,找到差异条带,筛选其中清晰和差异明显的条带进行胶回收、克隆和测序,得到的49 bp差异基因片段的核苷酸序列为CGGTTCAGGTACACGTGAGCTCAGAGCTCAGAGCCAAACTCA CTGAATT(图2)。
图1 基因组甲基化类型
H.基因组用EcoRI+HpaII进行酶切;M.基因组经EcoRI+MspI酶切;A,B,C均为香猪样本;a.代表半甲基化位点;b.代表全甲基化位点;c.代表非甲基化位点
Fig.1 Type of the genomic methylation
H. Genomic DNA digested byEcoRI andHpaII;M.Genomic DNA digested byEcoRI and Msp I;A,B,C is the sample of Xiang pig;a. semi-methylated sites;b.full methylation sites;c. non-methylated sites

表3 基因组甲基化水平统计表Table 3 Statistical table of genome methylation level %

表4 从江香猪血液基因组甲基化水平与其生长繁殖性状之间的相关性分析Table 4 Correlation analysis between the level of genomic methylation and index related with growth and litter size of Xiang pig
注:同行数据肩标*表示相关性显著P<0.05,肩标**表示相关性极显著P<0.01,无肩标表示相关性不显著。
Note: In the same row,superscript * means correlation is significant atP<0.05 level,superscript ** means correlation is extremely significant atP<0.01 level,no superscript means correlation is not significant. The same below.
经比对分析,该片段与猪参考基因组1号染色体上的ATP10A基因第六内含子中相应序列的相似性为100%。利用RegRNA 2.0在线软件(http://regrna2.mbc.nctu.edu.tw/)对该片段的剪接位点进行预测,预测结果显示该片段存在内含子剪接增强子(intron splicing enhancer, ISE)和3个转录调控元件(Transcriptional regulatory motif ),可能对内含子的剪接存在影响。ATP10A基因编码磷脂转运ATP酶。将高产和低产香猪样本量扩大到65头,统计每个样本ATP10A基因片段差异位点是否甲基化,得出香猪高产种群该位点存在甲基化的比例为68.8%,低产群为93.9%,之间的差异明显(P<0.05)。
3 讨 论
本研究采用MSAP技术测定了从江香猪群体血液基因组DNA的甲基化水平,发现从江香猪的总甲基化水平明显低于柯乐猪、大白猪[5],此差异可能与猪品种的遗传差异有关,已知不同猪种脂肪组织基因组DNA甲基化水平不同[11],且动物DNA甲基化水平因动物年龄、组织、细胞类型的不同而有所差异[12]。同时从江香猪与柯乐猪和大白猪的生存地理位置、气候环境迥异,也可能导致甲基化水平差异的表现,有研究显示生存环境也对动物的表观遗传有所影响,导致甲基化水平的差异[13]。进一步分析显示,基因组甲基化水平与香猪的产仔数有关。同时低产香猪的经产产仔数约为7头,柯乐猪约为8头,大白猪约为12头[1,14-15],香猪的产仔数明显较低。有研究表明杂种一代的基因组甲基化水平高于亲本,繁殖性能也高于亲本[16],提示香猪基因组的低甲基化水平通过某种机制可能不利于个体的产仔性状。甲基化水平的变化影响到动物生命活动的各个方面,随着遗传背景和外界环境的不同而体现不同的功能,具体机制复杂且尚不清楚,但随着研究的深入,也将逐渐揭开这层迷雾。
将香猪高产群和低产群甲基化的PAGE分析图谱相比较,回收有明显差异的片段进行克隆测序,确定差异的甲基化位点条带的序列与ATP10A基因的第六内含子中的相应片段相似性为100%;经预测片段中含有一个ISE位点。进一步扩大样本量到65头,统计在高、低产香猪样本中的该位点的甲基化分布,发现香猪低产群该位点被甲基化修饰的比例明显较高。从人类Gene Cards数据库中检索到ATP10A基因广泛表达,特别是血小板中的表达量较高,主要功能与细胞膜之间磷脂分子转运和不对称分布有关[17-18];已知ATP10A的外源性表达促进磷脂酰胆碱(phosphatidylcholine,PC)发生翻转等跨膜活动[19],PC是人和动物血液中大量存在的磷脂类分子,与鞘磷脂一起形成了不同密度的脂蛋白,对血液中胆固醇分子的转运和代谢起重要作用[20];当禽类体内合成的胆固醇减少或不足以维持胚胎发育时,雌禽会减少甚至停止产蛋,表明胆固醇浓度与繁殖性状关系密切[21];给母猪补饲胆碱可提高窝产仔数和仔猪的生长速度[22]。根据上述研究结果,推测香猪高产个体的ATP10A基因位点的低甲基化修饰有利于ATP10A基因的表达,促进磷脂酰胆碱和胆固醇等脂质的转运和代谢,对从江香猪的繁殖性能产生积极的影响,但具体机制尚不明确。
4 结 论
通过甲基化敏感扩增多态性技术,得出香猪群体的平均半甲基化水平为10.45%、全甲基化频率为15.20%、总甲基化频率25.66%;将甲基化水平与香猪的生长繁殖指标进行关联分析得出,香猪血液基因组的总甲基化水平和全甲基化水平与其最高产仔数和第三胎产仔数显著正相关;在ATP10A基因的内含子中得到一个49 bp的差异片段。研究结果表明香猪基因组的甲基化水平与其繁殖性状存在相关性。

