饲粮添加阴离子盐对山羊瘤胃发酵参数及血钙调控的影响
简仕燕,杨 康,王 菲,马政发,郭子義,吴文旋,2,3*,吴佳海,牟琼
(1.贵州大学 动物科学学院动物营养与饲料科学研究所,贵州 贵阳 550025;2.贵州大学 新农村发展研究院,贵州 贵阳 550025;3.贵州山地畜禽粪便污染防控与资源化工程实验室,贵州 贵阳 550025;4.贵州省草业研究所,贵州 贵阳 550006)
低血钙是一种营养代谢性疾病,由于奶畜不能充分动用骨钙、肠钙吸收率降低、产后分泌初乳等原因造成钙损失过多,血钙浓度明显降低,严重可诱发真胃移位、胎衣不下、乳房炎等疾病,严重影响奶畜生产性能[1],是动物营养学界致力解决的重要课题。历经灌服水溶性钙盐、注射维生素D或其活性形式(1,25-(OH)2D3)、产前饲喂低钙日粮等处理后,Block[2]报道降低日粮阴阳离子差(dietary cation-anion difference, DCAD)可增加钙吸收、提高血钙水平、维持血钙稳恒、防治低血钙,为该领域后续研究提供了基础[3-4],而在饲粮中添加阴离子盐降低DCAD已成为当前防治低血钙的最常用手段[5]。
Ca2+的吸收包括3个步骤:首先,Ca2+经瞬时受体电位通道香草酸受体6(Transient receptor potential vanilloid receptor 6,TRPV6)介导顺浓度梯度扩散入胞;其次,入胞后Ca2+即与钙结合蛋白(Calcium binding protein D9k, CaBP-D9k)结合,并由细胞刷状缘膜顶膜转运至基底膜;最后,Ca2+在基底膜转运蛋白细胞膜钙泵(Plasma membrane Ca-ATPase 1b,PMCA1b)和钠钙交换体1(Na+/Ca2+exchanger1,NCX1)的作用下,逆浓度梯度由基底膜跨膜出胞,进入血液[6]。上述3个步骤均受维生素D受体(VDR)的调控。
本课题组前期研究发现,Ca2+吸收相关蛋白表达水平的提高与增加血钙浓度紧密相关[7-9]。CaBP-D9k、TRPV6和VDR可调控Ca跨细胞膜在肠道吸收这一途径,CaBP-D9k、TRPV6、VDR的表达水平越高,意味着钙的吸收越高,提示降低 DCAD 水平可上调这3个基因的表达水平而增强钙的吸收[10]。在本课题组开展的不同DCAD水平对羊血CaBP-D9k[7]、VDR[9]含量和瘤胃体外发酵参数[11]的基础上,本试验重点研究低DCAD水平饲粮对血钙稳恒及其调控因子水平与瘤胃内发酵参数的效应,为低DCAD防治低血钙和探讨山羊健康状况提供技术积累和基础数据。
1 材料与方法
1.1 试验设计
采用交叉试验设计,以6只体况良好、年龄(3.5±0.2岁)、体重相近(42.6±2.1 kg)的黔北麻羊为试验动物,将其分为处理组和对照组,每组3个重复,每个重复1只羊。对照组饲喂基础日粮,由精料和羊草干草构成,设计DCAD(DCAD=Na+K-Cl-S, mmol/kg DM)水平为+150。根据文献报道和课题组前期研究结果,处理组在对照组日粮基础上添加阴离子盐MgSO4·7H2O,设计DCAD水平为-150。山羊日粮精粗比为40:60,组成及营养水平见表1。经测定,设计DCAD水平和实际测量值略有差异。
1.2 饲养管理
试验共持续47 d,前10 d观察山羊采食和健康状况,然后进入为期30 d的试验期。试验期分为2个阶段,每个阶段持续15 d。每个阶段的前10 d为预饲期,主要观察山羊采食MgSO4·7H2O的适应性,后5 d为采样期。每个阶段结束后,持续7 d采食对照饲粮,消除处理残留效应。试验期间羊舍保持干燥,自然通风,山羊单饲于代谢笼中,留有运动空间。日饲3次,饲喂时间分别为8:00、13:00、18:00。山羊自由采食和饮水。
1.3 指标检测
1.3.1 日粮常规养分与DCAD 自预饲期开始,每天采集饲粮样品,试验结束后混匀并制成分析样品,检测常规养分:粗蛋白质(Crude protein, CP)、中性洗涤纤维(Neutral detergent fiber, NDF)、酸性洗涤纤维(Acid detergent fiber, ADF)、粗灰分(Ash)、粗脂肪(Ether extract, EE)、钠(Na)、钾(K)、氯(Cl)、硫(S)。CP采用凯氏定氮法,NDF、ADF采用Van Soest法,EE采用乙醚浸提法,Ash采用灼烧法,氯(Cl)采用硝酸银滴定法(GB/T6439-92)测定,硫(S)含量采用硝酸镁法(GB/T17776-1999)测定[12],钠(Na)、钾(K)含量采用原子吸收法测定(试剂盒购自北京三雄科技公司)。DCAD计算公式:DCAD(mmol/kg DM)=Na(%)/0.0023 + K(%)/0.0039-Cl(%)/0.00355-S(%)/0.0016。
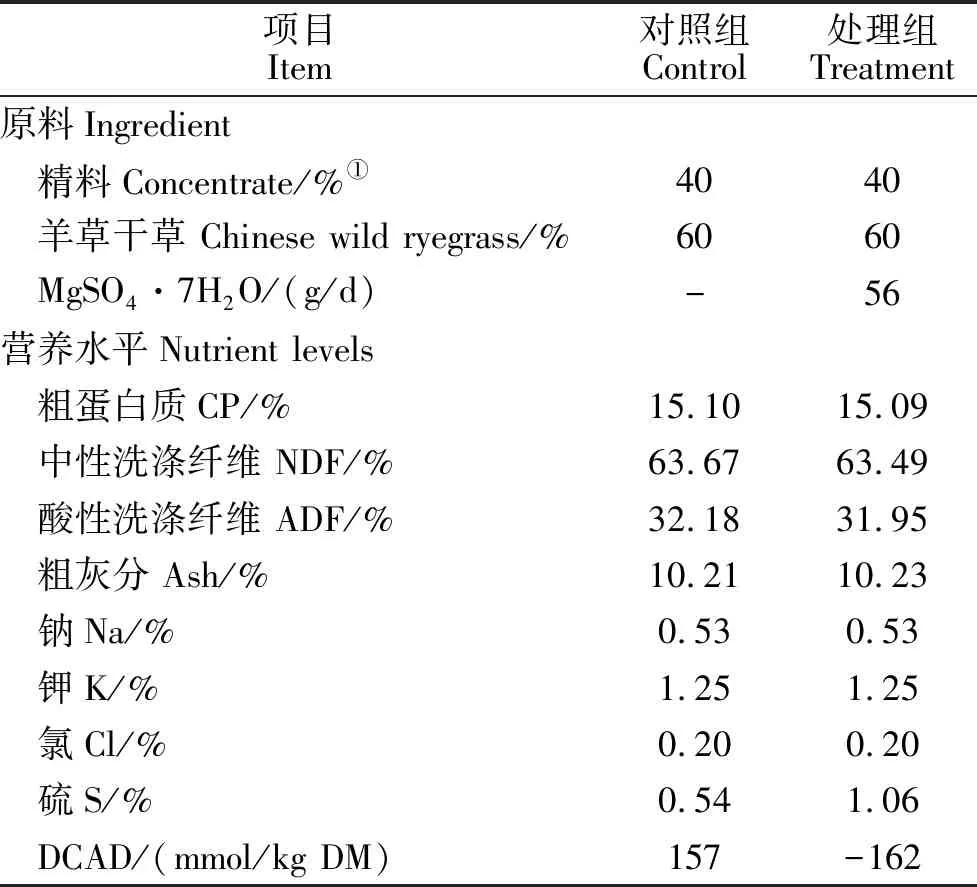
表1 山羊日粮组成及营养水平(干物质基础)Table 1 Composition and nutrition levels for diets of goats(DM basis)
注:①组成及水平:玉米67% ,豆粕 7%,麦麸 11%,菜籽饼 11%,预混料 2%,碳酸氢钙 1%,食盐 1%。每kg预混料含:VA 300~500 IU,VD3 150~220 IU,VE 850 IU,Fe 1 500~5 000 mg,Cu 500~620 mg,Mn 1 500~4 000 mg,Zn 2 000~3 500 mg,I 50~200 mg,Se 10~20 mg,Co 20~40 mg,Lys 10 000 mg。
Notes:① Composition and nutritional level: corn 67%,soybean meal 7%, wheat bran 11%,rapeseed cake 11%,premix 2%,CaHPO41%,NaCl 1%。The premix per kg contains: VA 300~500 IU,VD3150~220 IU,VE 850 IU,Fe 1 500~5 000 mg,Cu 500~620 mg,Mn 1 500~4 000 mg,Zn 2 000~3 500 mg,I 50~200 mg,Se 10~20 mg,Co 20~40 mg,Lys 10 000 mg.
1.3.2 尿液pH 从每期正试期开始持续至试验结束,连续5 d,每天在采食2 h后用精密pH试纸(pH范围为5.4~7.0,6.4~8.0,上海试剂三厂)蘸取新鲜尿液与标准板比对,记录尿液pH,以此判定山羊尿液pH变化情况。
1.3.3 血液指标 晨饲前(7:00)用肝素抗凝管从颈静脉采血10 mL,3 000 r/min离心15 min,取上清血浆置于-20 ℃冰箱保存,试验结束后采用试剂盒法测定血浆Ca、甲状旁腺素(Parathyroid hormone, PTH)、降钙素(Calcitonin, CT)、1,25二羟基维生素D3(1,25-(OH)2VD3)、瞬时性受体电位通道香草酸受体亚型6(transient receptor potential vanilloid 6, TRPV6)、维生素D受体(VDR)。上述指标检测试剂盒均购自南京建成生物公司。
1.3.4 瘤胃发酵参数 采用胃管式瘤胃液采样器于晨饲前采取瘤胃液,4层纱布过滤后测定瘤胃液发酵参数,包括:瘤胃液pH、氨态氮浓度(NH3-N)。其中,瘤胃液pH用便携式pH计(梅特勒-托利多仪器FG2-ELK)测定,氨态氮浓度参照文献[13]方法测定。
1.4 数据统计

2 结果与分析
2.1 干物质采食量
处理组山羊干物质采食量在预饲期前3 d稍低,经适应后逐渐恢复至与对照组基本一致水平,对照组、处理组分别为940.8±3.85和932.3±6.76 g/d,差异不显著(P>0.05),说明添加阴离子盐未对山羊饲粮适口性产生影响。
2.2 尿液pH
对照组和处理组山羊尿液pH分别为7.8±0.10和6.4±0.07,差异显著(P<0.05),说明处理组山羊采食低DCAD水平饲粮后尿液明显酸化。
2.3 血浆代谢指标
由表2可知,处理组血浆Ca2+浓度高于对照组12.3%(P<0.05)。血浆VDR、TRPV6、PTH浓度变化与DCAD水平呈相反趋势,即DCAD水平降低,血浆VDR、TRPV6、PTH浓度升高。处理组VDR、TRPV6、PTH分别高于对照组17.2%、20.8%、30.4%(P<0.05)。两组1,25-(OH)2VD3、CT水平接近,差异不显著(P>0.05)。
2.4 瘤胃发酵参数
处理组的瘤胃液pH和NH3-N浓度分别为6.48±0.37和6.46±0.17,与对照组(分别为6.80±0.16和6.24±0.19)差异不显著(P>0.05)。
3 讨 论
3.1 不同DCAD水平日粮对山羊干物质采食量的影响
动物采食量与其生长发育和生产性能的密切相关,是评价降低DCAD水平是否适宜首要考虑的问题,与饲粮适口性、环境、饲养管理方式等因素有关[14]。DCAD为负值的日粮通常具有苦涩味,会造成干物质采食量下降[15]。本试验中,处理组山羊的干物质采食量未明显降低,说明山羊可适应本试验所用阴离子盐(MgSO4·7H2O)的味道。此结果得到前人研究报道的支持[16-18],同时与本课题组前期的研究结果[19]一致。
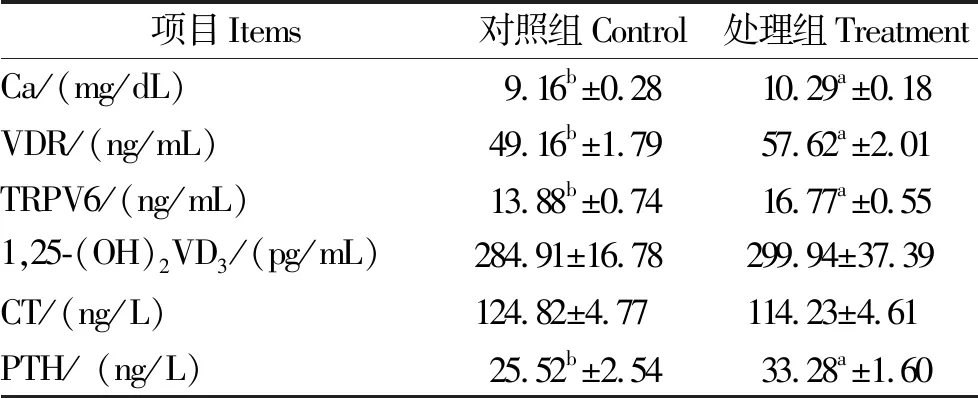
表2 不同DCAD水平饲粮对山羊血钙及其代谢因子水平的影响Table 2 Effect of different DCAD levels of diets on blood calcium and its metabolism associated factors in goats
注:同行数据肩标为相同字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。
Notes: In the same row, values with the same or no letter superscripts mean insignificant difference (P>0.05), while different lowercase superscripts mean significant difference (P<0.05).
3.2 不同DCAD水平日粮对山羊尿液pH的影响
采食低DCAD饲粮可诱导机体轻度代偿性酸中毒,DCAD水平与尿液pH及血液pH之间呈显著性相关[20]。尿液pH收集、测量便捷,对机体应激小,尤其对DCAD水平敏感性强,可作为量化DCAD水平的指标。试验表明,尿液pH会随DCAD降低而下降[21],这是因为采食DCAD饲粮,根据强离子差理论,Cl-、S2-被机体吸收后,可在肾脏中产生相应的负电荷,机体为了维持溶液电中性和电离平衡而分泌排出相应的H+,使血液中的阴离子水平高于阳离子水平,从而导致尿液pH降低[22]。本试验中处理组尿液pH显著低于对照组,这与Goff和Horst[23]试验结果一致,其认为降低DCAD后尿液pH的理想数值为5.5~6.5,在这个范围可保证肾脏离子代谢不紊乱和较高的血钙水平。总体而言,降低DCAD水平,可使尿液pH降低。
3.3 不同DCAD水平对山羊瘤胃发酵参数的影响
3.3.1 瘤胃pH 瘤胃pH是食糜VFA与唾液缓冲盐相互作用、以及瘤胃上皮对VFA吸收及食糜排出等因素综合利用的结果,是反映瘤胃酸碱平衡状况和瘤胃微生物环境的重要指标。鉴于瘤胃pH绝对水平的重要性,Iwaniuk和Erdman[24]统计分析了DCAD水平与瘤胃pH的关联性,发现在0~550范围内,饲粮DCAD水平每升高100个单位,瘤胃pH仅上调0.03个单位,显示瘤胃pH变幅最大是0.165个单位。与精粗比不同引发瘤胃酸中毒后的瘤胃pH变异相比,这个变幅差异很小,不足以根本改变瘤胃发酵状态。
本试验中两组山羊的瘤胃pH仅有微小差异,处于正常范围,说明低水平DCAD饲粮未对瘤胃发酵产生负面影响。更进一步,本课题组前期研究发现,体内pH(饲喂低DCAD饲粮,DCAD=-111)、体外pH(以低DCAD饲粮作发酵底物,DCAD=-170)水平均在正常范围[25]。与此类似,李斌[26]发现饲喂低DCAD饲粮后pH在2~6 h短期内降低,但很快回升至正常水平,这可能与瘤胃液强大的缓冲能力有关;Murphy和Kennelly[27]也得出相同结论,他们指出瘤胃pH一般是在采食后2~6 h内降低。Tucker等[28]对泌乳奶牛研究结果显示,瘤胃pH水平随饲粮DCAD水平升高(-100、0、100、200)而呈现上升趋势,但瘤胃发酵模式未改变。张跃文等[29]在体外模拟瘤胃发酵试验中,饲粮DCAD水平由正值+120降为-150的几个梯度(梯度水平为-70)对瘤胃pH均未产生影响。上述结果表明,DCAD水平造成的瘤胃pH差异很小,对瘤胃发酵状态的影响可忽略不计,为研究后续发酵参数奠定了基础。
3.3.2 瘤胃发酵参数 瘤胃NH3-N水平是反映饲粮蛋白质在瘤胃中的降解、能量供给及微生物蛋白的合成的重要指标,主要受采食速度、饲粮含氮量、降解速度、唾液及瘤胃缓冲能力等因素的影响。瘤胃微生物合成MCP所需的NH3-N水平在0.35~29.0 mg/100 mL之间[30]。当饲粮含氮化合物的含量较大且易被降解,瘤胃降解速度大于瘤胃微生物的合成速度时,瘤胃内NH3-N浓度较高,此时瘤胃中NH3-N参与“瘤胃-肝脏的氮素循环”。本试验结果表明,处理组和对照组NH3-N水平均处于正常范围内。胡明等[31]研究发现,随饲粮DCAD水平增加(0、100、200、400),瘤胃NH3-N变化范围为4.60~31.62 mg/100 mL。冯强等[32]将饲粮DCAD水平设为0、50、100、200,发现在同一时间点,随DCAD水平增加,瘤胃NH3-N浓度变化范围为7.72~30.80 mg/100 mL之内。这从另一侧面说明,DCAD水平不对瘤胃发酵产生负面作用。
瘤胃发酵作为反刍动物营养研究的重要内容,综合本试验上述指标测定结果和前人报道,可以认为,DCAD水平不会对瘤胃发酵和体内代谢产生负面影响。这为生产实践中推广添加阴离子盐降低DCAD防治低血钙提供了理论依据。
3.4 不同DCAD水平对山羊血浆指标的影响
3.4.1 血浆Ca2+水平 作为降低DCAD处理的主要观察点和效应表征,血钙水平是该类研究的重要检测指标。动物血钙稳恒由胃肠道Ca2+摄取、骨钙溶解及肾Ca2+重吸收等多种机制共同调节,一般维持在2.0~3.0 mmol/L范围间;低于2.0 mmol/L,即发生低血钙。本课题组前期研究报道,DCAD与血钙水平存在较强的关联度,DCAD降低,血钙水平升高;反之亦然[33]。这也在本试验中得到体现,并与该领域相关研究结果一致。Goff等[34]认为,不考虑饲粮钙水平的影响,饲粮 DCAD 为负值时,奶牛分娩时血浆中钙离子的浓度显著提高。Oba等[35]发现,对非泌乳非怀孕奶牛注射EDTA使其血钙降低后,饲喂不同DCAD水平(-64 vs. 82)和不同的钙水平(3.0和9.1 g/kg DM)饲粮,发现高钙饲粮和低DCAD水平饲粮均能缩短血钙水平恢复时间。总之,降低DCAD能提高血钙水平,得到学界的普遍认同,成为防治低血钙的常用措施。
3.4.2 钙调蛋白 PTH浓度是血钙调节的关键因素,一方面可促进肾脏对1,25-(OH)2VD3合成与分泌,二者可影响肾脏对Ca2+的重吸收;另一方面,PTH促进破骨细胞形成,抑制成骨细胞生成与转化,调控骨骼钙动员。1,25-(OH)2VD3是Ca2+主动转运的载体,可促进肠道上皮细胞对Ca2+的主动吸收。CT主要是抑制新的破骨细胞生成并使破骨细胞活性降低,从而降低血钙浓度。上述3种激素浓度的变化可反映血钙含量的变化。本试验结果显示,虽然两组山羊1,25-(OH)2VD3和CT水平变化不大,差异不显著;但处理组血浆PTH浓度显著高于对照组,这说明DCAD饲粮可促进PTH的分泌,可能贡献了较高的血钙水平。VDR是钙吸收过程中主要的调控因子,其与1,25-(OH)2VD3特异性结合为蛋白-受体复合物发挥生理功能[36],同时,1,25-(OH)2VD3能有效提高胃肠道TRPV6的活性[37]。TRPV6大量分布于肠道上皮细胞,是促使胞内Ca2+跨质膜外排进入血液的重要生理大分子,也是肠道上皮细胞对Ca2+的吸收的初始元件;在Ca2+吸收过程中,TRPV6通道表达增加,使Ca2+内流速度加快、胞内Ca2+浓度增加。本课题组前期研究发现,低DCAD饲粮可提高山羊胃肠道VDR和血浆TRPV6的水平[38]。本试验结果显示,山羊血浆VDR、TRPV6的浓度随饲粮DCAD水平的降低而升高,并达到差异显著水平,提示DCAD饲粮对血浆VDR、TRPV6的浓度有上调作用。总体来看,降低DCAD后,虽然并非所有钙调因子浓度都增加,但血液PTH、VDR和TRPV6水平得以升高,使处理组山羊血钙水平高于对照组,更好地维持血钙稳恒状态。
4 结 论
低DCAD饲粮可降低山羊体内酸碱平衡状态,提高血钙及其代谢因子水平,对瘤胃发酵指标不产生负面影响。这为生产实践推广添加阴离子盐降低DCAD防治低血钙提供了理论依据。

