地质封存CO2泄漏对蚯蚓的毒性效应
赵晨阳,马俊杰,2,*,薛璐,3,田园,刘丹
1. 西北大学,西安 710127 2. 二氧化碳捕集与封存技术国家地方联合工程研究中心,西安 710127 3. 榆林学院,榆林 719000
二氧化碳捕集与封存技术(CO2capture and storage, CCS)是清洁能源技术的关键部分,为减少温室气体排放、确保能源安全提供了一条可持续的道路[1]。CCS项目是将从排放源捕集的CO2注入到盆地的石油与天然气储层、深层咸水层和不可开采的煤层[2]等稳定的地质构造中,达到捕碳减排的效果[3]。CCS工程的“高效性”取决于“零泄漏”的保障[4],但由于封存的地质条件和人类活动的不确定性,注入的CO2存在着通过泄漏井、断层或裂缝以及盖层的“薄弱带”(局部高渗带)产生泄漏的风险[5-7],加之我国地形条件复杂,生态环境脆弱,一旦发生泄漏,其风险会远高于其他国家[8]。CCS泄漏将会对近地表陆地生态系统产生直接威胁,这已经成为CCS技术最大的环境风险[9]。
最近网络科学安全研究所(RISCS)的研究表明,地质封存CO2泄漏引起的土壤中CO2浓度的增加比任何相关的、短暂的和大气水平的轻微上升具有更显著的影响[10]。已有研究证实,CCS泄漏[11-12]可导致土壤CO2浓度升高、土壤酸化[13]以及土壤O2含量减少[14],在CO2泄漏中心区域,泄漏量可达2 000~3 000 g·m-2·d-1,土壤CO2浓度接近100%[13],会对土壤生态系统以及植物带来极大的危害。同时,CO2泄漏会对土壤微生物群落及土壤酶活性产生显著影响。张旺园等[15]研究得出,随着土壤CO2浓度增加,土壤微生物多样性逐渐降低,结构趋于单一,土壤酶活性变化明显。张慧慧等[16]通过变性梯度凝胶电泳(PCR-DGGE)分析得出,高浓度CO2长期入侵土壤包气带,能促进细菌、真菌生长,抑制放线菌的生长;真菌对CO2胁迫表现更为敏感。基于CO2泄漏对土壤性质以及土壤微生物的研究,地质封存CO2泄漏对土壤大型动物的影响知之甚少。
蚯蚓作为土壤大型动物的代表,是土壤生态系统非常重要的组成部分,其生命活动过程可改善土壤结构、提高土壤肥力,它对土壤生态系统的贡献已被广泛认识[17-18];蚯蚓作为的“生态系统工程师”,是许多动物的食物来源,也是土壤生物、土壤生态环境与陆地生物之间(营养)信息传递的桥梁[19-21],在地球物质循环和陆地生态系统食物链的物质传递中担负着重要功能[22]。同时,蚯蚓对土壤中外源性污染物非常敏感,是最易受到环境有毒有害物质伤害的土壤生物之一,因而也是土壤污染生态风险评价的重要指示生物。
本研究以蚯蚓作为研究对象,通过模拟地质封存CO2泄漏后可能产生的土壤高浓度CO2环境,研究土壤高浓度CO2对蚯蚓的形态变化、皮肤及表皮损伤、死亡率、体腔细胞溶酶体中性红保留时间(NRRT)等生长与生理毒性效应,明确土壤高浓度CO2对土壤典型动物蚯蚓的影响,以期为CCS项目的风险评估以及泄漏的识别提供参考。
1 材料与方法 (Materials and methods)
1.1 实验材料
1.1.1 蚯蚓
按照蚯蚓的生态习性,可将蚯蚓分为表栖型、内栖型和深栖型3类[23]。从CCS项目CO2泄露特征而言,一般具有下部浓度高表层浓度低的特点。关笑坤[24]采用250 cm土柱进行CO2泄露扩散模拟实验,发现30 cm深度处CO2浓度可达250 cm深度处的80%。通过预实验得出,5 cm和10 cm深度处CO2浓度可分别达到30 cm深度处的15%和45%。以250 cm深度处CO2浓度100%为参照,则5 cm和10 cm深度处CO2浓度可达到12%和36%。近表层土壤对深部CO2泄露有比较明显的响应,其浓度值也明显超过该层位土壤正常活动时CO2最高浓度(4%)。为了便于通过土壤动物蚯蚓开展CCS项目中CO2泄露风险监测,本文以易于发现、易于采样的表居型蚯蚓——赤子爱胜蚓(Eiseniafetida)为实验对象,其取自陕西却行生物科技有限公司(陕西杨凌)养殖场,在实验室用牛粪作为饲养基质,于室温下长期培养。实验时选取体重为400~500 mg、生殖环带明显且大小一致的成年蚯蚓。
1.1.2 供试土壤
实验土壤采自西安市长安区某农田表层土(0~20 cm),土壤的基本理化性质如表1所示,该土壤为弱碱性高有机质沙质粘土。
1.1.3 主要仪器和试剂
实践证明,耐密型玉米品种相比稀植大穗品种具有较大的增产潜力。通过对建昌县耐密玉米种植现状和推广对策分析,引导全县农民改变种植观念,广泛种植耐密玉米品种,通过增加密度和集成耐密型玉米高产栽培技术,实现玉米种植的高产高效。
试剂:二甲基亚砜、中性红指示剂(C15H17N4Cl)、氯化钠、氯化钾、氯化钙、硫酸镁、磷酸二氢钾、戊二醛、无水乙醇和乙酸异戊酯等,以上试剂均为分析纯,购自天津市科密欧化学试剂有限公司。
主要仪器:光学显微镜(型号OLYMPUS CX23,山东博科科学仪器有限公司);扫描电子显微镜(型号SU3500,深圳市三昊仪器设备有限公司);动物培养箱(型号YCP-160D,长沙华晓电子科技有限公司)等。
1.2 实验方法
1.2.1 实验设计
本实验用动物培养箱来模拟CCS技术中CO2发生泄漏后可能产生的高浓度CO2环境。该培养箱可以通过传感器及其反馈系统控制箱体内CO2的浓度,以达到控制土壤CO2浓度的目的,该培养箱也可以控制温度和光照度,其CO2浓度量程可以到达100%。各参数均可以多级调节,可以根据实验的需要设定相应的目标值。具体装置如图1所示。
本实验参考经合组织化学品测试准则(OCED 207)[25]的方法开展蚯蚓毒性实验。首先通过预实验得出蚯蚓全存活的最高浓度为8%,全致死的最低浓度为48%。在此基础上,确定适用于开展蚯蚓毒性实验的CO2浓度分别为:CK(对照组)、10%、20%、30%、40%和48%共6个浓度梯度。实验时将驯化一周的蚯蚓放入铺有湿润滤纸的培养皿中清肠24 h,用0.9%的生理盐水冲洗蚯蚓表面并用滤纸擦干。称取500 g实验土样于实验盒中,加入适当蒸馏水,调节土壤含水率,使得土壤含水率为最大持水量的60%。然后将10条清肠后的蚯蚓放入土壤表面,任其自由活动,实验盒用纱布封口,橡皮筋捆扎,防止蚯蚓逃逸。将实验盒放入培养箱中培养,保持箱内恒温(20±1) ℃,提供连续的光照,适时补充水分,每个处理设置3个重复。
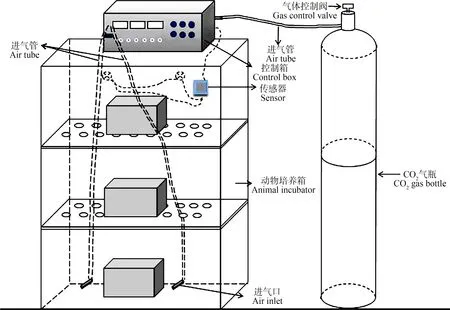
图1 动物培养箱Fig. 1 Animal incubator

表1 实验土壤基本理化性质Table 1 Physical and chemical properties of experimental soil
1.2.2 指标测定
形态变化与皮肤损伤:在实验过程中观察蚯蚓形态变化,并通过扫描电镜观察暴露7 d后各浓度梯度下存活的蚯蚓皮肤,拍照记录皮肤损伤情况。具体操作步骤按照谢显传[26]所描述的方法进行试验,对蚯蚓进行清肠、取材、固定、清洗、脱水、置换和干燥等处理后用扫描电镜观察。
蚯蚓死亡数与死亡率统计:分别在7 d和14 d记录每个浓度梯度下蚯蚓的死亡数,实验中将蚯蚓头、尾部受到机械刺激而无反应认为是已经死亡[19],根据死亡率=(死亡数/总数量)×100%计算得出蚯蚓的死亡率。
蚯蚓体腔细胞溶酶体中性红保留时间(neutral red retention time, NRRT)测定方法如下。由于污染物会使蚯蚓溶酶体膜受损,导致中性红染料释放,体腔细胞变红。因此,用NRRT变化来指示蚯蚓受到的污染胁迫,NRRT越长,毒害作用越弱;NRRT越短,毒害作用越强。实验分别取暴露7 d和14 d后不同CO2浓度下存活的蚯蚓测定NRRT,根据Maboeta等[27]所描述的方法进行测定。用中性红工作液(20 mg中性红溶于1 mL二甲基亚砜)染色,在光学电子显微镜下观察并实时记录整个染色过程,当视野中超过50%的体腔细胞被染成粉红色,观察结束,记录NRRT。
1.3 数据分析
采用SPASS11.5和origin8.0进行数据分析与作图,数据表示为平均值±标准差(AV±SD),高浓度CO2对蚯蚓的半数致死浓度(LC50)通过线性回归法求出。
2 结果(Results)
2.1 蚯蚓形态变化与皮肤损伤
土壤高浓度CO2使蚯蚓的形态发生了变化。在暴露1初期,蚯蚓出现了卷曲现象;随着暴露时间的延长,蚯蚓表现出生殖环带肿大、尾部串珠以及断尾等中毒现象;在实验过程中还观察到,受损蚯蚓皮肤表面不像正常蚯蚓一样保持湿润,有蚯蚓死亡在土壤表层甚至发生自溶。
通过扫描电镜观察蚯蚓在不同CO2浓度下暴露7 d后的皮肤状况。CK组蚯蚓的皮肤表面光滑紧凑、组织良好(图2(a));CO2浓度为10%时,蚯蚓皮肤出现局部损伤(图2(b));CO2浓度为20%时,蚯蚓皮肤损伤面积扩大、程度加深,个别环节收缩变细(图2(c));CO2浓度为30%时,蚯蚓表皮纹理变粗并出现与皮肤损伤连带性的明显组织损伤(图2(d));CO2浓度为40%时,发生大面积皮肤损伤,整个皮肤表面非常粗糙,褶皱明显(图2(e)、2(f))。
通过观察蚯蚓刚毛发现,CK组蚯蚓的刚毛完整、排列整齐(图3(a));随着土壤CO2浓度升高,蚯蚓的刚毛锐度降低,出现不同程度的开裂及断裂现象(图3(b)~3(d))。
进一步放大观察蚯蚓的表皮纹理变化(图4),在同样的放大倍数(1 000倍)下,CK组蚯蚓表皮裂隙规整顺直,裂隙间紧致有序(图4(a));随着CO2浓度的增加,蚯蚓的表皮裂隙逐渐加宽、弯曲度增大,表皮裂隙间纹理逐渐模糊,部分裂隙间出现细胞碎屑及其分泌物(图4(b)~4(e))。
2.2 蚯蚓死亡数与死亡率
在实验的第7天和第14天分别统计不同CO2浓度下蚯蚓的死亡数与死亡率(图5、图6)。由图5可知,在暴露7 d和14 d时,CK组的蚯蚓均未出现死亡。在不同CO2浓度下暴露7 d后,随着CO2浓度的增加蚯蚓死亡数随之增加,10%浓度组开始出现蚯蚓死亡,48%浓度组蚯蚓死亡率达到100%。当暴露时间为14 d时,蚯蚓死亡数呈现出与暴露7 d时相似的规律,但死亡率明显增加,在CO2浓度为40%时蚯蚓的死亡率已达100%。通过线性回归方法分析蚯蚓死亡率与CO2浓度的关系(图6)可知,受到高浓度CO2污染的土壤对蚯蚓产生了致死效应,土壤高浓度CO2对蚯蚓的7 d半致死浓度(7 d-LC50)和14 d半致死浓度(14 d-LC50)分别为26.39%和17.78%,LC50随染毒时间的延长而降低。
2.3 体腔细胞溶酶体中性红保留时间(NRRT)
在不同CO2浓度下,选择第6分钟拍照记录蚯蚓体腔细胞溶酶体染色情况(图7)。由图7可知,随着CO2浓度的增加,视野内体腔细胞的染色数量(红色)逐渐增加。

图2 暴露7 d时不同CO2浓度下蚯蚓的皮肤损伤情况注:(a). CK; (b). 10%; (c). 20%; (d). 30%; (e)~(f). 40%。Fig. 2 Skin damage of earthworms at different CO2 concentrations after 7 d of exposureNote: (a). CK; (b). 10%; (c). 20%; (d). 30%; (e)~(f). 40%.

图3 暴露7 d时不同CO2浓度下蚯蚓刚毛受损情况注:(a). CK; (b). 10%; (c). 30%; (d). 40%。Fig. 3 Setae damage of earthworms at different CO2 concentrations after 7 d of exposureNote: (a). CK; (b). 10%; (c). 30%; (d). 40%.

图4 暴露7 d后不同CO2浓度下蚯蚓表皮的变化注:(a). CK; (b). 10%; (c). 20%; (d). 30%; (e). 40%。Fig. 4 Epidermis changes of earthworms at different CO2 concentrations after 7 d of exposureNote: (a). CK; (b). 10%; (c). 20%; (d). 30%; (e). 40%.

图5 不同CO2浓度和暴露时间下蚯蚓的死亡数Fig. 5 Earthworm deaths at different CO2 concentration and exposure time

图6 不同CO2浓度和暴露时间下蚯蚓死亡率的变化Fig. 6 Changes of earthworm mortality under different CO2 concentration and exposure time
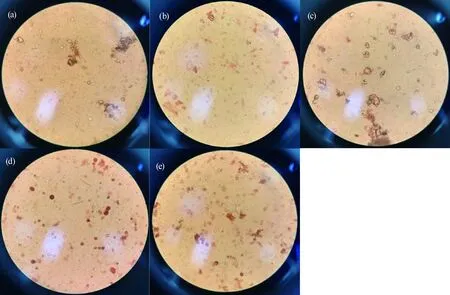
图7 暴露7 d时健康蚯蚓及暴露于不同CO2浓度土壤中的蚯蚓体细胞染色6 min时的情况注:(a). CK; (b). 10%; (c). 20%; (d). 30%; (e). 40%。Fig. 7 Staining conditions of earthworm cells at 6 min in healthy earthworms and earthworm exposed to soil with different CO2 concentrations after 7 dNote: (a). CK; (b). 10%; (c). 20%; (d). 30%; (e). 40%.
7 d组和14 d组在不同CO2浓度下存活蚯蚓的体腔细胞溶酶体NRRT结果如图8所示,由图8可知,当暴露时间相同时,随着CO2浓度的升高,体腔细胞溶酶体NRRT不断减小;当CO2浓度相同时,随着暴露时间的增加,体腔细胞溶酶体NRRT也会缩短。即随着CO2浓度的升高以及作用时间的增加,体腔细胞溶酶体NRRT不断减小,说明CO2对蚯蚓溶酶体膜的毒性作用在增强。
体腔细胞溶酶体NRRT抑制率(IRNRRT),表示在一定条件下,各种污染物对蚯蚓体腔细胞溶酶体正常功能的抑制作用,与污染物浓度呈正相关。NRRT抑制率与NRRT的关系可表达为:
IRNRRT(%)=(NRRTCK-NRRTCI)/NRRTCK
式中:IR为体腔细胞溶酶体NRRT抑制率(inhibition rate);NRRTCK为对照组体腔细胞溶酶体NRRT;NRRTCI为各实验组体腔细胞溶酶体NRRT。

图8 不同CO2浓度下暴露7 d和14 d时蚯蚓体细胞溶酶体的中性红保留时间(NRRT)Fig. 8 The neutral red retention time (NRRT) of earthworm somatic lysosomes exposed to different CO2 concentrations for 7 d and 14 d
在不同CO2浓度下分别暴露7 d和14 d后各处理组体腔细胞溶酶体NRRT抑制率如表2所示。在毒性实验中得到蚯蚓7 d-LC50和14 d-LC50的土壤CO2浓度分别为26.39%和17.78%,对比之下,当CO2浓度为10%时,蚯蚓7 d和14 d NRRT抑制率分别达到22.2%和41.2%,说明在蚯蚓个体发生死亡之前,蚯蚓体腔细胞溶酶体膜已受到损伤。
3 讨论(Discussion)
蚯蚓的体壁由角质层、表皮以及皮下的环肌层、纵肌层等组成。刚毛位于体壁内的刚毛囊中,围绕蚯蚓的体节排列,是辅助蚯蚓在土壤中移动的几丁质细胞器(chitinous organelles)[28-29]。刚毛结构的完整性对蚯蚓在土壤中的运动及其生态功能的发挥具有重要的作用。本研究表明,高浓度CO2破坏了蚯蚓的刚毛结构,其可能的原因是高浓度CO2抑制了几丁质的合成,迫使其结构发生部分或完全变形,同时刚毛受损会引起蚯蚓运动迟缓和掘穴能力减弱,这也解释了大多数蚯蚓死亡于土壤表面的现象。土壤作为蚯蚓生存的介质,与蚯蚓的表皮直接接触,高浓度CO2所导致的土壤pH降低、O2浓度减少和湿度降低等改变[30],可能会对蚯蚓的皮肤及表皮产生直接影响,造成蚯蚓皮肤不同程度的损伤、表皮裂隙和褶皱的明显变化。实验中还观察到蚯蚓发生了身体卷曲、生殖环带肿大、尾部串珠及断尾等异常运动及形态变化,此现象与刘馥雯等[31]在研究铬污染土壤稳定化处理对蚯蚓的毒性效应时和Nusair等[32]在研究二恶英(PCDD/Fs)对Eiseniaandrei蚯蚓的体表影响时所观察到的现象基本一致。这说明,高浓度CO2污染土壤后,蚯蚓会产生肉眼可见的中毒症状。这些现象可能是由于高浓度CO2对蚯蚓体壁微结构损伤的一种宏观表现。
在实验暴露7 d和14 d时,随着土壤CO2浓度的增加,蚯蚓死亡数与死亡率逐渐增加。蚯蚓从背孔分泌粘液保持皮肤湿润,通过皮肤进行呼吸。本研究表明,随着暴露浓度的增加和时间的延长,蚯蚓的体表变得干燥,其可能原因是高浓度CO2抑制了粘液的分泌;其次,蚯蚓的呼吸方式为有氧呼吸,当空气经皮肤吸入时,氧气被置换至循环系统的环状心脏,从而通过血液循环输送氧气并通过皮肤排除CO2[33]。高浓度CO2使蚯蚓皮肤受损,直接阻碍了蚯蚓呼吸时气体的交换,这在一定程度上抑制了蚯蚓的呼吸,不能为机体提供足够的能量,这时蚯蚓不得不依靠组织消耗提供能量,当组织消耗过度时导致蚯蚓死亡。此外,相比于内层种威廉腔环蚓,表层种赤子爱胜蚓也会食取少量的土壤微生物[34],因此土壤微生物的改变也会对蚯蚓产生影响。Pierce和Sjögersten[35]通过Asgard平台试验,证实了土壤的缺氧和酸化,对大型土壤动物(蚯蚓等)的生存不利,蚯蚓的活性受到抑制。Zhao等[36]对青海省平安县三合镇的天然CO2泄漏试验场的土壤动物的调查结果也表明,在CO2胁迫下,不同种类土壤动物的适应性和耐受性差异较大,其中,蚯蚓对土壤CO2浓度的变化表现最为敏感,随着CO2浓度的升高,生存率显著降低。

表2 不同CO2浓度和暴露时间下蚯蚓体腔细胞溶酶体膜NRRT抑制率(IRNRRT)Table 2 NRRT inhibition rate (IRNRRT) of lysosome membrane in earthworm lumen cells under different CO2 concentration and exposure time
溶酶体是一种几乎存在于所有动物细胞中的亚细胞器[37],对细胞内受损的细胞器、细胞碎片以及外部入侵的微生物的清除与循环利用发挥着重要作用[38],溶酶体的损害是其浓缩各种污染物的结果[39]。它可以表明一个有机体的健康状况,常用溶酶体NRRT来评估由污染物引起的溶酶体膜通透性(lysosomal membrane stability, LMS)的改变[40]。本研究结果表明,随着CO2浓度的增加和暴露时间的延长,NRRT逐渐变短,即CO2对蚯蚓的毒害作用随着CO2浓度的增加和时间的延长而增强。这种溶酶体膜通透性的增加甚至破坏,可导致组织蛋白酶和其他相关溶酶体水解酶的释放并进入胞浆,促进细胞程序死亡,被认为是一种细胞死亡的机制[41-43]。虽然此时在不同土壤CO2浓度下,仍有蚯蚓存活,但其健康状况已经受到了不同程度威胁。所以,尽管暴露于CO2浓度相对较低的污染土壤不一定导致蚯蚓死亡,但蚯蚓溶酶体膜通透性的变化是显著的。Moore等[44]和Fuchs等[45]学者的研究得出,溶酶体系统的改变通常被认为是蚯蚓暴露于污染物的第一反应,这种有害的溶酶体反应通常发生在细胞和组织病理学之前。也有研究人员证实,蚯蚓溶酶体膜的响应速度远远快于其生长、茧产量和茧活力等其他生理反应指标[46-47]。因此,蚯蚓体腔细胞溶酶体NRRT可用作指示地质封存CO2泄漏对蚯蚓种群产生不利影响的早期预警指标,为建立地质封存CO2泄漏近地表监测与识别提供技术参考。但由于溶酶体膜NRRT对CO2并非具有专一性,因此在蚯蚓取样时,应尽量避免其他导致同类现象的污染存在。
综上所述,尽管CO2泄露对土壤中蚯蚓的形态、生理及生存影响具有系统性特征,但其研究却具有明显的零散性特点,进一步进行高浓度CO2对蚯蚓的血象、酶活性、解剖及超微结构等影响的研究,则更有利于深化其影响的系统性机理认识和挖掘,也有助于利用蚯蚓寻找地质封存CO2泄漏近地表监测与识别的方法。

