镉对大型溞肠道结构及消化酶活力的影响
高菲,林威,王兰,王茜
山西大学生命科学学院,太原 030006
镉(cadmium, Cd)是一种生物体非必需的重金属元素,也是地表水中常见的有毒污染物之一,具有降解难、易转化和易富集的特点,对水生生态系统造成了严重的破坏。水环境中的重金属污染,尤其是淡水中的重金属污染已经成为包括我国在内的许多国家需要面对的严峻的环境问题[1]。根据淡水环境重金属污染状况的研究数据,我国七大水系表层沉积物中重金属污染程度为:Cd > Hg > Pb > As > Zn > Cr > Cu[2]。且我国多个湖泊的镉污染程度属于中度到重度,潜在生态风险系数最高,尤其是东部和中部湖泊的污染更加严重[3],近年来,长江流域沉积物中镉含量达1.7 mg·kg-1[4]。水体中的镉经食物链积累和放大作用,最终对人体产生影响,引发多种疾病甚至死亡。近年来,我国水体镉污染事件频发,对生态环境和人体健康造成了严重威胁,因此,引起了许多学者的重视[5]。
水体中的镉会随着食物进入水生动物肠道,肠道作为动物消化吸收营养物质的主要器官,也是机体生物转化和其他生理过程的关键结构,维持肠道结构的完整性对镉的吸收能起到至关重要的屏障作用[6]。研究表明,镉对果蝇(Drosophila)中肠上皮细胞具有损伤作用,对细胞核膜、线粒体和微绒毛等超微结构造成损伤,并显著促进中肠干细胞的增殖[7]。镉污染造成了黄鲈鱼(Pelteobagrusfulvidraco)肠道上皮细胞间隙扩张并出现空泡区域,对淀粉酶和脂肪酶活力有抑制作用,造成消化能力变弱,延缓生长[8]。镉对河南华溪蟹(Sinopotamonhenanense)的肠道上皮的微绒毛造成了显著的破坏,抑制华溪蟹肠道中淀粉酶和胃蛋白酶的活力[9]。因此,镉对肠道结构的破坏将影响动物对食物的消化、吸收[6],消化酶活力的高低可直接反映动物体消化能力的强弱,酶活力的变化被认为是检测早期水体重金属污染的潜在生物标志[10],可间接反映重金属对机体的危害程度。
大型溞(Daphniamagna)作为国际公认的毒理学实验动物,对于维持水生生态系统的稳定具有关键性作用[11]。大型溞体积小而透明,具有分布广、易于培养和生命周期短等特点,可以快速监测水体中的重金属和有害物质的污染状况,因此,常被广泛用作评价水生态环境中污染物风险的模式生物[12]。目前,对大型溞的研究主要集中于环境变化对其生长繁殖的影响及其应激反应等,而重金属镉对大型溞肠道的毒性影响报道很少,本实验以大型溞为实验材料,检测镉对大型溞肠道结构和消化酶活力的影响,旨在探索镉对大型溞肠道损伤的毒性机制,为水质监测提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
大型溞采自山西大学令德湖,在本实验室经过了至少三代以上的孤雌生殖培养,其敏感度确保已经达到中国国家标准《水质、物质对溞类(大型溞)急性毒性测定方法》(GB/T13266—91)[13]的要求,在玻璃缸中置于恒温培养箱中培养。水温控制在(20±1) ℃,pH为7.2,溶氧量为8.0~8.3 mg·L-1,光照周期光∶暗=16 h∶8 h,小球藻(Chlorella)来源于中国科学院水生生物所,小球藻浓度为5×105cells·mL-1,投喂量为20 mL·L-1,一周投喂2~3次小球藻。实验用水为曝气自来水。实验选择大小相近、运动活泼的大型溞为材料。
氯化镉(CdCl2·2.5H2O,分析纯,天津市博迪化工有限公司);中性树胶(北京索莱宝科技有限公司);琼脂粉、Bouin’s固定液、HE染液、石蜡、无水乙醇和二甲苯等为分析纯,均购自上海生工生物有限公司;蛋白质浓度(Bradford法)检测试剂盒,淀粉酶、脂肪酶和胰蛋白酶检测试剂盒均购自于南京建成生物工程研究所。
1.2 实验设计
依据国家《地表水环境质量标准》(GB3838—2002)[14]的Ⅴ类水质的镉浓度标准限值的1倍、5倍和9倍设置3个镉浓度组(0.01、0.05和0.09 mg·L-1)和1个对照组,分别处理24、48 h。配制1 g·L-1镉原液,再稀释成相应的镉浓度组,每组设3个平行。将实验前选好的含卵大型溞200~300只放入2 L烧杯中正常培养,18 h后取走母溞,24 h时选择个体大小基本一致的幼溞(一日龄)进行镉处理和对照实验。处理期间采取半静态的实验系统,与培养条件相同,24 h换水一次,每次换水50%,并维持各组镉浓度。实验期间不投喂食物。
1.3 肠道组织显微与亚显微结构的观察
显微结构观察:选择大小一致的一日龄幼溞,分别经0、0.01、0.05和0.09 mg·L-1的镉处理24、48 h。处理期间停止喂食。各浓度组取0.1 g一日龄幼溞,用Bouin’s固定液固定16 h,2%的琼脂预包埋,然后用乙醇进行由低到高的梯度脱水,之后用二甲苯透明处理,过夜浸蜡,常规石蜡包埋;Leica切片机连续切片,切片厚度为0.5 μm,HE染色,中性树胶封片保存。
亚显微结构观察:选择大小一致的一日龄幼溞,分别经0、0.01和0.09 mg·L-1的镉处理48 h。处理期间停止喂食。各浓度组取0.1 g一日龄幼溞,用戊二醛固定24 h,缓冲液漂洗后用2%琼脂预包埋,放入缓冲液中4 ℃保存,送至山西医科大学电镜室进行样品处理。之后进行电镜样品观察,拍照分析。
1.4 肠道消化酶活力的检测
选取一日龄幼溞分别在染毒24、48 h后取样,设置3个镉浓度组(0.01、0.05和0.09 mg·L-1)和1个空白对照组。按照试剂盒提供的步骤对淀粉酶、脂肪酶、胰蛋白酶活力和蛋白质浓度进行测定,计算出具体数值。
1.5 统计分析
运用SPSS 18.0统计学软件进行实验数据单因素分析,结果以3个平行组的平均值±标准差(Mean±SD)来表示,P<0.05、P<0.01表示差异显著。实验数据采用Dunnett’s检测计算以确定最低可观察效应浓度(LOEC)值。
2 结果(Results)
2.1 镉对大型溞肠道组织显微结构的影响
镉处理大型溞24、48 h后,观察肠道组织显微结构的变化(图1、图2)。大型溞正常肠道组织的上皮细胞排列紧密,呈圆柱形且界线明显,向肠腔内凸起形成纹状缘(图1(a)、2(a))。在镉浓度为0.01 mg·L-1时,上皮细胞排列略显松散,纹状缘膨胀增厚(图1(b)、图2(b))。在镉浓度为0.05、0.09 mg·L-1时,肠道上皮细胞界线模糊,细胞间出现断裂,且出现空泡化,纹状缘破裂(图1(c)、1(d),图2(c)、2(d))。从图1、图2可以看出,随着镉浓度的升高和处理时间的延长,肠道上皮细胞受到的损伤程度加剧。
2.2 镉对大型溞肠道组织亚显微结构的影响
镉胁迫下,大型溞肠道亚显微结构的变化如图3所示。对照组结果表明:肠道微绒毛形态结构正常,排列整齐规则(图3(a));线粒体呈规则的长椭圆形,外层膜平滑完整,内层膜折叠成规则的嵴,排列紧密,基质均匀浓厚(图3(d));基底膜细胞镶嵌连接紧密,细胞间隙很小(图3(g));微绒毛前有完整的围食膜,排列致密(图3(a))。0.01 mg·L-1低浓度镉处理组结果表明:肠道微绒毛排列疏松,开始变形、部分溶解(图3(b));线粒体肿胀,内部嵴结构疏松,开始出现嵴断裂、空泡区域的现象(图3(e));基底膜细胞间隙连接不紧密(图3(h))。0.09 mg·L-1高浓度镉处理组结果表明:肠道微绒毛损伤严重,排列紊乱,发生溶解、破裂,甚至消失(图3(c));线粒体被严重破坏,双层膜结构不完整,内部嵴溶解消失,空泡化严重(图3(f));基底膜镶嵌连接间隙扩张(图3(i));肠道围食膜疏松不完整,出现断裂(图3(c))。从对照组、低浓度和高浓度镉处理组的大型溞肠道超微结构损伤的分析可知,高浓度镉处理对大型溞肠道造成了更为严重的损伤。
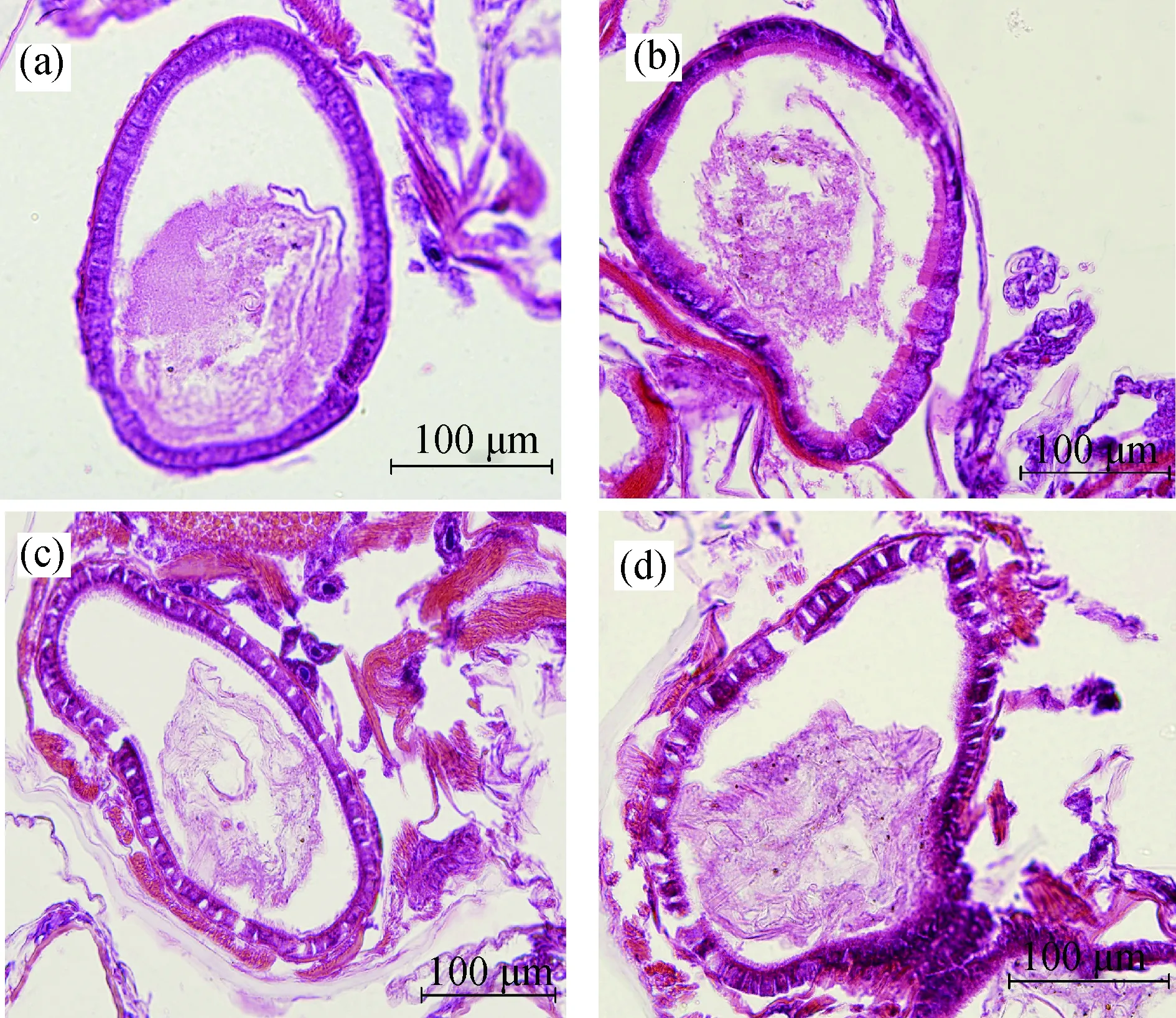
图1 镉胁迫24 h后大型溞肠道的显微结构注:(a)对照组;(b) 0.01 mg·L-1镉处理组;(c) 0.05 mg·L-1镉处理组;(d) 0.09 mg·L-1镉处理组。Fig. 1 The changes of intestine microscopic structure of D. magna exposed to cadmium for 24 hNote: (a) control group; (b) the cadmium 0.01 mg·L-1 group; (c) the cadmium 0.05 mg·L-1 group; (d) the cadmium 0.09 mg·L-1 group.
2.3 镉对大型溞淀粉酶活力的影响
由图4可知,镉处理对大型溞体内的淀粉酶活力产生了抑制作用。在处理24、48 h后各浓度组的淀粉酶活力均显著低于对照组(P<0.01)。从图4(a)和(b)中可以看出,24 h时大型溞在对照组和镉处理组中的淀粉酶活力均低于处理48 h时的对照组和处理组。由表1、表2可知,镉对大型溞肠道淀粉酶活力的LOEC为0.01 mg·L-1。
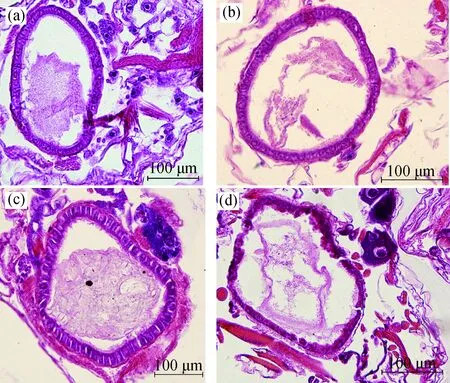
图2 镉胁迫48 h后大型溞肠道的显微结构注:(a)对照组;(b) 0.01 mg·L-1镉处理组;(c) 0.05 mg·L-1镉处理组;(d) 0.09 mg·L-1镉处理组。Fig. 2 The changes of intestine microscopic structure of D. magna exposed to cadmium for 48 hNote: (a) control group; (b) the cadmium 0.01 mg·L-1 group; (c) the cadmium 0.05 mg·L-1 group; (d) the cadmium 0.09 mg·L-1 group.

图3 镉对大型溞肠道亚显微结构的影响注:(a)、(d)、(g)为对照组;(b)、(e)、(h)为0.01 mg·L-1镉处理组;(c)、(f)、(i)为0.09 mg·L-1镉处理组;MV表示微绒毛,M表示线粒体,PTM表示围食膜,→指示细胞间隙。Fig. 3 The changes of intestine submicroscopic structure of D. magna exposed to cadmiumNote: (a), (d), (g) are figures of control group; (b), (e), (h) are figures of the cadmium 0.01 mg·L-1 group; (c), (f), (i) are figures of the cadmium 0.09 mg·L-1 group; MV stands for microvilli; M stands for mitochondria; PTM stands for the peritrophic membrane; → indicates intercellular spaces.

表1 镉胁迫24 h后大型溞消化酶活力实验数据统计分析表Table 1 The statistics of data of digestive enzyme activity in Daphnia magna exposed to cadmium for 24 h
注:*表示P<0.05,**表示P<0.01,差异显著。
Note: *, **mean significant difference atP<0.05,P<0.01 level.

表2 镉胁迫48 h后大型溞消化酶活力实验数据统计分析表Table 2 The statistics of data of digestive enzyme activity in Daphnia magna exposed to cadmium for 48 h
注:*表示P<0.05,**表示P<0.01,差异显著。
Note: *, **mean significant difference atP<0.05,P<0.01 level.

图4 镉对大型溞淀粉酶活力的影响注:(a)镉处理24 h;(b)镉处理48 h。Fig. 4 Effect of amylase activity of D. magna exposed to cadmiumNote: (a) cadmium treatment for 24 h; (b) cadmium treatment for 48 h.
2.4 镉对大型溞脂肪酶活力的影响
如图5所示,镉处理后大型溞脂肪酶活力先升高后降低,处理24 h后在0.01~0.05 mg·L-1之间均显著高于对照组(P<0.01),在0.09 mg·L-1时显著低于对照组(P<0.05)。处理48 h后,0.01~0.05 mg·L-1之间均显著高于对照组(P<0.01、P<0.05),且呈现下降趋势;在0.09 mg·L-1时和对照组无显著性差异。由表1、表2可知,镉对大型溞肠道脂肪酶活力的LOEC为0.01 mg·L-1。
2.5 镉对大型溞胰蛋白酶活力的影响
由图6可知,镉处理24 h后,浓度为0.01 mg·L-1时大型溞胰蛋白酶活力显著高于对照组(P<0.05),浓度为0.05、0.09 mg·L-1时和对照组相比无显著性差异。镉处理48 h后,各浓度组的胰蛋白酶活力均显著低于对照组(P<0.01),且呈下降趋势。由表1、表2可知,镉对大型溞肠道胰蛋白酶活力的LOEC为0.01 mg·L-1。
3 讨论(Discussion)
3.1 镉对大型溞肠道结构显微与亚显微结构的影响
大型溞属于滤食性动物,无专门的呼吸器官,因此,通过摄食从消化道进入和从体表经渗透作用进入是镉入侵机体的主要方式。研究发现,镉随食物进入体内蓄积的量比从体表经渗透作用吸收的量高[15],镉进入体内后易积累在中肠,随着循环系统输送到全身并在各器官积累,因此,肠道是受镉损伤的主要部位之一。早期的体外研究表明,肠道是限制镉吸收的主要屏障,肠道屏障在遭受破坏时镉的吸收会相应增加,表明了肠道在保护机体免受毒物损害过程中的作用至关重要[16]。肠道中的微绒毛能增加上皮游离面的吸收功能,更有利于食物的消化吸收[17]。楼哲丰等[7]研究发现,镉可破坏果蝇(Drosophila)肠道结构的完整性,降低肠道微绒毛的高度,且造成微绒毛脱落。参环毛蚓(Pheretimaaspergillum)受到镉胁迫后,肠道上皮细胞排列松散,微绒毛出现疏松、断裂的现象[18]。镉使隆线溞(Daphniacarinata)肠壁细胞的核膜破裂,核质外流,核仁变形;微绒毛溶解、变形[19]。本实验研究结果同样表明,镉胁迫大型溞24 h和48 h后,随着镉浓度的升高,肠道上皮细胞空泡化、微绒毛脱落均很严重,这些结构的改变将对消化系统的功能产生严重的影响。
线粒体是一种能有效为细胞生命活动提供所需能量的细胞器,是细胞的“动力车间”[20]。细胞间紧密的连接能更好地发挥其渗透调节功能,对维持组织的稳态环境具有重要意义[21]。本实验结果表明,除肠上皮细胞结构改变外,线粒体也出现嵴断裂、空泡化,同时细胞间隙扩张。隆线溞肠道线粒体在受到镉胁迫时会肿胀,嵴断裂、消失[19]。其他研究也表明,动物受到胁迫后肠道细胞间隙扩张[22]。线粒体结构的改变是由于镉胁迫后会产生过多的活性氧(ROS),导致机体的氧化损伤[23]。前期实验也发现,镉胁迫后大型溞总抗氧化能力(T-AOC)随镉浓度的升高呈上升趋势[24],T-AOC是衡量机体抗氧化系统和非酶促系统功能整体状况的综合性指标,能消除体内多余的活性氧和自由基。因此,T-AOC的升高表明体内有过多的活性氧,从而导致氧化损伤,进一步引起线粒体结构的损伤。镉诱导的氧化损伤也可改变Na+、K+-ATP酶活性,引起胞液中Na+的积累,从而增加细胞对水的渗透吸收,造成细胞肿胀,引起细胞排列不规则、间隙不紧密[25]。本实验中,高浓度镉胁迫下肠道上皮细胞出现了严重的细胞水样变性,进而出现空泡化。而当大型溞受镉胁迫后肠道屏障失去了保护机体的作用,会导致大量镉离子通过其体壁进入体内,并存留在肠上皮,对上皮细胞也造成损伤,从而降低了肠道内表面吸取营养物质的面积,导致养分汲取的能力也随之降低。这种破坏具有浓度依赖性,且造成的毒性可能是长期的。从而使动物的整体供能发生改变,无法进行正常的运动、摄食与消化。

图5 镉对大型溞脂肪酶活力的影响注:(a)镉处理24 h;(b)镉处理48 h。Fig. 5 Effect of lipase activity of D. magna exposed to cadmiumNote: (a) cadmium treatment for 24 h; (b) cadmium treatment for 48 h.
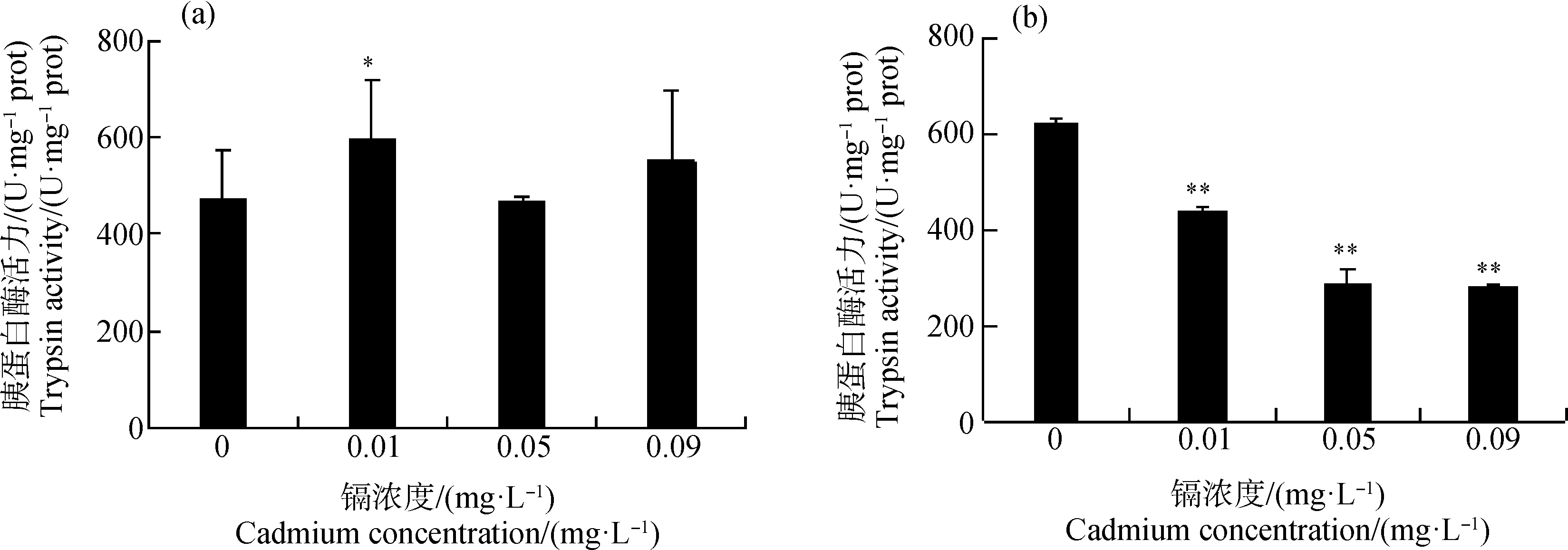
图6 镉对大型溞胰蛋白酶活力的影响注:(a)镉处理24 h;(b)镉处理48 h。Fig. 6 Effect of trypsin activity of D. magna exposed to cadmiumNote: (a) cadmium treatment for 24 h; (b) cadmium treatment for 48 h.
3.2 镉对大型溞肠道消化酶活力的影响
已有研究证实,枝角类的消化道内有蛋白酶、淀粉酶和酯酶等,淀粉酶在食物的消化过程中起着重要的生物学作用,动物摄入的碳水化合物在消化道内被淀粉酶分解成单糖,然后被机体进一步吸收利用。胰蛋白酶是一种活化酶,可以把动物体内的蛋白质分解为氨基酸,然后再被机体吸收和利用。本研究发现,镉暴露后,大型溞淀粉酶活力显著下降,且具有浓度-效应关系;镉处理48 h后,胰蛋白酶活力降低。这与Wu等[26]的研究结果相似,他们发现,镉、铜胁迫河南华溪蟹(Sinopotamonhenanense)后,肠道淀粉酶和胰蛋白酶活力降低。也有研究报道,镉胁迫三刺鱼(Gasterosteusaculeatus)后,淀粉酶和脂肪酶活力降低[27];镉、铜等对罗非鱼(tilapia)的淀粉酶和脂肪酶都有不同程度的抑制作用[28]。酶活力的降低会直接影响大分子物质的分解,消化能力变弱会降低机体对营养物质的吸收,从而影响动物体的生长发育,间接反映重金属对动物体的危害程度。动物体内各种消化酶的发生并不是完全同步的,而是随着机体的生长发育逐步演变和完善的,因此,肠道消化酶活力的变化与其食性和营养需求紧密相关[29]。本研究发现,对照组中48 h的大型溞肠道淀粉酶和胰蛋白酶活力比24 h的高,可能是随着机体生长,消化器官相对增大,内分泌机能增强,消化酶活力也相应增加。在大菱鲆(ScophthalmusmaximusL.)生长过程中,随着肠道的发育完善,消化酶的种类和活力大小发生着变化,蛋白酶和脂肪酶活力呈上升趋势;淀粉酶活力呈先升后降的趋势[29],体现了通过消化酶活力的改变来适应不同生长阶段机体对不同营养物质的需求。
水生动物对脂肪有较强的利用能力,是机体代谢过程中能量供应的有效来源,脂肪酶起着重要的分解作用。本研究发现,0.01~0.05 mg·L-1镉对大型溞肠道脂肪酶活力具有显著促进作用,而0.09 mg·L-1镉对脂肪酶活力产生抑制作用,脂肪酶活力出现了“低促高抑”的现象。在镉胁迫鱼虾后也出现了低浓度促进消化酶活力升高而高浓度抑制酶活力的现象[30],研究镉对泥蚶(Tegillarcagranosa)体内消化酶活力的影响时也发现,脂肪酶活力呈现“低促高抑”现象[31]。本研究中,镉胁迫后,淀粉酶、胰蛋白酶活力都被抑制;脂肪酶呈先升高后降低的趋势,低浓度镉可促进脂肪酶活力增高,可能是对机体产生了“毒性兴奋反应”,低浓度短时间内对脂肪的消化有促进作用;而随着镉浓度的升高,脂肪酶活力被抑制至低于对照组。这些酶活力的变化均表明,高浓度镉对大型溞消化系统的结构和功能产生了损伤作用。同时,镉对大型溞消化酶活力的LOEC为0.01 mg·L-1。与地表水中我国规定的工业废水中镉的最高排放浓度0.1 mg·L-1相比较而言,LOEC数值仅为标准的1/10,表明大型溞消化酶活力对水体中污染物反应灵敏,可作为镉污染水体的检测指标,实验结果将为管理部门制定有关污水排放标准提供依据。另外,镉对水生生态环境具有潜在和长远的影响,所以必须重视对重金属环境毒性的监测和评价。
综上所述,高浓度镉暴露破坏了大型溞肠道上皮细胞的显微和亚显微结构,对淀粉酶、脂肪酶和胰蛋白酶活力产生影响,从而对机体消化系统造成了严重损伤。本研究结果将为重金属镉对消化系统的损伤提供实验数据,进一步为镉抑制动物摄食提供实验依据,同时进一步明确了水生动物在重金属污染的水域生态环境监测中的作用,为监测水质污染、保护生态和防治镉中毒提供理论参考与科学依据。

