稀土Ce3+、 Sm 3+掺杂Ca3 S iO4 B r2的制备及发光性能研究
康 永
(榆林市瀚霆化工技术开发有限公司,陕西 榆林 718100)
物质吸收某一能量后,发射出比该能量低的光的现象称为发光[1]。稀土荧光粉中起发光作用的主要是其中的稀土离子,稀土元素的外层电子结构为4f0-145d0-16 s2,在制备的稀土荧光粉中,稀土元素通常是失去6s上的两个电子和4f上的一个电子形成三价的稀土离子[2-3]。由于4f 轨道的l=3,s=1/2,因此, 每个电子有14种独立的状态,产生各种能级,而E6S≤ E4f≤ E5d, 当用外界能量去激发稀土荧光粉时,荧光粉中的稀土离子4f 上的电子就可以在不同能级上跃迁。退激发时,由于稀土离子具有众多的光谱谱线,就可以发射出从紫外到可见光各种波长的光[4-8]。
制作白光LED的一个重要的成分是荧光粉,它在实现白光LED的过程中起着重要的作用。是一种新型的荧光粉,发光性质还不够透彻[9-16], Ce3+与 Sm3+之间的相互作用也不够明确,选择本课题进行相关的研究可以为后续开发制备此类荧光粉提供一些参考数据,对稀土荧光粉的研究具有一定的指导意义。
1.实验部分
1.1 实验试剂
本实验所用主要试剂如下表1所示。
表1 实验试剂
1.2 主要实验仪器
本实验所用主要仪器如下表2所示。

表2 实验仪器
1.3 样品的制备
1.3.1 样品溶胶—凝胶溶液的制备
首先,分别计算1 g Ca3-xS mxS iO4B r2、 Ca3-xC exS iO4B r2、Ca2.98-xS m0.02C exS iO4B r(2x=0.005,0.010,0.015,0.020,0.025,0.030,0.035,0.040,0.045,0.050,0.055,0.0 60,0.065,0.070,0.075,0.080,0.085,0.090,0.095,0.100)中所需原料Sm2O3、 CeO2、 CaCO3、正硅酸乙酯以及CaBr2• 2H2O的量。然后,按以下步骤制备样品湿凝胶:①称取所需稀土氧化物倒入干净的1号烧杯中;②用胶头滴管滴加少量浓硝酸(大概17滴)进行溶解,往烧杯中放入磁石,然后将烧杯放在磁力搅拌器上缓慢搅拌;③再用胶头滴管滴加氨水调节pH到7~8;④出现白色浑浊后加入10 mL的去离子水;⑤称取所需量的碳酸钙倒进干净的2号烧杯中,用胶头滴管滴加稀硝酸并用玻璃棒搅拌,当碳酸钙白色固体刚好全部溶解后停止滴加稀硝酸,将溶解在稀硝酸中的碳酸钙倒入1号烧杯中;⑥按所需量1.05倍称取二水合溴化钙倒入1号烧杯中;⑦在2号烧杯中倒入10 mL无水乙醇,摇晃洗涤后转移到1号烧杯中;⑧用胶头滴管滴加柠檬酸调节pH至3~4,并搅拌5 min;⑨再用移液管滴加正硅酸乙酯,继续搅拌8 min;⑩用氨水调节pH至7~8,加速搅拌13 min后制得乳白色的样品湿凝胶。按所需原料量重复以上步骤制得上述三种系列的荧光粉湿凝胶各6组。
1.3.2 样品湿凝胶的干燥
利用FN101-A型鼓风干燥箱对制备的湿凝胶溶液进行干燥,将样品湿凝胶溶液连同烧杯放在干燥箱中,设定温度为60 ℃,保温干燥3~4 d,待湿凝胶溶液干燥成白色的干凝胶后进行后续步骤。
1.3.3 样品烧结
样品的烧结采用的是SX2-6-13箱型电阻炉。首先将干燥后的白色干凝胶固体在玛瑙研钵中研碎,然后倒入小坩埚中,再放入马弗炉中。打开电源,设定温度为400 ℃,达到设定温度后计时, 保温预烧 2h。冷却后用研钵再次研碎放入小坩埚,采用碳粉还原的方式,将小坩埚放进加有过量碳粉的大坩埚中,盖上大坩埚盖子,最后一起放入马弗炉中。设定烧结温度,温度到达指定温度后烧结 3h,冷却后在玛瑙中研碎得到荧光粉。
1.4 样品测试
在室温下,采用D8 Advance型X射线粉末衍射仪对荧光粉样品的物相结构进行分析(辐射源为Cu Κα线,λ=0.154056 nm,工作电压40 kV,工作电流40 mA,10º≤2θ≤80º,扫描速度10º/min); 采用F-4500型荧光分光光度计对样品荧光光谱进行测试(光源是150 W氙灯,工作电压为700 V,激发和发射的狭缝都是5 nm)。
2.实验结果与讨论
2.1 样品X射线衍射谱分析
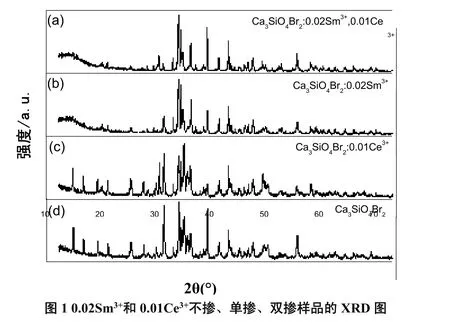
图1(a,b,c,d)是采用Cu靶的Kα收集到的4个代表性样品的XRD图谱,4个样品均是在950 ℃下烧结3 h得到的。由于在标准PDF卡片库中未找到的PDF标准卡片,故无法与标准卡片进行比较。从(a)、(b)、(c)、(d)四个图可以看出他们的衍射图谱基本相似,并且(a)、(b)、(c) 三个图Sm3+和Ce3+单、双掺样品的X射线衍射图谱的衍射峰与不掺稀土离子的基质的衍射峰基本吻合。由此说明,在950℃制备的荧光粉样品中,向基质中掺杂少量Sm3+和 Ce3+,基质的物相结构基本不会改变。

2.2 样品荧光光谱分析
2.2.1 制备温度对Ca3SiO4Br2: 0.02Sm3+荧光粉发光强度的影响
图2为480 nm蓝光激发下,不同温度(800 ℃、850℃、900 ℃、950 ℃、1000 ℃、1050 ℃)烧结的的发射光谱图。从发射光谱可以看出,制备温度的变化不会改变发射光谱的形状,但会影响发射光的强度。荧光粉样品的发光强度随着制备温度的升高先增大后减少,并且在950 ℃下制备的荧光粉样品发光强度达到最大。因为950 ℃制备的样品,少量的Ce3+和Sm3+的掺杂基本不会改变基质的物相结构,并且该温度制备的荧光粉发光强度最大,所以后续分析的都是低于950 ℃制备的荧光粉样品。
2.2.2 单掺、双掺荧光光谱比较
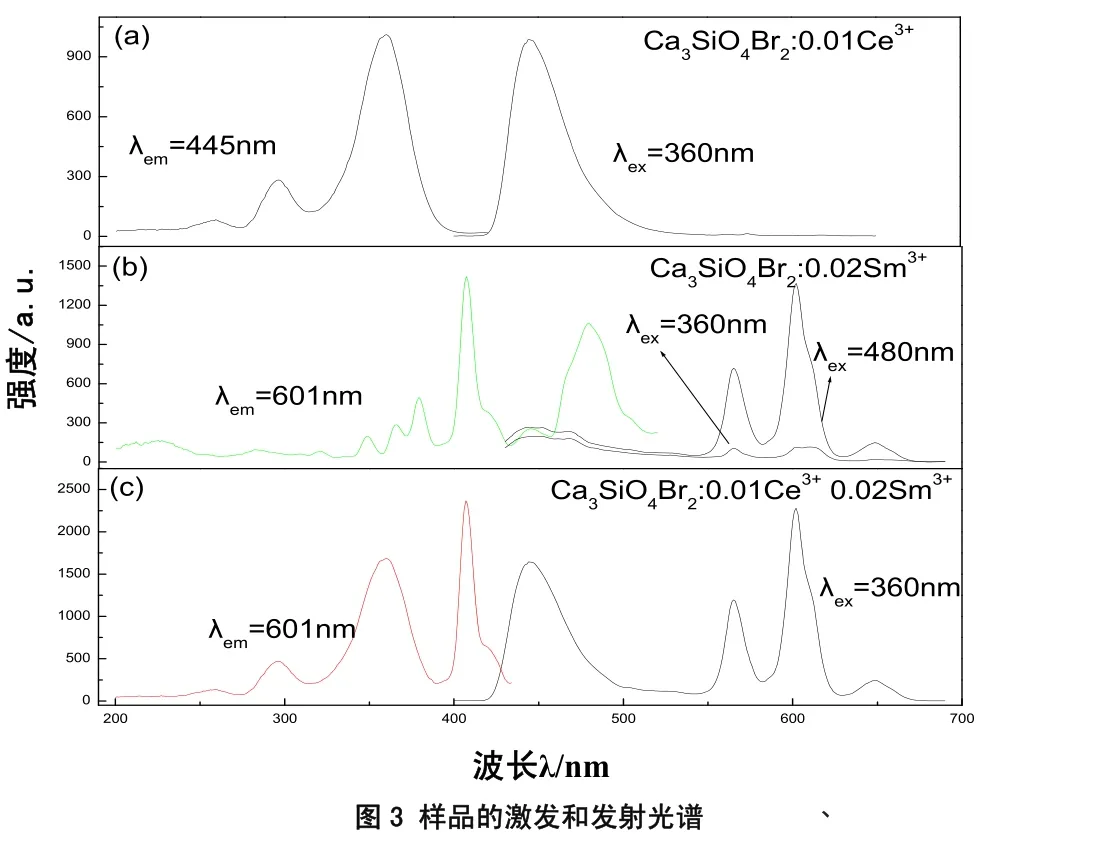
通过对比图3(a)中Ce3+的发射峰与图3(b)中Sm3+激发峰可以看出,在400~520 nm之间, Ce3+发射峰与Sm3+的激发峰存在着明显重叠,因此, 可能存在着Ce3+→Sm3+的能量传递。

2.2.3 Ce3+浓度对Ca3-xCexSiO4Br32发射强度的影响
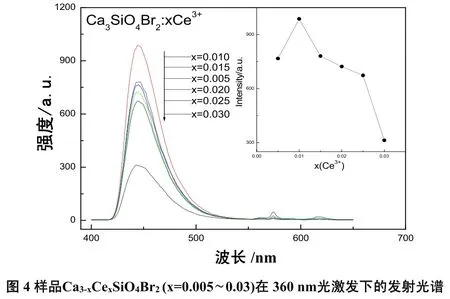
制备的Ca3-xC exS iO4B r2(x=0.005,0.010,0.015,0.020,0.025,0.030)系列样品在360 nm光激发下测试的发射光谱如图4所示。各个发射光谱的形状相似,发射峰峰位一致,但荧光粉发光强度却随着Ce3+浓度x的增加,先增大后减少,在掺入的的浓度 x=0.010时,荧光粉发光强度达到最大。
2.2.4 Sm3+浓度对发射强度的影响
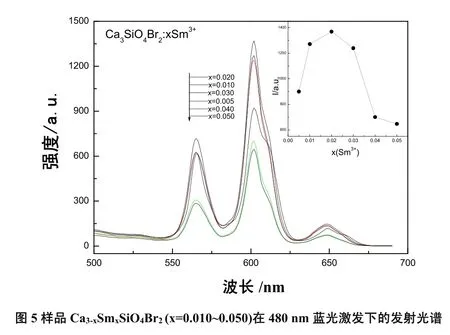
制备的Ca3-xS mxS iO4Br2(x=0.005,0.010,0.020,0.030,0.040,0.050)系列样品在480 nm蓝光激发下测试的发射光谱如图5所示。各个荧光粉发射光谱的形状彼此相似,但荧光粉的发光强度却随着掺入的Sm3+浓度x的增加,先增大后减少,并且在掺入的Sm3+浓度x=0.020时发光强度达到最大。
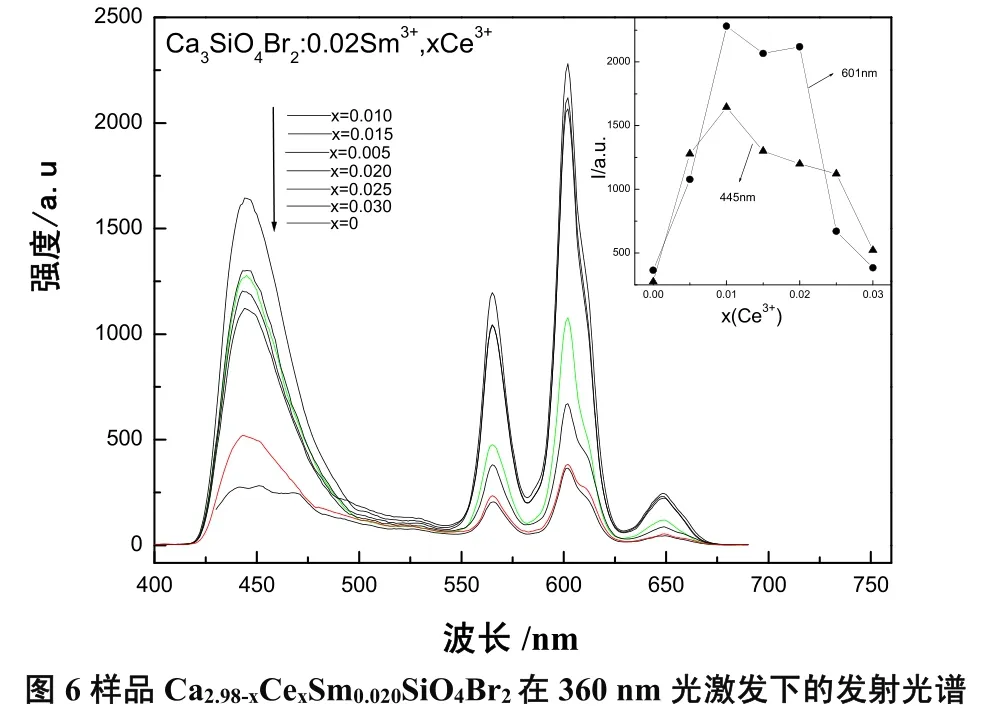
2.2.5 Ce3+浓度对发射强度的影响
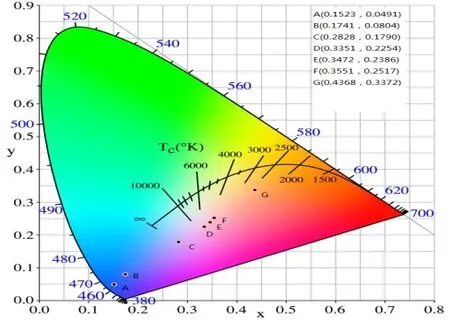
2.3 CIE色坐标分析

3.结论
(2)制备温度对稀土荧光粉的发光强度具有重要的影响,但不会改变稀土荧光粉的光谱形状。在基质中掺杂Sm3+的荧光粉,发光强度随着制备温度的升高,先增大后减小,并且在950 ℃下制备的荧光粉样品的发光强度最大。
(4)Ce3+→ Sm3+之间具有比较显著的能量传递,适量的Ce3+的掺入会显著地提高Sm3+的发光强度。然而当掺入的Ce3+的量过高时,不但不会提高发光强度,反而会出现抑制发光的现象。浓度过高会导致稀土离子之间的距离变近,离子之间的作用加强,导致能量转移。
(5)样品CIE色坐标分析表明,改变Ce3+、 Sm3+的浓度可以实现蓝光—蓝紫光—红光的发射,复合上一定强度的黄绿光可以实现白光发射,可以应用在白光LED上。

