ZNF772基因启动子区DNA甲基化及其表达与宫颈癌的相关性
李 萌,李 鸥,孙 金,郑 雪,马 冬,3
1华北理工大学研究生学院,河北唐山 063200 2唐山市工人医院妇二科,河北唐山 063000 3华北理工大学公共卫生学院,河北唐山 063200
宫颈癌的发病率趋势尽管略有下降,但死亡率仍未能下降[1]。宫颈癌的晚期治疗及预后效果仍然不佳,提示早期诊断十分重要。持续的高危型人乳头瘤病毒(human papillomavirus,HPV)感染(主要是16和18亚型)被认为是宫颈癌发生的主要原因,但并非所有的HPV病毒感染患者都发展为宫颈癌[2]。目前研究显示,宫颈癌发生需要多因素协同作用,但发病机制尚不清楚。DNA甲基化作为癌症发生的早期事件,即DNA高甲基化导致抑癌基因失活[3],这为宫颈癌的早期诊断提供新的途径。锌指蛋白(zinc finger protein,ZNF)是一类具有锌指结构的转录因子[4],且已有多个锌指蛋白家族亚型与宫颈癌的发生密切相关。ZNF772是锌指蛋白家族的一个成员,目前已有研究报道ZNF772基因下调与下颌癌有关[5],然而ZNF772在宫颈癌中的研究报道较少。因此,本研究通过收集更多临床样本,检测ZNF772基因启动子区这些位点的DNA甲基化状态、基因表达和临床意义,探讨其DNA甲基化与基因表达的相关性,为宫颈癌的诊治提供新的分子靶点。
对象和方法
对象选取2015年9月至2018年9月在唐山市工人医院接受子宫切除手术或宫颈组织活检的患者85例,其中因良性子宫疾病行子宫全切除术的正常宫颈组织患者45例为对照组、宫颈鳞癌患者40例为宫颈鳞状细胞癌(cervical squamous cell carcinoma,SCC)组。SCC组纳入标准:(1) 临床资料完整;(2)病理明确诊断为SCC;(3)术前未接受过放、化疗。排除标准:(1)术前 3个月内曾行宫颈治疗,如阴道用药、激光治疗等;(2)患者为妊娠状态;(3) 同时合并其他妇科恶性肿瘤,如子宫内膜癌、卵巢癌等;(4)同时合并其他脏器肿瘤,如肠道、乳腺肿瘤等。对照组纳入标准:宫颈薄层液基细胞学检查未见非典型鳞状细胞或癌细胞。排除标准与SCC组相同。所取标本均经唐山市工人医院病理科技师证实,且取材前均未行放、化疗或免疫治疗。标本收集后部分于-80 ℃冰箱保存。所有标本取材患者知情同意,本研究经唐山市工人医院伦理委员会批准。40例SCC患者的一般情况信息通过查阅患者电子病例收集,患者年龄为(51.94±4.44)岁;选择HPV16/18型为筛查对象,阳性患者29例、阴性患者11例。病理类型及分型按世界卫生组织(World Health Organization,WHO)病理分级(2003版),高度分化13例、中低分化27例,病理类型均为鳞癌;临床分期按2009年国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)标准分期[6],Ⅰ期标本24例、Ⅱ期标本16例。根据肿瘤大小进一步分组分析,在宫颈癌ⅠB~ⅡA期,与≤4 cm组(14例)比较,>4 cm组(26例)分期较晚,临床分期越高,预后越差[7]。
基因组DNA和总RNA提取采用饱和酚-氯仿抽提法提取正常宫颈组织和宫颈鳞癌组织基因组DNA,Trizol法提取总RNA,1.5%琼脂糖凝胶电泳鉴定 DNA 和总RNA完整性。
宫颈组织中ZNF772基因启动子甲基化修饰情况的全基因组重亚硫酸盐测序和RNA测序联合检测检测3例宫颈鳞癌组织ⅠA1期组织和年龄相匹配的3例正常宫颈组织的基因组DNA和总RNA,送天津麦基生物信息科技有限公司完成DNA甲基化和RNA测序。用Integrated Genome Browser对这些数据进行可视化分析,比对基因组版本为GRCh37/hg19[8]。根据可视化分析结果确定ZNF772基因上DNA差异甲基化修饰区域,再对该区域内各CpG位点的甲基化百分比进行表征。RNA测序检测结果采用热图分析表达差异[9]。
免疫组织化学检测宫颈组织中ZNF772蛋白表达所有标本均经4%多聚甲醛固定,石蜡包埋并切片4 μm。免疫组织化学采用SP法按说明书进行。随机选取5个癌巢内的视野,通过Image-Pro Plus 6.0软件(美国 Media Cybernetic 图像技术公司)分析棕色颗粒在整个视野内所占的百分比。
亚硫酸盐化测序PCR 反应检测ZNF772基因启动子区的甲基化状态采用EZ DNA甲基化检测试剂盒对宫颈组织中提取的基因组DNA进行甲基化修饰及纯化。亚硫酸盐化测序PCR(bisulfite sequencing polymerase chain reaction,BSP)检测引物上游序列为5’-TATGGTGTTTGGAGTTTTTTTT-3’,下游序列为5’-AAATCAACTATCCAAAACCCA-3’,PCR产物长度368 bp。扩增反应条件:95 ℃ 10 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,2个循环;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,30个循环,72 ℃ 5 min。PCR产物送至上海生工生物工程公司进行序列测评。将测得序列进行比较,判断CpG位点是否发生甲基化,以CG序列判为甲基化,TG判为非甲基化,重叠序列判为甲基化。
实时荧光定量PCR检测ZNF772基因mRNA表达使用Trizol法提取液氮保存的宫颈组织中的总RNA,运用逆转录试剂盒合成cDNA,采用SYBGreen染料试剂盒进行PCR反应。目的基因ZNF772上游引物序列为5’-GACCCTATACAGGGGCAGGT-3’,下游引物序列为5’-GTGGCAACAGCTAGGGTCAT-3’。GAPDH引物进行内参的扩增,上游5’-GAGAGGGAAATCGTGCGTGAC-3’,下游5’CATCTGCTGCAAGGTGGACA-3’。PCR 反应条件:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 20 s,72 ℃ 35 s,共35个循环。所有反应重复3次,用公式2-△△Ct循环阈值法将ZNF772 mRNA的相对表达水平归一化为内参GADPH的相对表达水平。
转录因子结合位点序列分析转录因子的结合DNA序列位点的分析采用TFSEARCH软件、Promoterscan软件和在线AliBaba 2.1分析工具[10-11]。
结 果
ZNF772基因启动子甲基化修饰和mRNA表达Methprimer CpG岛预测软件(http://www.urogene.org/methprimer/index1.html)对ZNF772基因启动子区序列(NC_000019.10)进行预测,结果显示在该基因上游大约1000 bp的启动子区可见5个CpG位点,覆盖长度为692 bp,位于19号染色体上。通过全基因组重亚硫酸盐测序筛查分析显示,在SCC中ZNF772基因启动子区-237、-257、-377、-420、-422位点DNA甲基化率升高(分别为66%、33%、66%、100%、66%)(图1)。RNA测序和实时荧光定量PCR检测结果显示,与对照组相比,在SCC中ZNF772的mRNA表达下调,差异有统计学意义(1.35±0.21 比 0.43±0.18,t=8.351,P=0.016)(图2)。
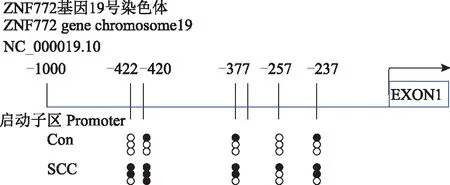
WGBS:全基因组重亚硫酸盐测序;Con:对照组;SCC:宫颈鳞状细胞癌组;EXON1:外显子1;甲基化的程度用黑色圆点个数表示:只有白色圆点,0%;1个约为33%;2个约为66%;3个为100%
WGBS:whole-genome bisulfite sequencing;Con:control group;SCC:cervical squamous cell carcinoma group;EXON1:extron 1;the degree of methylation is expressed in terms of black dots:only white dots,0%;one is about 33%;two is about 66%;three is 100%
图1WGBS检测ZNF772基因启动子有5个位点的甲基化修饰结果
Fig1Methylation of five loci in ZNF772 gene promoter (detected by WGBS)
宫颈癌组织中ZNF772的蛋白表达ZNF772作为核蛋白发挥转录功能时免疫组织化学染色可见细胞核呈棕黄色颗粒。为了进一步确定在SCC组织中ZNF772的蛋白表达水平变化及其细胞定位,采用免疫组织化学进行染色观察,结果显示与对照组比较,ZNF772蛋白表达在SCC组织细胞中表达缺失[(81.23±9.02)%比(10.00±3.05)%,t=3.802,P=0.005](图3)。
宫颈组织中ZNF772基因的DNA甲基化为进一步验证SCC中ZNF772基因启动子的DNA甲基化状态,采用BSP方法验证SCC组织中ZNF772基因启动子5个重要位点的甲基化率,结果显示与对照组比较,SCC中ZNF772基因启动子区-237、-257、-377位点DNA甲基化率差异无统计学意义(P=0.693,P=0.712,P=0.323);而-420、-422位点甲基化率均显著升高(P=0.038,P=0.043)(表1)。
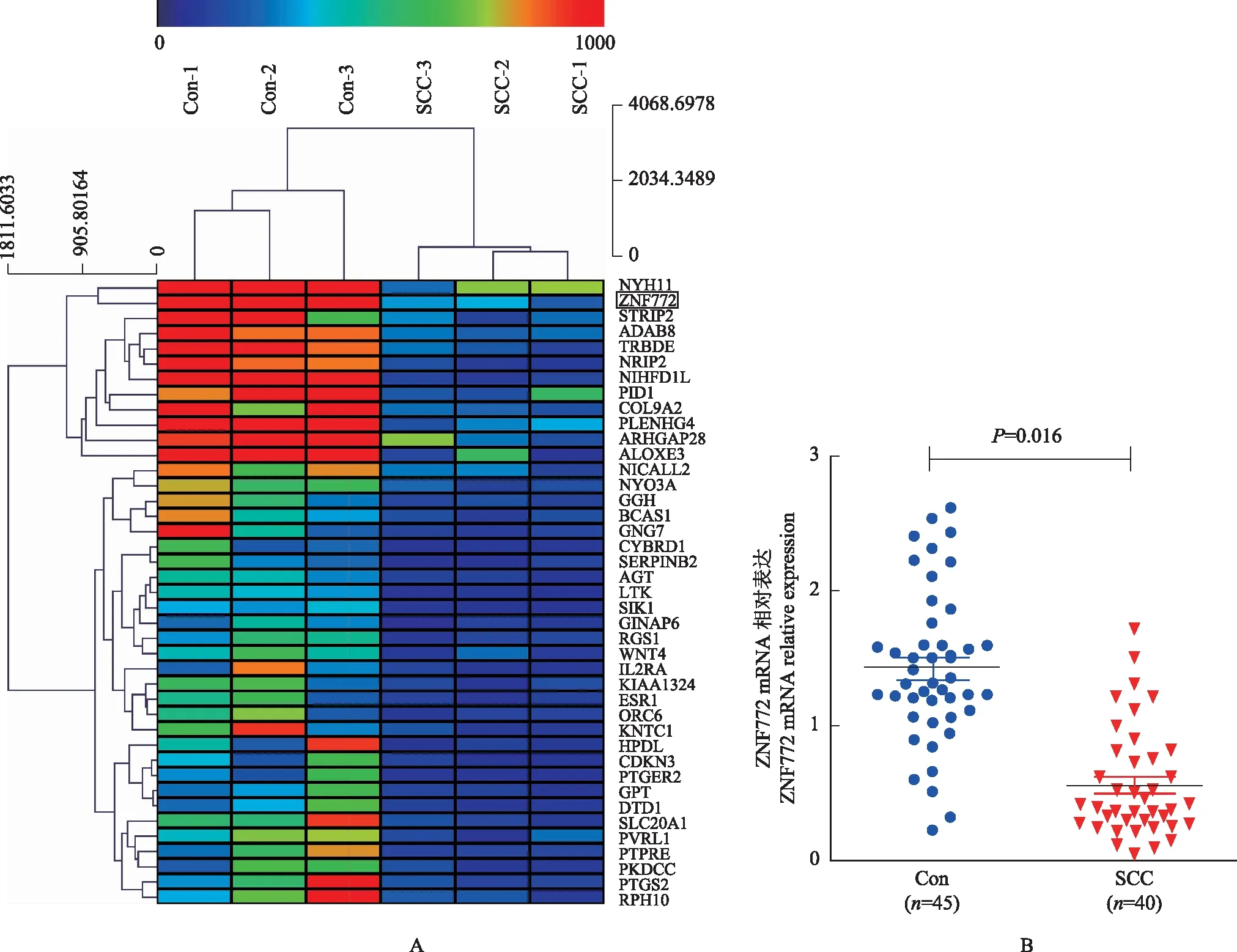
图2转录组测序(A)及实时荧光定量PCR(B)检测宫颈组织中ZNF772的mRNA表达
Fig2mRNA expression of ZNF772 in cervical tissues [detected by RNA sequencing (A) and real-time quantitative polymerase chain reaction (B)]

A.正常宫颈组织;B.宫颈鳞状细胞癌组织
A.normal cervical tissue;B.cervical squamous cell carcinoma tissue
图3免疫组织化学方法检测ZNF772在宫颈组织中的表达
Fig3Expression of ZNF772 in cervical tissues (by immunohistochemistry)

表1 两组宫颈组织ZNF772基因启动子-237、-257、-377、-420、-422位点甲基化率的比较[n(%)]Table 1 Methylation rates in ZNF772 gene promoters -237,-257,-377,-420,and -422 loci in cervical tissues of two groups [n(%)]
宫颈组织中ZNF772基因的mRNA表达与其DNA甲基化的相关性在SCC组织中ZNF772基因启动子区-420CpG位点DNA甲基化修饰最为显著,这可能导致该基因的转录沉默。Spearman相关性分析结果显示,在对照组中,9例-420CpG、10例-422CpG位点甲基化和36、35例未发生甲基化的mRNA表达水平比较,差异无统计学意义(t=0.328,P=0.375;t=0.092,P=0.526),ZNF772的mRNA表达与-420CpG、-422CpG位点DNA甲基化修饰无相关性(r=-0.051,P=0.745;r=-0.079,P=0.528);在SCC中,26例-420CpG、25例-422CpG位点甲基化和14、15例未发生甲基化的mRNA表达水平比较,差异具有统计学意义(t=7.516,P=0.024;t=6.378,P=0.035),ZNF772的mRNA表达与-420CpG、-422CpG位点DNA甲基化修饰呈负相关性(r=-0.351,P=0.045;r=-0.349,P=0.032)(图4)。此外,ZNF772基因-420CpG位点的甲基化状态与HPV DNA阳性感染、肿瘤大小、病理分级和临床分期相关(P=0.018,P=0.012,P=0.009,P=0.035)(表2),但与年龄无关(t=0.849,P=0.237)。
讨 论
锌指蛋白数量大、功能广,与多种人类肿瘤相关。其家族亚型广泛参与癌症的发生发展过程,以类似癌基因或抑癌基因的功能发挥作用[12-13]。近年来,锌指蛋白一直是分子生物学的研究热点,已发现多个亚型的异常表达与宫颈癌的发生发展相关。目前国内研究报道ZNF84、ZNF217、ZNF268、ZNF711在宫颈癌组织中表达均升高,ZNF545和ZNF582在宫颈癌组织中低表达[14-20];国外研究显示ZNF582高DNA甲基化与宫颈腺癌相关[21];高甲基化导致的ZNF516表达下调与宫颈癌相关[22]。作为真核生物中重要的转录因子,其生物学功能主要通过影响靶基因的调控参与肿瘤细胞的增殖、分化、凋亡及侵袭转移作用[23]。
目前仅有1篇研究报道采用外显子测序法筛查分析发现ZNF772基因在下颌癌中表达下调[5],然而并未深入研究,而且其在宫颈癌中的表达情况及其作用尚不清楚。本研究结果显示,ZNF772表达在正常宫颈组织中高表达,在宫颈癌组织中表达显著降低,并且随着宫颈癌肿瘤的大小、分化程度及临床分期的进展,ZNF772的表达显著降低,提示其表达下调可能参与了宫颈癌发生发展过程,ZNF772可能发挥抑癌作用。

图4宫颈组织中ZNF772基因-420CpG(A)和-422CpG(B)位点甲基化与其mRNA表达的关系
Fig4Relationship between methylation of ZNF772-420CpG (A) and-422CpG (B) loci and mRNA expression in cervical tissues

表2 在SCC中-420CpG位点DNA甲基化与临床病理特征的关系[n(%)]Table 2 Correlations of DNA methylation at-420CpG locus in SCC with the clinicopathological features of cervical cancer [n(%)]
HPV:人乳头瘤病毒
HPV:human papillomavirus
有研究表明,HPV感染与基因的表观遗传改变对宫颈癌发展的协同促进效应,其中 DNA甲基化影响机体免疫系统从而参与HPV感染的分子机制相对清楚[24-25]。DNA 甲基化作为表观遗传修饰之一,其修饰并不改变一级结构,是一种可逆的改变,故可通过改变甲基化状态上调抑癌基因表达发挥肿瘤基因靶向治疗的作用。本研究对ZNF772基因的DNA甲基化状态及mRNA和蛋白表达进行分析,结果表明宫颈癌患者ZNF772基因启动子区-420、-422位点均出现较高的甲基化状态,在SCC组织中mRNA和蛋白表达下降,且mRNA的表达与DNA甲基化状态呈负相关。提示启动子区高甲基化导致其 mRNA 表达降低,进而影响蛋白表达和生物学功能变化,从而促使宫颈癌的发生发展。
DNA甲基化引起基因转录抑制的机制主要有3种,即直接作用模式(结合位点DNA 甲基化导致相应转录因子不能识别与结合)、间接作用模式(序列特异性的甲基化 DNA 结合蛋白与启动子区甲基化CpG岛结合,募集一些蛋白,形成转录抑制复合物,从而阻止转录因子与启动子区的靶序列结合,进而影响基因转录)和改变染色质结构模式(DNA的甲基化致使染色质结构改变,抑制基因表达)[26]。本研究通过基因启动子序列的转录因子结合位点预测发现,ZNF772基因启动子区可能包含KLF5、KLF4和RUNX23转录因子结合域,而-420、-422位点与KLF5、KLF4顺式作用元件重合,提示在宫颈癌组织中ZNF772基因启动子区-420、-422位点的高甲基化状态抑制基因表达,一种可能的机制是DNA甲基化直接干扰特异转录因子与各自启动子的识别位点结合,从而抑制基因的转录表达。
HPV检测联合细胞学检查是临床早期发现子宫颈癌的重要手段,但HPV检测缺乏特异性,因此需要一个有效的监测手段[27]。本研究从临床角度证实ZNF772在SCC中表达下调与启动子区高度DNA甲基化相关,虽然缺少SCC发生、发展的分子机制及细胞生物学功能验证的研究,但是该基因启动子区的DNA高甲基化状态与SCC的高危型HPV16/18型感染、肿瘤大小、WHO病理分级及FIGO临床分期相关,但随着FIGO分期升高,甲基化阳性率下降,ZNF772启动子高甲基化可能并非肿瘤癌变的结果,而是宫颈癌变中的早期事件。肿块大于4 cm组甲基化阳性率高,WHO病理分级高、中分化组低于低分化组,ZNF772基因的高甲基化的出现有可能促使宫颈癌恶性进展,提示ZNF772基因在SCC中下调的甲基化调控机制研究在诊断和治疗方面具有重要意义,为宫颈癌的早期筛查和诊治提供了新型分子标志物。
尽管本研究显示ZNF772基因的DNA甲基化影响其表达从而参与宫颈癌变过程,但是仍有以下限制:(1)SCC病例数相对较少,需进一步扩大样本量以支持课题组结论;(2)研究对照尽可能取自SCC患者病灶远端正常宫颈组织;(3)临床收集宫颈癌前病变组织,同时观察该组织中ZNF772基因的DNA甲基化及其表达的变化;(4)通过长期随诊,考察ZNF772阳性的宫颈癌患者预后情况,为临床提供更多的指导意义。

