氯酸钾分解制氧气催化剂活性的研究
龙冬梅,员蓉,伏彩彩,周孝伟,毛泽川,梁永锋
(宁夏师范学院化学化工学院,宁夏固原756000)
氧气是人体进行新陈代谢的关键物质,人体生命活动离不开氧。通过呼吸作用把外界的氧转化为人体内可利用的氧,称为血氧。血液携带血氧向全身输入能源,血氧的输送量与心脏、大脑的工作状态密切相关,心脏泵血能力越强,血氧的含量就越高[1];心脏冠状动脉的输血能力越强,血氧输送到心脑及全身的浓度就越高,人体重要器官的运行状态就越好[2-3]。分解氯酸钾是制取氧气的一种常用方法,利用该方法制取氧气需要催化剂,但在实际应用中发现用二氧化锰作为催化剂有明显的不足。因此,重新选择对氯酸钾分解制氧气催化效果好的催化剂,在实际应用中具有重要的意义。
1 用二氧化锰作为氯酸钾分解制取氧气催化剂的不足
一般情况下,氯酸钾加热时发生下列歧化反应:
只有在催化剂的作用下,氯酸钾加热才能分解为氯化钾和氧气,目前文献中介绍氯酸钾制氧气的催化剂是二氧化锰。二氧化锰催化氯酸钾分解制取氧气的化学反应是:
实验中发现,用二氧化锰作催化剂,催化氯酸钾分解除能够发生上述反应外,同时还有下列副反应发生:
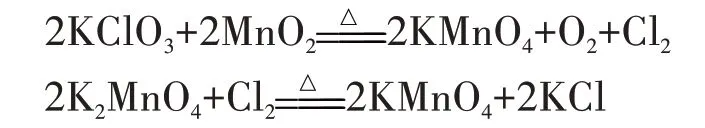
由于有副产物氯气生成,一是导致收集的氧气纯度不高;二是制取过程中收集到的氧气带有白雾[4],且有较浓的刺激性气味;三是对环境造成污染;四是氧气逸出的速率不好控制[5]。
另外,MnO2是化学实验室常用的化学试剂之一,具有氧化性。虽然一般情况下,MnO2非常稳定,但与易燃物放置一起,容易引发燃烧或爆炸;实验过程中若MnO2与眼睛直接接触会造成损伤,侵入机体可造成脑部损伤。
2 氯酸钾分解制取催化剂活性比较
2.1 氯酸钾制氧气催化剂活性比较
催化剂活性比较是一个复杂的问题,设计到许多方面。在中学化学教学中,采用相同条件下,制取相同体积的氧气所用的时间来衡量,用时越短,表明反应速率越快,催化剂活性越高。
2.1.1 实验仪器和试剂
硬质大试管(420×150)数支、500 mL 量筒、水槽、酒精灯、铁架台、导气管、单孔橡皮塞、电子分析天平等,氯酸钾(AR)及催化剂(二氧化锰及替代品)、淀粉试纸等。
2.1.2 实验方法
(1)氧气的制取方法。准确称取经过重结晶的氯酸钾1 g 和催化剂各1 g,充分混合后装入大试管,先给试管均匀加热,当气体排放连续后用排水集气法收集气体,并开始计时,仔细观察实验现象。实验结束后用淀粉碘化钾试纸对气体进行检验。
(2)催化剂的回收。实验结束后,待试管完全冷却后,用蒸馏水溶解试管中的剩余物质,过滤,将滤渣在坩埚中灼烧,冷却后称量回收的催化剂的质量。
2.1.3 实验结果
实验结果见表1。

表1 氯酸钾制氧气催化剂活性Tab.1 Oxygen catalyst activity of potassium chlorate
实验结果表明,若从生成200 mL 氧气所用的时间来 看 ,催 化 剂 的 活 性 依 次 为 :P2O5>CrO3>Fe2O3>Cr2O3>NaHSO4>MoO3>MnSO4>V2O5>PbO>CuO>PbO2>ZnO>MnO2>MgO>Al2(SO4)3>CaO>Al2O3。
2.2 催化剂种类对氯酸钾分解反应催化活性的影响
按照2.1.2 的实验方法,选用不同的催化剂进行试验,实验结果见图1。
图1 表明,除二氧化锰外,氧化钙等其余16 种常见化学试剂对氯酸钾分解制氧气均具有催化效果。若按照开始生成氧气(50 mL)所用的时间来看,其催化活性依 次 为 :P2O5>CrO3>Cr2O3>NaHSO4>Fe2O3>MoO3>MnSO4>V2O5>MnO2>CuO>PbO2>PbO>Al2O3>Al2(SO4)3>ZnO>MgO>CaO;但是当收集到氧气体积大于50 mL时,Al2O3的催化效果明显开始下降,生成氧气需要的时间明显增加;当收集到氧气体积大于100 mL 时,MnO2和Al2(SO4)3的催化效果明显开始下降;当收集到氧气体积大于150 mL 时,NaHSO4的催化效果明显降低;当收集到氧气体积大于200 mL 时,PbO2的催化效果明显降低。在实验的条件下制取氧气在50~350 mL 体积范围内 ,与 MnO2比 较 ,P2O5,CrO3,Fe2O3,Cr2O3,NaHSO4,MoO3,MnSO4,V2O5,PbO,CuO,PbO2,ZnO,CaO,MgO 的催化效果明显优于MnO2,Al2O3催化效果与MnO2相当,Al2(SO4)3催化效果稍弱于MnO2。

图1 催化剂种类对氯酸钾分解反应催化活性的影响Fig.1 Effect of catalyst type on catalytic activity of potassium chlorate decomposition reaction
2.3 催化剂用量对氯酸钾分解反应催化活性的影响
按照2.1.2 的实验方法,准确称取经过重结晶的氯酸钾1 g,催化剂的用量依次为氯酸钾质量的1/1(1 g),1/2(0.5 g),1/3(0.33 g),1/4(0.25 g)和 1/5(0.20 g)进行实验,以收集250 mL 氧气为参照,利用所用的时间,比较催化剂的催化效果,用时越少,催化剂的催化效果越好。实验结果如图2所示。

图2 催化剂用量对氯酸钾分解反应催化活性的影响Fig.2 Effect of the amount of catalyst on the catalytic activity of potassium chlorate decomposition
图2 表明,氧化铜、三氧化铬、五氧化二磷、氧化铁和硫酸氢钠5 种物质分别作为氯酸钾分解制氧气的催化剂时,其与氯酸钾的质量比为1∶1 时催化效果最好;二氧化铅、氧化锌做氯酸钾分解制氧气的催化剂时,其与氯酸钾质量比为1∶2 时对氯酸钾分解催化效果最佳;氧化钙、氧化镁、三氧化二铬、氧化铅、硫酸锰、硫酸铝、二氧化锰7 种物质分别作为氯酸解分解制氧气反应的催化剂时,其与氯酸钾的质量比为1∶3 时催化效果最佳;氧化铝、五氧化二钒、三氧化钼三种物质分别作为氯酸钾分解制氧气反应的催化剂时,其与氯酸钾质量比为1∶4时,催化效果最佳。
2.4 催化剂种类对氧气逸出速率的影响
按照2.3 的实验结果和2.1.2 的实验方法,准确称取经过重结晶的氯酸钾1 g,选择催化剂与氯酸钾最佳的催化活性比例进行试验,根据收集到相同体积的氧气(50 mL)所用时间的间隔进行氧气逸出速率的评价,时间间隔越均匀,氧气逸出速率越平稳,越有利于氧气的收集和实验现象的观察。实验结果如图3所示。

图3 催化剂种类对氧气逸出速率的影响Fig.3 Effect of the type of catalyst on the oxygen evolution rate
图3 表明,硫酸铝、硫酸氢钠和三氧化二铬作氯酸钾分解制取氧气反应的催化剂,在氧气体积在50~250 mL之间,氧气逸出速率均匀、稳定,便于收集;氧气体积大于250 mL 后,氧气逸出的速率明显减慢;氧化锌、氧化铅、二氧化铅、氧化镁、氧化铜、氧化铁、二氧化锰催化氯酸钾分解制氧气,氧气的体积在50~300 mL 之间,氧气逸出速率均匀、稳定;氧化钙、氧化铝、五氧化二钒、五氧化磷、硫酸锰、三氧化铬和三氧化钼催化氯酸钾分解制氧气,氧气的体积在50~350 mL 之间,氧气逸出速率均匀、稳定。
3 讨论与结论
(1)实验过程中发现用三氧化铬、二氧化铅、五氧化二钒、三氧化钼催化氯酸钾分解反应有少量的氯气产生,可能是发生了下列副反应:

(2)除二氧化锰外,氧化钙等16 种常见化学试剂对氯酸钾分解制氧气的反应都有催化作用,且大部分催化效果好。首次发现氧化钙、氧化镁、三氧化二铬、三氧化铬、氧化铅、二氧化铅、五氧化二磷、五氧化二钒、三氧化钼、硫酸氢钠、硫酸锰和硫酸铝12 种常见化学试剂对氯酸钾分解制氧气的反应有良好的催化效果。
(3)综合考虑催化效果,氧气逸出的均匀稳定性、易于收集、没有副反应、原料的廉价和容易得到等因素,优先选用氧化钙、氧化铜、氧化铁、氧化锌、氧化铝和氧化镁6 种物质代替二氧化锰作为氯酸钾分解制氧气的催化剂。其优点是首先避免了副产物氯气的产生,实验过程中没有白雾产生;其次是催化剂易得,费用低廉;第三是实验过程比较安全;第四是实验结束后催化剂(氧化钙、氧化铜、氧化铁、氧化锌、氧化铝和氧化镁)回收方便,可反复使用。

