大豆种子成熟蛋白PM40基因表达方式分析及其启动子预测
赵 艳,刘阔成,王 珏,马晓宇,孙天国
(齐齐哈尔大学 生命科学与农林学院,抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
大豆是重要的粮食作物和油料作物,种子中富含蛋白质和油脂,是世界范围内能量和营养的主要来源。大豆种子约40%的总重量为种子蛋白,主要为贮藏蛋白或各种蛋白因子[1]。大豆种子的发育分为2个主要的阶段:第1个阶段是开花后20~25 d,这时的胚仍很小,距离种子成熟还有很长时间,不积累籽粒的营养分子,主要是细胞的分裂,这个时期的基因不参与营养物质的贮藏;第2个阶段发生在开花后25~60 d,涉及扩大先存的细胞,在这个时期,主要是油类、蛋白和碳水化合物的合成及其在种子中的贮藏,这个时期称为“营养库”时期[2]。在种子成熟期阶段,淀粉、蛋白质、脂肪等物质在种子中大量积累,其中贮藏的蛋白质即为贮藏蛋白,该蛋白在种子成熟期间大量积累,主要为之后种子的萌发提供氨基酸和氮元素。
大豆种子主要包括2种贮藏蛋白,β-球蛋白(7S)和大豆球蛋白(11S),两者占总种子蛋白的70%。此外,依据沉降系数,还有2S和15S蛋白等[3]。种子贮藏蛋白主要在胚胎发育后期表达,编码这些蛋白的基因在不同时空条件下的表达存在一定差异,如种子成熟蛋白多在大豆种子中表达量较高,颜克亮等[2]分析大豆种子形态建成期与成熟期基因差异表达情况,检测表明大豆种子成熟蛋白基因(PM34)在大豆种子中表达量较高。根据Yin等[4]报道,Glyma05g04230基因属于第2个阶段的“营养库”基因,积累时间大约在开花后35~42 d,是另一种种子成熟蛋白基因(PM40),本研究将通过qRT-PCR方法,检测大豆PM40基因在干旱、盐、低温和脱落酸条件下及大豆不同组织中的表达方式;克隆PM40基因上游的启动子序列,利用生物信息学软件预测其启动子的功能,为该基因及启动子的进一步研究应用提供理论基础。
1 材料和方法
1.1 材料及主要试剂
ExTaq、pMD18-T克隆载体、TRIzol reagent、Oligo(dT)18、Recombinant RNase Inhibitor、反转录酶、限制性内切酶PstⅠ和KpnⅠ、荧光定量试剂盒等均购自TaKaRa公司;凝胶回收试剂盒购自天恩泽公司;PCR引物和DNA序列测定由金唯智公司完成;其他试剂均为进口或国产分析纯。
1.2 qRT-PCR试验
1.2.1 大豆材料处理 配置Hoaglands营养液培育4组大豆水培幼苗,之后进行各处理如下:干旱胁迫处理(PEG8000, 20%);盐胁迫处理(NaCl, 200 mmol/L);低温胁迫处理(放置于4 ℃低温环境);脱落酸处理(200 μmol/L)[5]。4组大豆水培幼苗在各处理条件下分别处理0,1,2,5,10,24 h,分别取样并迅速置于液氮中,而后放于-80 ℃中保存备用。
准备各处理的同时对自然条件下生长的大豆各组织进行取样:分别取大豆根、茎、叶、花、开花后30天的胚(30DAF)、开花后60天的胚(60DAF)和成熟种子(开花后90 d种子,90DAF)[6],迅速置于液氮中,放于-80 ℃中保存备用。
1.2.2 qRT-PCR检测 将干旱、盐、低温和脱落酸处理的各大豆幼苗,称取叶3 g,分为3份,每份1 g作为1次生物学重复。液氮研磨后,采用TRIzol reagent试剂提取大豆总RNA,反转录获得 cDNA,用于进行qRT-PCR反应。 选用大豆管家基因β-tubulin(GMU12286)为内参,内参的引物为(B1: 5′-GGAAGGCTTTCTTGCATTGGTA-3′;B2: 5′-AGTGG CATCCTGGTACTGC-3′)[7-8]。根据大豆PM40基因的核苷酸序列(NM_001349197.1),利用引物设计软件Primer Premier 5.0 设计检测引物,引物为(H1:5′-TGCTGACTCGGATCATGAAGTGG-3′)和(H2:5′-GCACACATCTGCTTGATGCCT-3′)。设置实时定量PCR仪,反应参数:95 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s。每个取样点设3次技术重复[9-10]。大豆各组织的qRT-PCR检测同上述方法进行。数据结果采用SPSS 24.0进行统计分析。
1.3 启动子的克隆及生物信息学预测
利用DNA提取试剂盒提取大豆叶片的总基因组DNA,根据大豆PM40基因在NCBI中的序列和大豆基因组中的序列(http://www.plantgdb.org/GmGDB/cgi-bin/blastGDB.pl),设计引物扩增PM40基因上游的启动子序列,引物分别为X1:5′-TTTATGAGATTGAGACTCGGGTTAG-3′和X2:5′-TCCTCAGCAACATCCACGAC-3′。反应条件:预变性94 ℃ 5 min;94 ℃ 30 s,53 ℃ 40 s,72 ℃ 1 min,共30个循环;72 ℃后延伸10 min。凝胶回收试剂盒回收扩增片段,连接至pMD18-T克隆载体上,转化大肠杆菌DH 5α感受态,获得重组质粒,用PstⅠ与KpnⅠ进行双酶切鉴定、测序。测序结果利用DNAStar软件进行同源性比对。采用启动子分析网站NewPLACE (https://www.dna.affrc.go.jp/PLACE/?action=newplace)预测PM40基因启动子序列中的顺式作用元件。
2 结果与分析
2.1 大豆PM40基因的逆境诱导表达分析
对大豆PM40基因在不同处理条件下进行表达分析,该基因在干旱(PEG)、盐(NaCl)、低温(4 ℃)和脱落酸条件下,处理不同时间,qRT-PCR检测结果表明(图1):在盐处理条件下,处理2 h时PM40基因表达升高,是未处理的3.29倍,其余处理时间基因表达与未处理相比下降,说明该基因在盐诱导2 h表达升高。PM40基因在干旱、低温和脱落酸处理不同时间下,与未处理相比,表达量均下降,分别下降3~4倍,4~10倍,3~60倍,说明PM40基因受干旱、低温和脱落酸诱导表达下降。
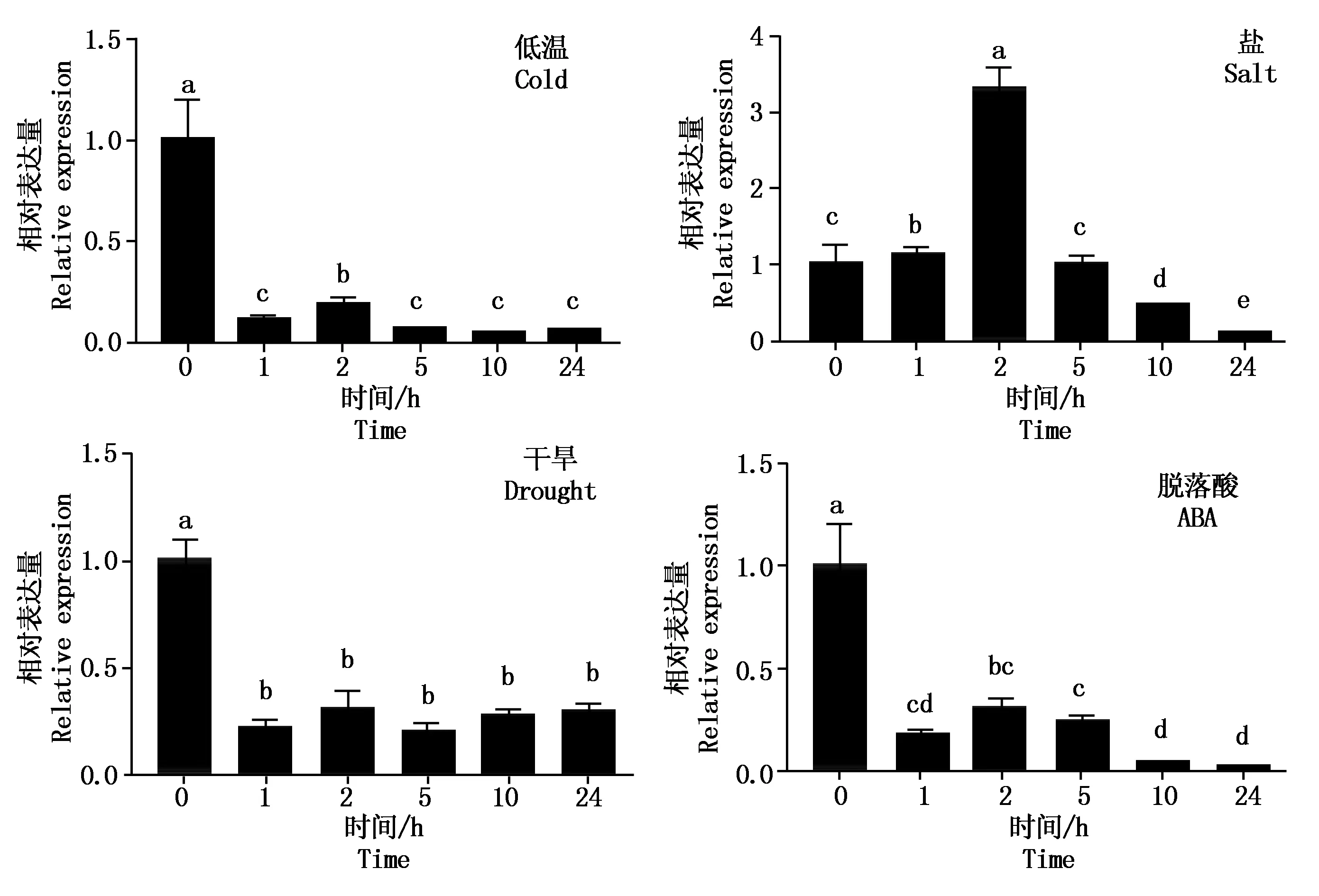
不同字母表示差异显著(P<0.05)。图2同。Different letters indicate significant differences(P<0.05).The same as Fig.2.
2.2 大豆PM40基因的组织表达分析
对大豆PM40基因在大豆各组织中的表达进行分析,qRT-PCR检测结果表明(图2):大豆PM40基因在大豆种子中的表达相对较高,在叶、花中表达量低,相对于根中的表达量,该基因在叶、花中的相对表达量为0.16和0.58,在茎、30DAF、60DAF和90DAF中的相对表达量为2.80,2.79,35.76和239.75,统计分析表明,开花后60 d的胚和成熟种子中的相对表达量达到显著水平,说明该基因在种子中表达较高且特异性较好。
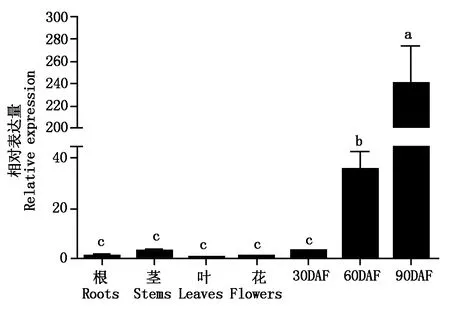
图2 大豆PM40基因在大豆根、茎、叶、花和不同时期种子中的表达 Fig.2 The expression patterns of soybean PM40 gene in roots, stems, leaves, flowers and different times seeds of soybean
2.3 大豆PM40基因启动子序列的克隆
根据大豆基因组中PM40基因序列,设计引物,PCR扩增PM40基因上游的启动子序列,扩增片段长度为1 581 bp的序列,命名为MP(图3)。将MP片段连到pMD18-T载体上,转化大肠杆菌DH 5α感受态,得到重组质粒pMD18-T-MP。采用PstⅠ与KpnⅠ限制性内切酶双酶切鉴定后,得到约1 581 bp的片段(图4)。测序结果(图5)与大豆基因组中该段序列同源性比对后,同源性达到100%,说明获得PM40基因的启动子序列。
2.4 大豆MP启动子的生物信息学预测
MP启动子序列中存在多种与种子特异表达或胚高表达相关的顺式调控元件(表1),PM40基因在大豆种子中高表达,特别是随着种子成熟表达量增加,在成熟种子中的表达最高,PM40基因的这种组织表达方式,与其启动子中含有表1中不同的顺式作用元件有密切的关系。
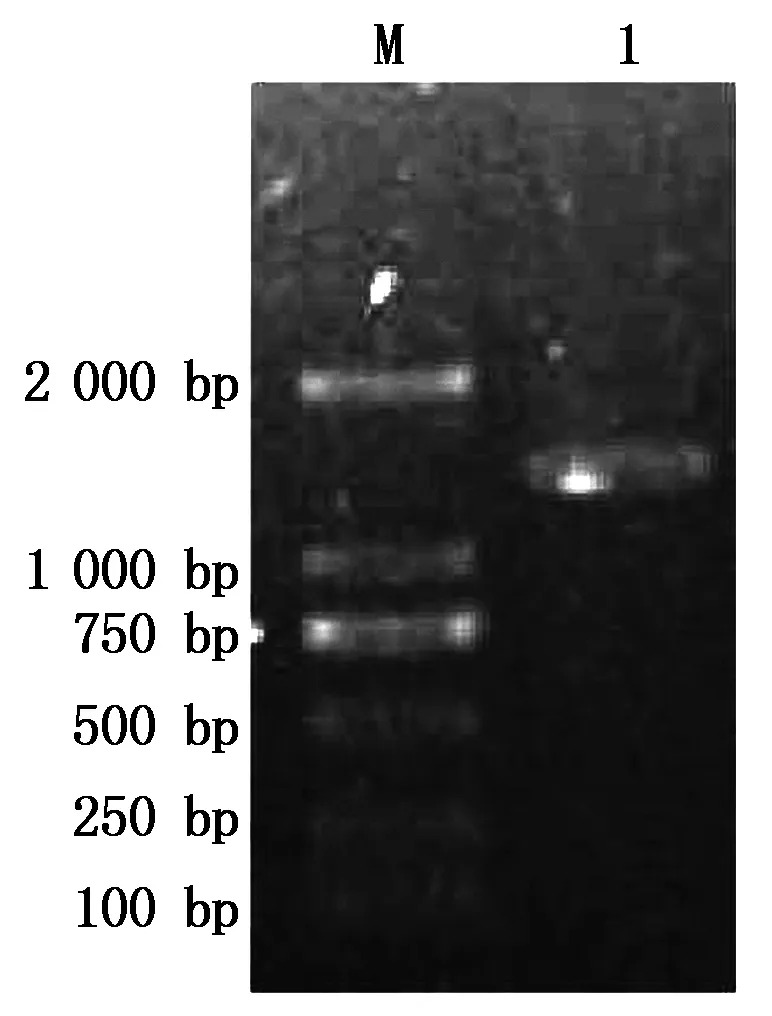
M.2000 bp DNA Marker; 1.MP的PCR扩增产物。M.2 000 bp DNA Marker; 1.PCR amplification of MP.
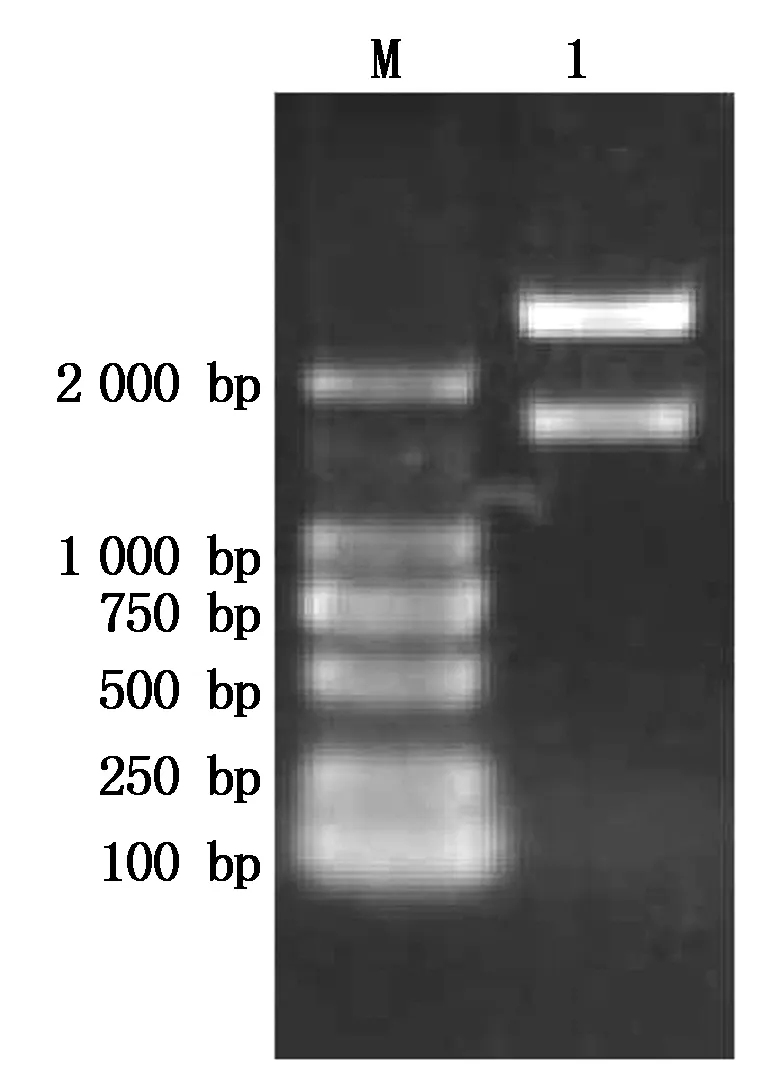
图4 pMD18-T-MP的双酶切鉴定结果Fig.4 Restriction enzyme digestion identification of pMD18-T-MP

图5 MP启动子序列 Fig.5 The sequence of MP promoter
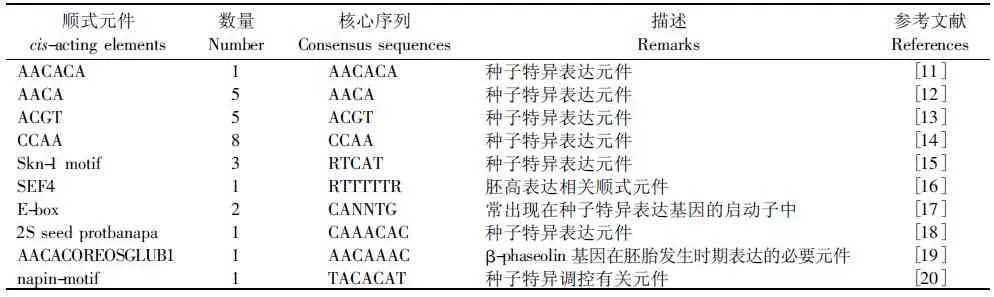
表1 大豆MP序列中的顺式元件Tab.1 Cis-elements in the MP promoter of soybean
注:R.A/G; N.A/T/C/G.
3 结论与讨论
有报道表明,大豆PM40基因在种子中高表达,种子同样是渡过逆境最好的阶段,因此,本研究利用qRT-PCR方法,进一步检测该基因在盐、干旱、低温和脱落酸条件下的表达情况,结果显示,PM40基因在盐诱导2 h表达升高,在干旱、低温和脱落酸诱导下,表达量下降,说明该基因受环境影响比较大。
同样,本研究也进一步检测PM40基因在大豆各组织中的表达方式,不仅是在根、茎、叶、花中,也检测了不同发育时期的种子,发现PM40基因具有较好的组织特异性,即在大豆种子中的表达高,在根、茎、叶、花中表达都较低;此外,不同发育时期的种子中,该基因的表达量来看,PM40基因随种子发育成熟,积累快速增多,主要在种子成熟阶段表达量最高,可能与此时蛋白积累密切相关,但与Yin等[4]的报道,PM40(Glyma05g04230) 基因积累时间大约在开花后35~42 d有差异,关于其积累的阶段仍需进一步探讨。
PM40基因具有很好的组织特异性,在大豆种子中高表达,本研究继续克隆了PM40基因5′端上游启动子序列1 581 bp,经生物信息学预测表明PM40基因启动子序列中包含多种与种子高表达相关的顺式元件,这些顺式元件的存在、数量与位置,可能与PM40基因在大豆种子的高表达有关。本研究推测大豆PM40基因启动子可能是种子特异性启动子,需进一步试验验证,本研究结果为PM40基因及其启动子的功能研究奠定理论基础。

