不同采收时期蜂王浆抗氧化活性研究
谌 迪 肖朝耿 盛玲冬 卢文静 唐宏刚 叶 沁 吴卫成 葛 啸
(1浙江省农业科学院食品科学研究所,浙江 杭州 310021;2浙江经贸职业技术学院应用工程系,浙江 杭州 310018;3杭州康力食品有限公司,浙江 杭州 311401)
蜂王浆是传统抗衰老食品[1],由哺育蜂头部腺体(主要为咽下腺和上颌腺)分泌,呈乳白色或淡黄色的浓稠浆状物[2]。作为蜂王的主要食物[3],蜂王浆具有免疫调节、抗菌、抗肿瘤[4]、调节血压血脂[5-7]、激活神经保护因子[8]和类胰岛素[9]等多种生物活性。研究表明蜂王浆对缓解小鼠的疲劳症状有一定作用[10]。近十多年来,蜂王浆的抗氧化活性得到了诸多国内外研究人员的验证,Jamnik 等[11]通过蛋白二维电泳发现,蜂王浆具有降低酿酒酵母细胞氧化应激的作用;Cihan 等[12]发现蜂王浆能明显改善小鼠血液和肝脏中的脂质过氧化产物过高,超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性异常等不良症状;Teixeira 等[13]发现蜂王浆具有降低皮质酮水平,改善冷胁迫下大鼠大脑抗氧化系统的作用。鉴于此,蜂王浆的抗氧化能力与其抗衰老作用有着较大的关联,也是评价蜂王浆品质的一项重要指标。
蜂王浆主蛋白(major royal jelly proteins,MRJPs)作为蜂王浆的主要活性物质,约占蜂王浆干物质的50%[14],由9 个蛋白家族成员组成,分子量主要介于40~100 kDa之间[15]。有研究认为MRJPs家族中的MRJP1 是决定蜜蜂幼虫级型分化的关键环境因素[16],也有研究认为MRJPs 家族中的其他成员同样重要[17]。MRJPs 可有效保护CCl4诱导的急性肝损伤[18];可调节果蝇体内过氧化物酶基因的转录[19];对人体肺成纤维细胞表现出抗衰老作用[20]。然而MRJPs 的含量及活性在室温条件下变化较大,这主要归因于MRJPs 的热敏性,在常温下易降解[21]。不同采集时间下,温度差异导致泌浆蜂所产生的内源性蜂王浆品质各不相同,且在蜂王浆采集贮运过程中很难做到全程冷链保存[22],因此高品质的蜂王浆原料对于蜂王浆产品的品质至关重要。目前关于不同采收时期对蜂王浆品质的影响尚鲜见报道。本研究比较了不同采收时期的蜂王浆中MRJPs 特定标记蛋白的含量,通过分析不同采收时期蜂王浆中总水溶性蛋白和多酚的含量,结合体外抗氧化活性评价,剖析蜂王浆抗氧化活性的物质基础,旨在为蜂王浆的生产利用提供理论依据。
1 材料与方法
1.1 材料与试剂
蜂王浆,杭州康力食品有限公司,本试验蜂王浆均取自不同月份的意大利蜜蜂的新鲜王浆,即用镊子将蜂王幼虫从王台中夹出,然后取出蜂王浆迅速置于冰浴中保存。
2,2-联苯基-1-苦基肼基(2,2-diphenyl-1-picrylhydrazyl,DPPH),美国Sigma 公司;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)、[2,2′-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS]总抗氧化活性试剂盒,碧云天生物技术有限公司;牛血清白蛋白,国药集团化学试剂有限公司。其他试剂均为分析纯,杭州泽衡生物科技有限公司。
1.2 主要仪器与设备
BS124S 型电子天平,德国赛多利斯天平有限公司;5424R 型冷冻离心机,德国艾本德公司;Spectra Max 190 型酶标仪,美国MD 公司。
1.3 试验方法
1.3.1 MRJPs 含量测定 蜂王浆采集后于-20℃保存。采用SDS-PAGE(sodium dodecyl sulfatepolyacrylamide gel electrophoresis)蛋白电泳分析蜂王浆中MRJPs 的组成,用蒸馏水将蜂王浆充分溶解,制备成20 mg·mL-1蜂王浆溶液后与loading buffer 等体积混合,100℃热变性3 min 后上样,开始电泳。电泳电压设置:待样品成近似一条直线后将电泳电压从66 V 调至110 V。利用Image J 软件中的灰度测定方法测定MRJP1 及MRJP3 的相对含量[23]。
1.3.2 ABTS 总抗氧化活性测定 将不同采收时期的蜂王浆样品依次稀释为800、400 和200 mg·mL-1,根据试剂盒说明书测定ABTS 总抗氧化活性。
1.3.3 DPPH 自由基清除能力测定 参考于丽娜等[24]的方法并作适当修改。将蜂王浆用蒸馏水稀释至100 mg·mL-1,取190 μL 0.1 mmol·L-1DPPH 乙醇溶液于96 孔板中,然后依次加入10 μL 100 mg·mL-1不同采收期的蜂王浆样品,混合均匀,30℃保温20 min后用酶标仪于517 nm 波长处测定其吸光度值;对照组以等体积的蒸馏水代替蜂王浆样品。按照公式计算DPPH 自由基清除率:

1.3.4 水溶性蛋白质含量测定 参考Lowry 等[25]的方法并作适当修改。测定系列浓度牛血清白蛋白(bovine serum albumin,BSA)溶液在595 nm 波长处的吸光度值,并制作BSA 标准曲线。然后测定样品溶液在595 nm 波长处的吸光度值,带入标准曲线换算出样品的蛋白浓度。
1.3.5 总酚含量测定 参考Hinneburg 等[26]和田玉肖等[27]的方法并作适当修改。准确吸取1 mL 超声溶解后的10 mg·mL-1蜂王浆水溶液,加入1 mL Folin-Ciocalteu 显色剂,混匀后加入5 mL 1 mol·L-1Na2CO3溶液,用蒸馏水定容至10 mL,漩祸混匀,在室温下避光静置1 h 后测定760 nm 波长处的吸光度值。标准曲线用系列浓度的原儿茶酸(3,4-dihydroxybenzoic acid,PCA)溶液吸光度值绘制,样品总酚含量结果表示为mg PCA·g-1。
1.4 数据分析
试验数据通过SPSS 18.0 进行显著性分析,P<0.05 表示差异显著。采用Microsoft Excel 2010 绘制图表,描述性统计值使用平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 不同采收时期蜂王浆中MRJPs 含量
由图1可知,不同采收时期蜂王浆的MRJPs 以MRJP1 为主,且不同采收时期的MRJPs 含量差异明显。由图2可知,4月份采收的蜂王浆中,MRJPs MRJP1 含量显著高于其他采收时期的样品(P<0.05),工蜂在此时期分泌的内源性蜂王浆可能受环境等多种因素的影响,因此该采收时期蜂王浆所含有的MRJP1 较其他收集时期高。9月份采收的的蜂王浆中MRJP1 含量仅次于4月份采收的样品(P<0.05),但高于其他采收时期的样品。7、8月份采收的蜂王浆中MRJP1 含量略低于9月份,但无统计学差异(P>0.05),而5月份采收的蜂王浆中MRJP1 含量显著低于9月份(P<0.05)。6月份采收的蜂王浆MRJP1 含量最低。
由于具有热不稳定的特性,不同采收时期蜂王浆中MRJP3 含量受温度影响,也呈现出明显的差异,但整体上与MRJP1 类似,5、7 和8月份采收的蜂王浆中MRJP3 含量无显著差异(P>0.05),但上述3 个月份采收样品的MRJP3 含量均显著低于4月份和9月份(P<0.05);6月份采收的蜂王浆中MRJP3 含量显著低于其他月份(P<0.05)。结果表明,温度等环境因素的差异导致不同采收时期的蜂王浆中MRJPs 含量差异非常明显,且含量较少的几种主蛋白在6月份采收的蜂王浆中均未检出。
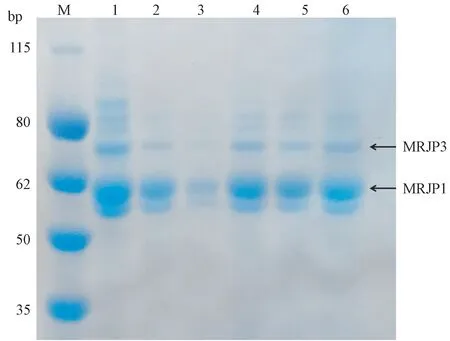
图1 不同采收时期MRJPs 的SDS-PAGE 电泳图Fig.1 SDS-PAGE analysis of MRJPs at different collection times
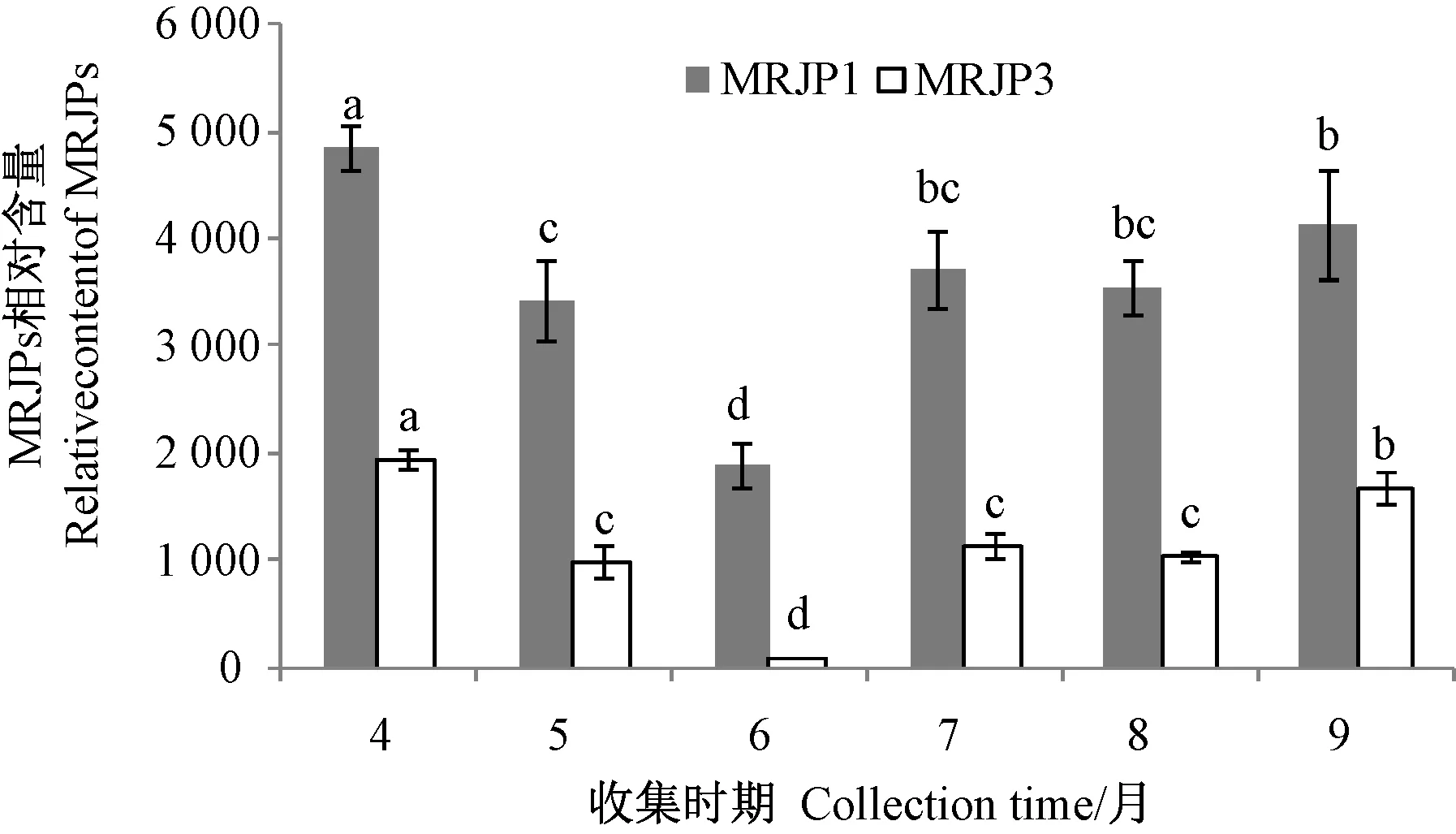
图2 不同采收时期的蜂王浆中MRJPs 含量Fig.2 Content of MRJPs in royal jelly at different collection times
2.2 蜂王浆DPPH 自由基清除能力
由图3可知,4月份采收的蜂王浆DPPH 自由基清除能力与7、8、9月份采收的样品无显著差异;5月份与6月份采收的蜂王浆DPPH 自由基清除能力无显著差异,但二者均显著低于其他采收时期(P<0.05)。相关性分析结果表明,除8月份外,其他采收时期的蜂王浆DPPH 自由基清除能力和MRJP1 和MRJP3 含量的相关系数达0.828 和0.847。表明,蜂王浆DPPH自由基清除能力与其MRJPs 含量存在较明显的正相关性。
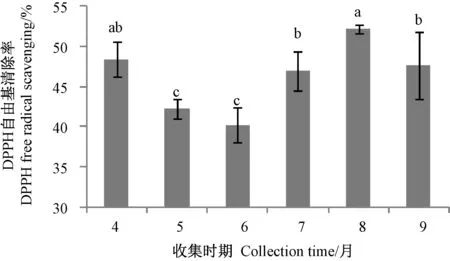
图3 不同采收时期的蜂王浆DPPH 清除能力Fig.3 DPPH scavenging ability of royal jelly at different collection times
2.3 蜂王浆总抗氧化活性
由图4可知,5月份和9月份采收的蜂王浆总抗氧化能力最强,显著高于其他采收时期的样品(P<0.05),其次为7月份和8月份采收时期的的蜂王浆。与DPPH 自由基清除能力结果类似,6月份采收的蜂王浆总抗氧化能力显著低于其他采收时期的样品(P<0.05)。相关性分析结果表明,5-9月份采收的蜂王浆的总抗氧化能力与MRJP1 与MRJP3 含量的相关系数分别为0.680 和0.743。表明MRJPs 与蜂王浆总抗氧化活性存在一定的相关性。

图4 不同采收时期的蜂王浆总抗氧化能力Fig.4 Total antioxidant capacity of royal jelly at different collection times
2.4 蜂王浆水溶性蛋白及总酚含量
由图5可知,不同采收时期蜂王浆中总水溶性蛋白含量无显著差异(P>0.05),但MRJPs 含量在不同采收时期的样品中存在显著差异,这可能是由于MRJPs 在蜂农采收储运过程中部分发生降解,产生其他多肽类成分所致。
由图6可知,6月份采收的蜂王浆总酚含量最高,且显著高于其他采收时期的样品(P<0.05),其次为4月份采收的蜂王浆;5月份和8月份采收的蜂王浆总酚含量无显著性差异(P>0.05);7月份和9月份采收的蜂王浆采收的蜂王浆总酚含量最低,且无显著差异(P>0.05),9月份采收的蜂王浆总酚含量较低,可能与工蜂在该时期分泌的内源性蜂王浆有关,而7月份采收的蜂王浆总酚含量较低可能与该月温度较高有一定关系。
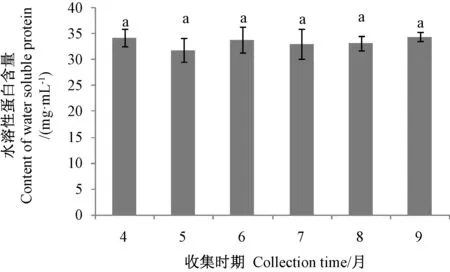
图5 不同采收时期的蜂王浆水溶性蛋白含量Fig.5 Content of water soluble protein in royal jelly at different collection time
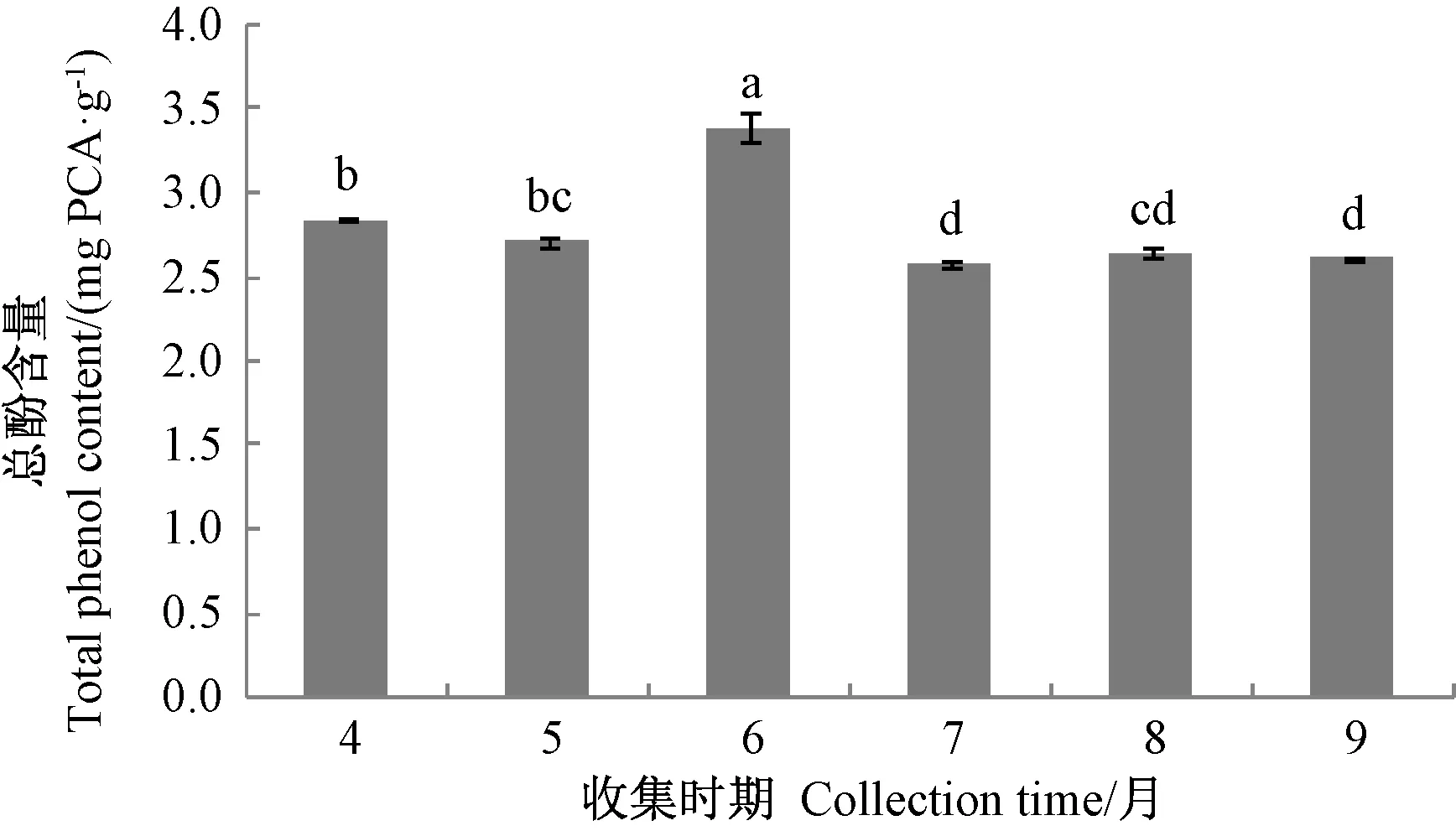
图6 不同采收时期的蜂王浆总酚含量Fig.6 Total phenol content of royal jelly at different collection time
3 讨论
MRJPs 是蜂王浆的主要活性物质。研究表明,MRJPs 的热不稳定性,使其较蜂王浆酸等其他成分更适合作为蜂王浆新鲜度的标记物,而蜂王浆中超氧化物歧化酶的抗氧化性是评价其新鲜度的重要参数[28]。本研究通过分析不同采收时期蜂王浆DPPH 自由基清除能力和总抗氧化能力发现,6月份采收的蜂王浆活性均低于其他采收时期样品,进一步分析其组成发现,该月份采收的蜂王浆不仅MRJP1 和MRJP3 含量低于其他采收时期,且从电泳图可知其他MRJPs 家族成员也明显低于其他采收时期,究其原因,一方面可能是由于6月份环境温度高,导致MRJPs 部分降解;另一方面取浆的时间、泌浆蜂的日龄以及环境因素也会影响工蜂所分泌内源蜂王浆的抗氧化生物活性,特别是环境温度对蜂王浆中超氧化物歧化酶的影响较大[29]。本研究对不同采收时期蜂王浆的MRJPs 含量与总抗氧化活性进行了相关性分析,结果表明,蜂王浆总抗氧化活性与其MRJPs 存在正相关性,这与高慧等[30]报道的MRJPs 含量与DPPH 自由基清除活性具有正相关性的结论一致。
Nagai 等[31]用胃蛋白酶、胰蛋白酶和木瓜蛋白酶处理蜂王浆后发现,MRJPs 经酶解后清除超氧阴离子自由基和羟自由基的能力显著提高。本研究发现不同采收时期的蜂王浆总水溶性蛋白含量无显著性差异,但是不同采时期的MRJPs 含量存在差异,这可能是由于MRJPs 经内源或外源酶作用后产生了多肽等其他形式的水溶性蛋白,因此导致不同采收时期蜂王浆中总水溶性蛋白含量并无显著差异。Guo 等[32]发现MRJPs 酶解所产生的多肽类成分具有较强的抗氧化活性,蜂王浆在天然状态下,部分具有抗氧化活性的MRJPs 被分解,产生抗氧化活性更强的多肽类成分,这种变化也一定程度上解释了5月份和8月份样品中MRJPs 含量虽然较低但总抗氧化能力反而较强的现象。多酚是典型的抗氧化成分,但不同的多酚成分其抗氧化活性不相同,通过分析不同采收时期蜂王浆总多酚含量发现,虽然6月份采收的蜂王浆DPPH 自由基清除能力和总抗氧化能力低于其他采收时期的样品,但其总多酚含量高于其他采收时期的样品,推测6月份采收的蜂王浆多酚的抗氧化活性较其他采收时期弱,因此,后续研究可针对6月份采收的蜂王浆中多酚的活性及结构表征,阐明多酚结构的变化规律,明确其抗氧化活性降低的分子机理。综上所述,影响蜂王浆抗氧化活性的因素非常复杂,包括MRJPs 及其酶解产生的抗氧化活性肽、多酚含量及种类,还包括影响上述成分的取浆时间及季节等环境因素。
4 结论
本研究结果表明,不同采收时期的蜂王浆样品中,蜂王浆主蛋白(MRJPs)含量差异显著,特别是MRJP1和MRJP3 等含量较丰富的蛋白,由于普通蛋白电泳灵敏度不够,少数丰度较低的蛋白未能检出,后续可采用蛋白组学的方法进行痕量MRJPs 的比较分析。蜂王浆的抗氧化活性与MRJPs 存在一定的正相关性。但不同采收时期的蜂王浆中,MRJPs 含量的降低并不一定导致其抗氧化活性也降低,因为MRJPs 降解后可能产生抗氧化活性更强的多肽,此外多酚结构的变化也会导致抗氧化活性的改变。综上,蜂王浆的抗氧化活性由MRJPs、抗氧化肽及多酚等多种抗氧化物质共同体现,但MRJPs 如何转化成抗氧化肽,以及MRJPs 转化成抗氧化肽后,对蜂王浆其他生物活性有何影响,还有待深入的研究。

