灰葡萄孢霉角质酶粗提液酶学特性研究
吴媛媛 吴伟杰 郜海燕 孙 健 刘瑞玲 陈杭君 韩延超
(1南京农业大学食品科技学院,江苏 南京 210012;2浙江省农业科学院食品科学研究所/农业农村部果品产后处理重点实验室/浙江省果蔬保鲜与加工技术研究重点实验室/中国轻工业果蔬保鲜与加工重点实验室,浙江 杭州 310021;3广西农业科学院农产品加工研究所,广西 南宁 530070)
灰葡萄孢霉(Botrytis cinerea)属半知菌亚门(Deuteromycotina)丝孢纲(Hyphomycetes)葡萄孢属(Botrytis),是一种植物病原真菌。由灰葡萄孢霉引起的灰霉病是造成草莓[1]、蓝莓[2]等水果采前和采后损失的重要原因。灰葡萄孢霉致病过程较复杂,病原菌入侵植物,首先需要分泌水解酶来突破其表皮的第一道屏障——角质层[3],角质层破损后病原菌进一步生长,从而导致植物组织腐烂。通常角质以C16和C18为底物通过酯键连接形成,是一种高聚物[4],而角质酶够分解角质、甘油三酯等化合物并产生大量脂肪酸[5],因此角质酶是入侵植物最主要的功能酶[6]。角质酶也是诱导酶,经其降解的角质单体能够诱发病原细胞中角质酶基因的持续表达并分泌更多角质酶,因此寄主体表的角质被降解后,更易受到病原菌侵染[7]。
角质酶能影响并削弱寄主抗病性,是果实采后保鲜技术的关键控制点。开展角质酶酶学性质的研究,在果实贮藏过程中采取相关措施来抑制角质酶活性,有助于保护果实角质层,从而减小灰葡萄孢霉对果实的危害。目前,针对灰葡萄孢霉角质酶酶学性质及其对葡萄角质层降解作用的研究鲜见报道。本试验探究了灰葡萄孢霉角质酶的最适反应温度、最适pH 值、热稳定性、pH 值稳定性以及金属离子和有机溶剂对其粗酶活性的影响,并分析角质酶粗提液对葡萄角质层的降解作用,以期为控制果蔬采后病害,探究植物角质层与抗病性的关系提供理论参考。
1 材料与方法
1.1 试验材料
灰葡萄孢霉(Botrytis cinerea)分离自蓝莓,由浙江省农业科学院食品科学研究所果蔬保鲜与加工技术研究重点实验室鉴定和保存[2]。
苹果及葡萄均购于杭州市江干区石桥路农贸市场。
1.2 主要仪器与设备
DHG-9070A 电热恒温鼓风干燥箱,上海精宏实验设备有限公司;MLS-3781L-PC 高压蒸汽灭菌器,松下健康医疗器械株式会社;MIR-253 恒温培养摇床、MIR-253 真菌恒温培养箱,SANYO Electric Co.Ltd;MSZCL-1 磁力搅拌器,郑州长城科工贸公司;E-103E分析天平,梅特勒-托利多仪器有限公司;Cintral 20 紫外-可见分光光度计,澳大利亚GBC 科学仪器公司;BIOFUGE Stratos 高速低温冷冻离心机,美国Thermo公司;KYKY SBC-12 离子衍射仪,北京中科科仪技术发展有限责任公司;TM3000 型扫描电镜,日本日立公司。
1.3 试验方法
1.3.1 苹果角质的制备 取适量苹果表皮浸泡于草酸缓冲液(草酸4 g·L-1和草酸铵16 g·L-1),煮沸1 h,煮沸后用蒸馏水彻底冲洗苹果表皮,以除去草酸缓冲液。处理后的苹果表皮置于50℃恒温鼓风干燥箱中干燥3 h,取出后用研钵研磨成粉末。取适量苹果皮粉末,加入氯仿-甲醇(2∶1,v/v)过夜提取,然后用分液漏斗萃取24 h,取下层萃取液,待萃取液挥发至干即得角质[8]。
1.3.2 灰葡萄孢霉角质酶培养液制备 分别称取0.6 g NaNO3、0.6 g K2HPO4、0.2 g MgSO4、0.2 g KCl、0.01 g FeSO4·7H2O 及0.2%苹果角质,用蒸馏水定容至1 000 mL[9],配制成角质酶培养液。将培养液分装至250 mL 三角瓶中,装液量为100 mL,经121℃湿热灭菌25 min 后备用。
1.3.3 角质对灰葡萄孢霉角质酶的诱导 参照王飞[8]的方法。从已分离鉴定的灰葡萄孢菌种上挑取少量菌丝,接种至马铃薯葡萄糖琼脂培养基中22℃恒温培养。取培养7 d 的灰葡萄孢霉,制成浓度为1×106个·mL-1的孢子悬浮液。取10 mL 孢子悬浮液接种于1.3.2 制备的培养液中,然后置于25℃条件下120 r·min-1恒温振荡培养6 d。每隔1 d 取10 mL 灰葡萄孢霉培养液,用4 层纱布过滤除去菌丝,然后于4℃条件下10 000 r·min-1离心20 min,保留上清液,即为灰葡萄孢霉角质酶粗酶液。
1.3.4 灰葡萄孢霉角质酶酶活的测定 取200 μL 粗酶提液,加入200 μL 0.4%Triton X-100 和1 380 μL 50 mmol·L-1磷酸钠缓冲液(pH 值7.0),混合后于35℃条件下水浴2 min,再加入20 μL 丁酸对硝基苯酯(p-nitrophenyl butyrate,PNB)作为反应底物,于405 nm波长处测定并记录3 min 内反应液的吸光度值的变化速率[10]。以直接沸水浴5 min 处理后的粗酶液为对照。以35℃时每分钟催化PNB 水解生成1 μmol 对硝基酚的酶量为一个酶活单位(U):
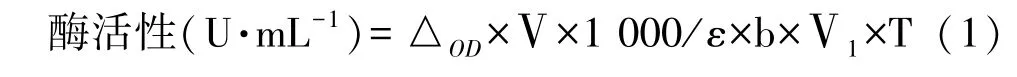
式中,△OD为1 min 内吸光值度的变化;Ⅴ为反应液体积,mL;ε 为消光摩尔系数6 830 L·mol-1·cm-1,pH 值7.0;Ⅴ1为反应液中酶液体积;b 为比色皿光程,cm;T 为反应时间,min。
1.3.5 灰葡萄孢霉角质酶粗酶最适反应温度及热稳定性测定 最适反应温度的选择:取培养第3 天的粗酶液10 mL,在1.3.4 的基础上,将水浴温度分别设置为25、35、45、55、65℃,水浴2 min 测定不同水浴温度下的粗酶活性,并依据粗酶活性判断灰葡萄孢霉角质酶最适反应温度。
热稳定性测定:取培养第3 天的粗酶液10 mL,在1.3.4 的基础上,将水浴温度分别设置为25、35、45、55、65℃,于不同水浴温度下每隔2 h 测定粗酶活性,进而判断不同反应温度下粗酶的稳定性。
1.3.6 灰葡萄孢霉角质酶粗酶最适反应pH 值及pH稳定性测定 最适反应pH 值的选择:取培养第3 天的粗酶液10 mL,在1.3.4 的基础上,将磷酸缓冲液pH 值分别设置为6.0、6.5、7.0、7.5、8.0、8.5、9.0,测定不同pH 值磷酸缓冲液下的粗酶活性,并依据粗酶活性判断灰葡萄孢霉角质酶最适pH 值。
pH 值稳定性测定:取培养第3 天的粗酶液10 mL,在1.3.4 的基础上,将粗酶液按1∶9 的比例与不同pH 值(6~9.0)的缓冲液稀释混匀,并于25℃水浴条件下每隔2 h 测定粗酶活性,进而判断不同pH 值下粗酶的稳定性[11]。
1.3.7 金属离子、有机溶剂对灰葡萄孢霉角质酶粗酶活力的影响 在5 mL 粗酶样品中分别加入金属离子(Na+、Ca2+、Mg2+、Cu2+、Zn2+和Fe3+),调节金属离子和EDTA 终浓度为10 mmol·L-1,于4℃条件下放置1 h,按照1.3.4 所述方法测定粗酶活性。以加入等量蒸馏水的粗酶液作为对照,设定对照酶活为100%[12]。
分别向5 mL 粗酶样液中加入0.56 mL 丙酮、甲醇、异丙醇、乙醇、乙腈和三氯甲烷,使有机溶剂体积分数均为10%[13],于4℃放置1 h,按照1.3.4 所述方法测定粗酶活性。以加入等量蒸馏水的粗酶液为对照组,设定对照组酶活为100%。
1.3.8 灰葡萄孢霉角质酶粗酶对葡萄角质层的影响
挑选外表皮蜡质保持完好的葡萄果实,将10 mL 粗酶液均匀喷洒于果实表面,以喷洒高温煮沸失活的粗酶液为对照,每组处理10 个葡萄果实。处理后的葡萄果实置于35℃恒温培养箱中培养1 h,然后在葡萄赤道附近切取面积厚约1 mm 的果皮置于载玻片,并于-80℃超低温冰箱冷冻后真空冷冻干燥24 h。干燥的样品用离子衍射仪镀金,厚度约20 nm,镀金结束后进行扫描电镜观察拍照[14]。
1.4 数据处理
采用Microsoft Excel 2010 软件对试验数据进行统计整理,应用Origin 8.5 软件绘制图形,并以SAS 9.2软件采用Duncan’s 和LSD 多重比较对试验数据进行显著性分析(P<0.05)。所有试验均设3 次重复。
2 结果与分析
2.1 培养时间对灰葡萄孢霉角质酶粗酶活性的影响
由图1可知,培养3 d 时角质酶粗酶相对酶活最高,第4 天时显著下降(P<0.05),第4 天时角质酶活仅为最高角质酶活的16.41%。这可能与培养液中的碳源有关,本试验以角质为唯一碳源,灰葡萄孢霉分泌角质酶降解角质以获取营养,随着培养时间延长,角质逐渐消耗,在第4 天角质酶活开始下降。因此本试验选取培养后第3 天作为酶活测定的时间点。
2.2 灰葡萄孢霉角质酶粗酶最适温度及热稳定性
由图2-A可知,水浴温度为35℃时角质酶粗酶相对酶活最高,显著高于25、45、55℃时的相对酶活(P<0.05);当水浴温度在为25℃时,其相对酶活仅为35℃时相对酶活的29.59%;45℃与55℃水浴处理组无显著差异(P>0.05),分别为最高酶活的75.12%与70.93%。粗酶在55℃时仍保留60%以上的酶活,表明灰葡萄孢霉粗酶中的角质酶具有较好的耐热性。
由图2-B可知,在不同时长的水浴条件下,角质酶在25℃和35℃条件下较稳定,水浴第8 小时,其相对酶活依然保持90%以上;水浴温度高于45℃时,随着温度的升高,酶的热稳定性逐渐降低,经8 h 水浴,水浴温度为45℃时残余酶活为83.18%,55℃时为70.0%,65℃时为59.1%,仍保持50%以上酶活。表明角质酶粗酶热耐受性较好,属于中度耐热型酶。
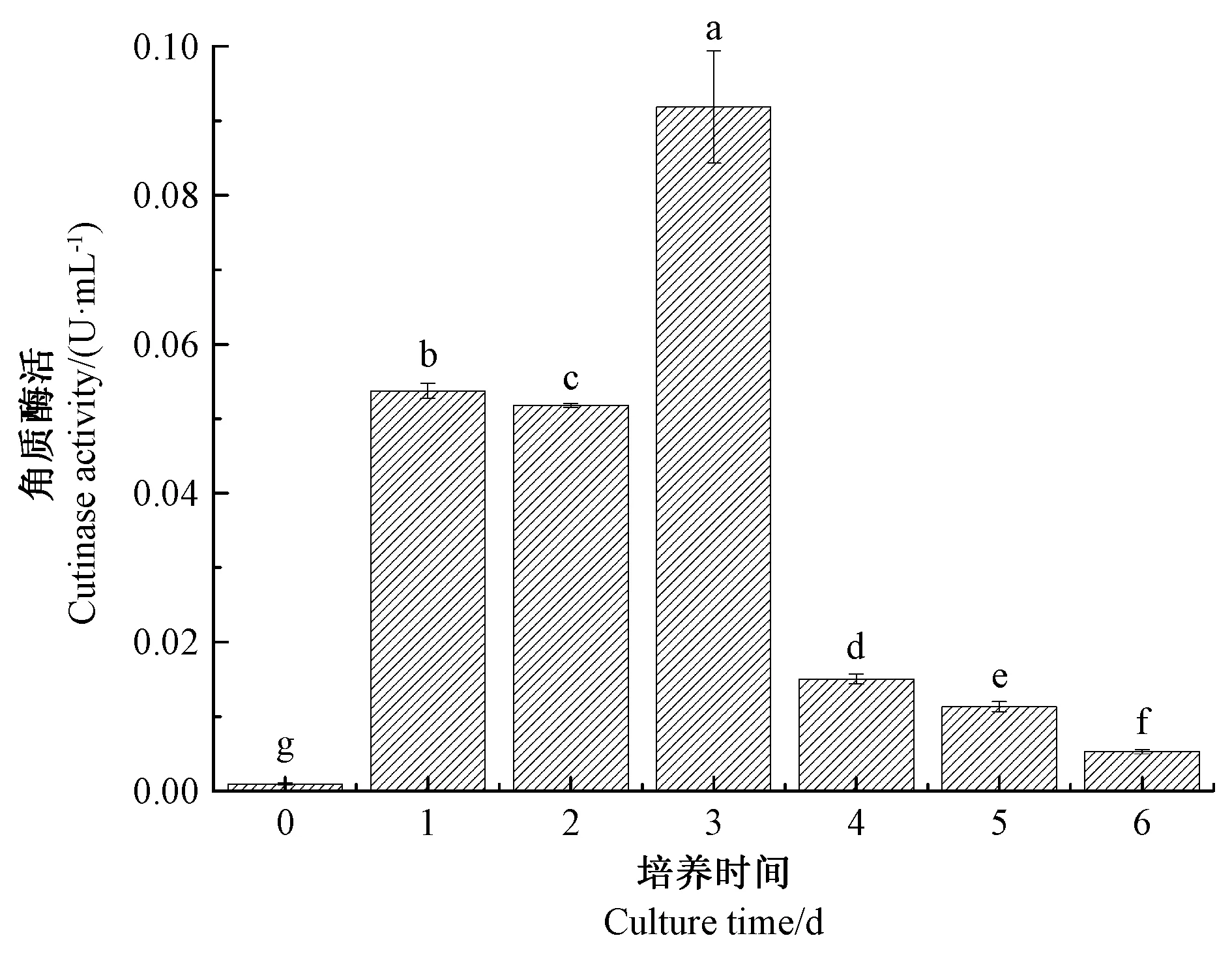
图1 培养时间对灰葡萄孢霉角质酶粗酶活性的影响Fig.1 Effect of culture time on the activity of crude cutinase from Botrytis cinerea
2.3 灰葡萄孢霉角质酶粗酶最适pH 值与pH 值稳定性
pH 值也是影响角质酶活的重要因素之一。由图3-A可知,角质酶粗酶酶活受反应体系pH 值的影响较大,其最适pH 值为7.5,偏碱性环境各组(pH 值在8.0~9.0 之间)间无显著差异(P>0.05)。当反应体系pH 值为9.0 时,其相对酶活为72.65%。偏酸性环境各组间也无显著差异(P>0.05),当反应体系pH 值为6.0 时,其相对酶活仅为43.12%。表明,角质酶在偏碱性环境中相对酶活较高,在pH 值低于7.5 时酶活显著下降(P<0.05)。

图2 温度对灰葡萄孢霉角质酶粗酶活性(A)及热稳定性(B)的影响Fig.2 Effect of temperature on the activity(A)and stability(B)of crude cutinase from Botrytis cinerea
由图3-B可知,角质酶在pH 值为7.5 的体系中酶活较稳定,经8 h 水浴,其残余酶活仍为102.14%。;在pH 值为6.0 时,酶活最不稳定,2 h 后酶活急剧下降,至8 h 仅为初始酶活的35.02%。当pH 值大于7.5时,随着pH 值的升高,角质酶稳定性逐渐下降;当pH值小于7.5 时,随着pH 值下降,角质酶在酸性体系中稳定性变差。

图3 pH 值对灰葡萄孢霉角质酶粗酶活性(A)及pH 值稳定性(B)的影响Fig.3 Effect of pH value on the activity(A)and stability(B)of crude cutinase from Botrytis cinerea
2.4 金属离子和有机溶剂对灰葡萄孢霉角质酶粗酶活性的影响
由图4-A可知,Na+、Mg2+、Ca2+对角质酶粗酶酶活具有显著促进作用(P<0.05),其中Na+的作用最显著,达到127.08%。Zn2+、Cu2+、Fe3+对角质酶粗酶酶活具有显著抑制作用(P<0.05),尤其是Fe3+,仅保留52.02%的残余酶活,Zn2+保留70.72%的残余酶活,Cu2+保留79.17%的残余酶活。
由图4-B可知,有机溶剂中甲醇对角质酶粗酶酶活有显著促进作用(P<0.05),相比对照组提高了18.11 个百分点,丙酮与异丙醇具有促进作用(P<0.05),酶活提高5.46 个百分点。而乙醇、乙腈与三氯甲烷有显著抑制作用(P<0.05),其中乙醇处理后酶活降低了34.95 个百分点,乙腈处理后酶活降低了27.75 个百分点,三氯甲烷处理后酶活降低了36.18个百分点。角质酶在有机溶剂中酶活不同可能是由于二级或三级结构发生了相应的变化[15]。
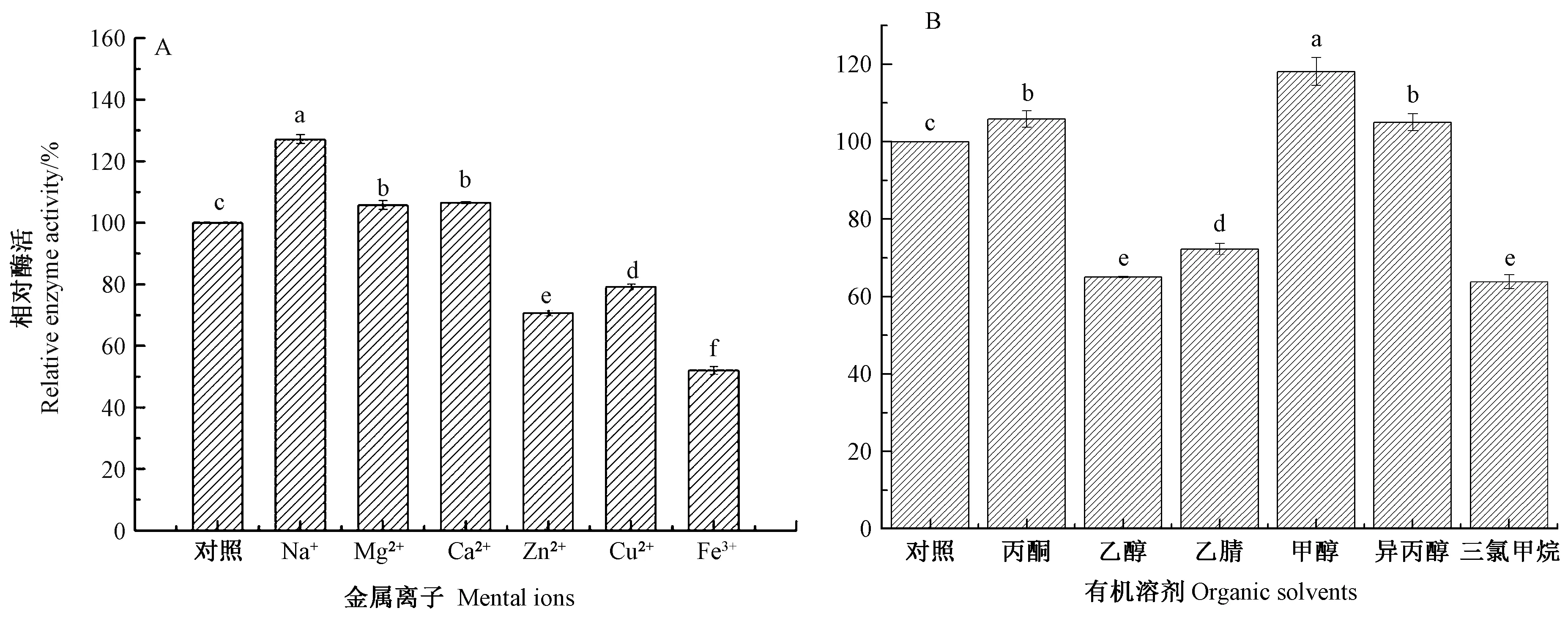
图4 金属离子(A)和有机溶剂(B)对灰葡萄孢霉角质酶粗酶活性的影响Fig.4 Effect of metal ions(A)and organic solvent(B)on activity of crude cutinase from Botrytis cinerea
2.5 灰葡萄孢霉角质酶粗酶对葡萄角质层的降解
由图5-A可知,喷洒失活角质酶粗酶的葡萄角质层结构致密,分布均匀以鳞片形式存在,表皮蜡质无明显降解。而未失活粗酶处理后,表皮蜡质出现明显降解,出现降解部分与正常部分分界线(图5-B)。正常部分蜡质完好,均匀致密,而降解部分出现类似于蜡质溶解的现象,蜡质晶体结构发生变化,与完好蜡质差异明显。角质层作为保护果实的第一道屏障,当表皮蜡质降解后,这道保护层遭到破坏,使角质层内层暴露在外,更易受到病原菌侵染。

图5 灰葡萄孢霉角质酶粗酶对葡萄角质层的影响Fig.5 Effect of crude cutinase from Botrytis cinerea on grape’s cuticle
3 讨论
灰葡萄孢霉角质酶粗酶的最适反应温度为35℃,大多数真菌角质酶的最适温度为30~40℃,这与本研究结果基本一致。细菌角质酶比真菌角质酶更耐热,如嗜热细菌Thermobifi da fusca角质酶最适温度为60℃[16],大多数细菌角质酶最适温度为 40~60℃[17-18]。水果采后通常在高温的夏季,为角质酶提供了适宜的温度,使果实更易受到灰葡萄孢霉的侵染,因此采后应尽快进行预冷处理,一方面有助于消除田间热,另一方面能够抑制角质酶活性,减少灰霉病害。除最适温度外,酶的热稳定性也受温度的影响。本研究表明,灰葡萄孢霉角质酶粗酶在35~55℃稳定性良好,孵育8 h 后在55℃条件下酶活仍能达到70.0%,说明此角质酶具有较强热稳定性。有研究报道画眉草弯孢霉的角质酶在40℃孵育20 min,酶活可下降50%[9],与本研究结果不一致可能与菌株不同有关。也有研究发现通高温放线菌(Thermoactinomyces vulgaris)NRRL B-16117 角质酶在50~60℃条件下可保持高度稳定性[19],真菌Fusarium solani pisi角质酶在60℃条件下水浴5 min 后即丧失50%酶活[20],说明角质酶的热稳定性受菌种来源的影响。
最适pH 值与pH 值稳定性是酶蛋白的重要性质,最适pH 值不是一个特征常数,随底物种类、浓度、温度及缓冲液成分变化而变化。本研究发现灰葡萄孢霉角质酶粗酶的最适pH 值为7.5,符合大部分角质酶最适pH 值为6.0~10.0[17,20],画眉草弯孢霉角质酶最适pH 值为7.5[9]。灰葡萄孢霉角质酶在pH 值为7.5 时稳定性较高,且偏碱性环境中酶的pH 稳定性比偏酸条件下更高。烟草赤星病菌在pH 值为5.0~9.0 时酶活较稳定,在35℃条件下孵育1 h 后,在pH 值为9.0的体系中稳定性较高[21],这种差异也可能与菌种不同有关。
金属离子也会影响酶的活性[22]。Na+、Mg2+、Ca2+对灰葡萄孢霉角质酶的酶活有促进作用,Zn2+、Cu2+、Fe3+抑制粗酶活性,这与L3-2 胞外酯酶粗酶[14]、重组Thermobifida fusca角质酶[23]的相关研究结果基本一致。Mg2+、Ca2+对灰葡萄孢霉角质酶粗酶具有轻微促进作用,Mg2+对胶红酵母角质酶酶活具有激活作用[24],这是因为高浓度金属离子与角质酶表面相关基团作用,改变酶的三级结构[25]。本研究发现10%乙醇处理能够明显降低角质酶活性,王莉[15]发现在37℃时,角质酶在20%~50%乙醇中具有较好的稳定性,可能是由于角质酶在不同体系中酶的构象不同,导致其活性不同。黄晓杰[26]发现采后乙醇处理能有效抑制蓝莓果实贮藏期间腐烂指数的上升,可能是由于乙醇处理在一定程度上抑制了灰葡萄孢霉角质酶活性。因此乙醇处理在葡萄采后保鲜应用中具有良好的应用前景。
本研究发现灰葡萄孢霉角质酶粗酶对葡萄角质层蜡质具有明显的降解作用。Schweizer 等[27]研究发现真菌病原体禾白粉菌(Erysiphe graminisf.sp.hordei)能够降解大麦角质层,释放角质单体,也验证了游离角质单体能够激活植物防御反应。目前,关于葡萄角质层降解后产物尚不明确,其蜡质或角质降解产物是否具有诱导抗病性的作用还有待进一步研究。也有研究表明植物蜡质在逆境胁迫下,相关合成基因表达会发生变化,以抵御外界环境的侵害[28]。后续可利用分子生物学技术继续探究葡萄角质层被灰葡萄孢霉降解后蜡质和角质相关基因的变化。
4 结论
本研究发现灰葡萄孢霉角质酶粗酶最适反应温度为35℃,最适反应pH 值为7.5,具有良好的耐热性与耐碱性,金属离子Zn2+、Cu2+、Fe3+,有机溶剂乙醇对酶活具有抑制作用,同时角质酶粗酶对葡萄角质层具有降解作用。为灰葡萄孢霉角质酶粗酶酶活抑制因子的发现及果实采前处理或采后贮藏技术提供了一定的理论基础,同时为角质酶对植物角质层的降解作用提供了参考。角质酶与葡萄角质层之间的相互作用以及降解产物对葡萄抗病性的影响还有待进一步研究。

