水稻短根突变体ksr8的表型分析和基因克隆
林静霞 朱俊兆 虞 洁 陈星月 李浩然 郑文娟 朱世华 丁沃娜
(1宁波大学科学技术学院,浙江 宁波 315212;2宁波大学海洋学院,浙江 宁波 315211)
根系是维持植物生命活动的重要器官,它不仅能将土壤中的水分和养分输送给地上部,还能合成植物激素和必需物质,促使植株健康生长[1-2]。水稻(Oryza sativaL.)是单子叶模式植物,根系是直接影响水稻地上部形态、单产、抗逆性等众多农艺性状的重要器官;水稻根长是所有根系性状中最重要的性状。根系生长发育的调控机制非常复杂,涉及多个信号途径的交互作用,对水稻根系发育机制的探究是改良遗传效应和提高作物产量的重要手段,对水稻优质品系的培育具有重要意义[3-4]。近十几年来,已经分离出一批具有短根表型的水稻根系突变体,水稻根系功能基因的研究取得了较大进展。从细胞学的角度分析,根系变短主要有两个方面的原因:其一是根尖分生组织功能或结构存在缺陷,其二是根尖细胞伸长受到抑制[4]。
已克隆的水稻根系发育基因部分与根细胞的分裂有关,如AIM1、GLR3.1 和RRL3[5-7]。AIM1 编码参与β 氧化作用的3-羟酰基-辅酶A 脱氢酶,aim1 突变体的主根和不定根长度明显变短,根尖分生区变小,进一步研究表明aim1 突变体根尖分生组织细胞分裂能力降低导致其短根性状[5]。GLR3.1 是类谷氨酸受体基因,该基因突变导致水稻根系变短,glr3.1 突变体根的分生组织活性丧失,细胞程序性死亡,表明该基因对根尖分生组织细胞的分裂和存活具有关键作用[6]。研究发现RRL3 基因在外界机械刺激下特异调控根尖分生组织细胞分裂的过程,导致分生区缩小,最终造成突变体rrl3 的短根表型[7]。
OsSPR1、OsCYT-INV1 和OsKASI等基因与根尖细胞的伸长有关[8-10]。OsSPR1 是一种参与胚后根伸长的线粒体基因,Osspr1 突变体根成熟区细胞的伸长严重受阻[8]。OsCYT-INV1 编码一个中性/碱性转化酶,Oscyt-inv1 突变体呈现短根表型,切片显示该突变体根细胞的长度变小,伸长区细胞发生皱缩[9]。OsKASI编码β-酮脂酰-酰基载体蛋白合酶,该酶参与脂肪酸的合成,OskasI突变体根系明显缩短,其主根伸长区和成熟区的细胞长度仅为野生型的四分之一[10]。
此外,还有一些调控水稻根长的基因与细胞分裂和细胞伸长有关。OsGLU3 编码一个β-1,4-葡聚糖内切酶,调控细胞壁的松驰,Osglu3-1 突变体成熟区细胞的长度仅为野生型的三分之一,分生组织细胞分裂活性降低[11]。OsDGL1 编码一个多萜长醇二磷酸寡糖蛋白环糊精糖基转移酶亚基,Osdgl1 突变体根中N糖基化过程受损,成熟区细胞长度变短,分生组织变小[12]。OsGatB基因编码一个谷氨酰tRNA 酰胺基转移酶B 亚基,Osgatb突变体的主根生长缓慢,根尖分生组织长度小于野生型,成熟区细胞长度明显变短[13]。OsMOGS基因编码甘露寡糖葡萄糖苷酶,该基因在细胞快速分裂的组织中强烈表达,osmogs突变体表现出根细胞分裂和伸长的严重缺陷[14]。
本研究从甲基磺酸乙酯(ethylmethane sulfonate,EMS)诱变的籼稻Kasalath 突变体库中筛选得到水稻短根突变体ksr8,对该突变体进行表型鉴定、遗传分析、突变基因的图位克隆、转基因互补验证以及短根细胞学基础分析,旨在了解该水稻突变体根系发育的分子机制。
1 材料与方法
1.1 试验材料
从EMS诱变的籼稻(Kasalath)突变体库中筛选出水稻短根突变体ksr8,连续自交几代,确保其突变性状可稳定遗传。将野生型籼稻Kasalath(WT)和粳稻Nipponbare 分别与突变体ksr8 杂交,将得到的F1群体用于表型观察,通过F1自交获得的F2群体用于遗传分析和基因定位。
1.2 表型分析
WT 和突变体ksr8 的幼苗均采用溶液培养法[15]培养,7 d 后观察幼苗表型并拍照,分别测量幼苗的株高、主根长、不定根长和侧根长,统计不定根的数目,每个样本统计20 株。
将水培20 d 的水稻幼苗移到大田栽培种植,待其成熟时,随机选取长势正常的WT 和突变体ksr8,对整株及稻穗拍照,并统计株高、分蘖数和每穗实粒数等农艺性状,每个样本统计10 株。
1.3 根尖树脂切片和染色
分别对水培5 d 的WT 和突变体ksr8 根尖的分生区、伸长区和成熟区进行树脂包埋,并制备半超薄切片,切片染色后拍照[16];对水稻幼苗根尖部分进行醋酸洋红染色并观察拍照。
1.4 突变基因的图位克隆
1.4.1 分子标记的选择和设计[17]根据Gramene 网站(http://www.gramene.org/)中已公布的SSR(simple sequence repeat)分子标记,选择覆盖水稻12 条染色体且遗传距离均匀分布的多态性SSR 引物,用于突变基因的初定位。根据粳稻Nipponbare 和籼稻Kasalath 间的序列差异设计初定位区间内具有多态性的InDel(insertion-deletion)标记进行精细定位。
1.4.2 基因定位 使用简易TPS 法[18]从水稻的叶片中分别提取Kasalath、Nipponbare、F1和F2分离群体的DNA。将F2分离群体中30 个短根株系的DNA 等量混合以形成突变体基因池,并通过PCR 扩增靶基因,再用非变性聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)检测PCR 产物,银染显色后观察带型,判断连锁关系,对于疑似连锁的标记采取进一步解包验证。在初步确定粗定位区间后,设计新的分子标记,扩大定位群体,缩小定位区间。通过水稻基因组数据库的网站(http://rice.plantbiology.msu.edu/cgibin/gbrowse/rice/)来分析定位区间内的候选基因,测序验证确定其突变位点,并对候选基因进行突变位点的保守分析。
1.5 转基因互补验证
根据KSR8 基因的启动子序列,设计上下游分别含SacⅠ和SmaⅠ酶切位点(下划线表示)的引物:PrKSR8-F(5′-AAAGAGCTCCCAGCCTACGACGCCACGA ACAGA-3′)和PrKSR8-R(5′-AAACCCGGGAAGTATCGT CGCCGAGGGTGTCCG-3′)。根据KSR8 编码序列(coding sequence,CDS),设计上下游分别包含SmaⅠ和SalⅠ酶切位点(下划线表示)的引物:KSR8-F(5′-A AACCCGGGATGGCCGCCGCCACCTCCCAA-3′)和KSR8-R(5′-AAAGTCGACTTATGAACTAATGCCAAGCTGAGT GC-3′)。以WT 叶片的DNA 和cDNA 为模板分别进行PCR 扩增,将扩增得到的KSR8 启动子片段及CDS分别与表达载体pCAMBIA1300 连接,构建好的回复载体由农杆菌介导转入突变体ksr8 愈伤组织中并分化成苗[19]。筛选根系正常的转基因植株进行繁种,获得纯合株系后进行表型分析。
1.6 突变体对外源精氨酸的响应分析
在含有0.5 mmol·L-1CaCl2水溶液的培养框中分别加入不同浓度梯度的精氨酸母液,使精氨酸终浓度分别为0、0.05、0.1、0.2、0.5 mmol·L-1。WT 和突变体ksr8 已萌发的种子在上述培养液中培养7 d 后观察幼苗全株表型、拍照并统计其主根长度。
2 结果与分析
2.1 突变体ksr8 的表型鉴定
对培养7 d 的WT 和突变体ksr8 幼苗进行表型观察,发现突变体ksr8 的地上部和根系发育均存在缺陷。突变体ksr8 的株高只有WT 的59.43%(图1-A、表1),主根和不定根的长度受到极显著抑制,分别只有WT 的15.53%和15.96%(图1-B、表1),但不定根数较WT 有显著增加(图1-C、表1)。体式镜下观测到突变体ksr8的侧根长度只有WT 的48.61%(图1-C、表1),ksr8 靠近根尖部位的根毛浓密且长(图1-C)。
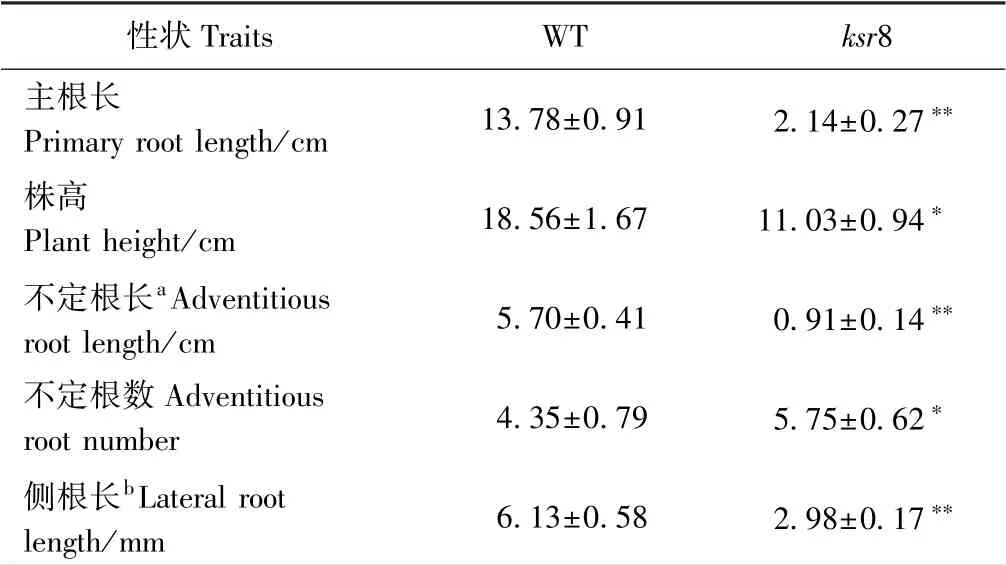
表1 WT 和突变体ksr8 水培7 d 幼苗表型比较Table 1 The characteristics of 7-day-old hydroponic seedlings of wild type and ksr8 mutant

图1 WT 和突变体ksr8 水培7 d 幼苗表型Fig.1 Phenotypic characterization of 7-day-old hydroponic seedlings of wild type and ksr8 mutant
2.2 突变体ksr8 的农艺性状分析
比较成熟期WT 和突变体ksr8 的农艺性状发现,突变体ksr8 的株高只有WT 的74.77%(图2-A、C);分蘖数极显著下降,只有WT 的15.87%(图2-C);每穗实粒数也减少,为WT 的77.33%,且芒刺退化(图2-B、C)。综上,突变体ksr8 的基因突变不仅限制了根系的发育,而且对水稻的单产也有影响。
2.3 突变体ksr8 根尖的树脂切片和染色分析
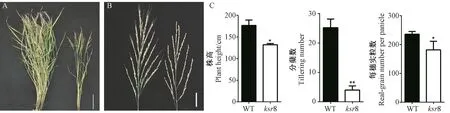
图2 WT 和突变体ksr8 成熟期表型Fig.2 Phenotype of wild type and ksr8 mutant at mature stage
经树脂半超薄切片纵切发现,突变体ksr8 主根成熟区的细胞形态与WT 相似(图3-A、D),但分生区和伸长区的细胞形态与WT 相比差异显著(图3-B、C),分生区明显变短(图3-C),伸长区细胞伸长受到严重抑制(图3-B),细胞长度仅为WT 的47.01%(图3-D)。醋酸洋红染色可用于观察分生区组织长度,结果显示,突变体ksr8 的根尖染色区域长度仅为WT 的48.39%(图3-E、F)。由此可见,突变体ksr8 的短根表型与伸长区细胞变短和根尖细胞分裂功能缺陷有关。此外,突变体ksr8 的根冠长度也明显变短(图3-C)。
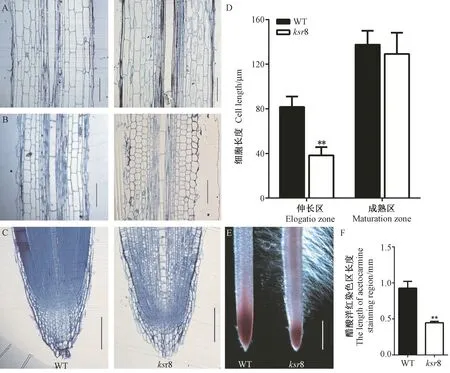
图3 WT 与突变体ksr8 的根尖细胞形态分析Fig.3 Morphological analysis of root tip cells of wild type and ksr8 mutant
2.4 突变体ksr8 的遗传分析
WT 与突变体ksr8 杂交获得的F1个体根系正常,均表现出与WT 相同的长根性状,这表明突变体ksr8的短根性状由隐性核基因控制。F1自交产生的F2群体经溶液培养7 d 后出现了性状分离,其中447 株F2植株中有326 株为正常表型,有121 株为短根表型,经卡方检验符合3∶1分离比(χ2=1.02<χ20.05=3.84)(表2)。
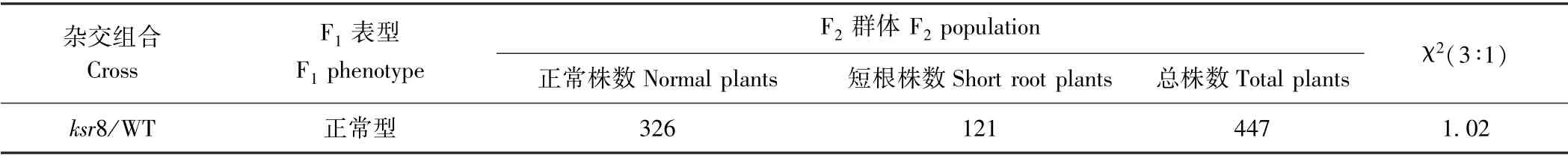
表2 突变体ksr8 的遗传学分析Table 2 Genetic analysis of short root mutant ksr8
2.5 KSR8 基因的图位克隆
以Kasalath、Nipponbare 和F1的DNA,以及混合30 株短根突变体的DNA 混合形成的突变池为模板,用在水稻12 条染色体上均匀分布的115 对SSR 引物进行目的基因的初步定位,发现KSR8 基因可能与3号染色体的分子标记RM3280 连锁。扩大定位群体,增加了531 株短根单株,在RM3280 物理位置附近设计了4 对有多态性的InDel 标记,最终将突变基因定位在分子标记InD3 和RM3280 之间,物理距离约106 kb(图4-A)。定位区间候选基因测序分析发现,基因号为LOC_Os03g19280 的候选基因第3 外显子上发生了单碱基突变;生物信息学分析该基因编码精氨酰琥珀酸裂解酶,CDS 全长1 560 bp,包含7 个外显子,编码519 个氨基酸,其CDS 序列653 bp 处的G 突变成A,导致第218 位精氨酸(R)突变成赖氨酸(K)(图4-B、C)。KSR8 与同源蛋白的序列比对分析表明,ksr8中突变的氨基酸残基是保守的,表明它可能是该蛋白功能的重要残基(图4-D)。

图4 KSR8 基因的图位克隆Fig.4 Map-based cloning of KSR8 gene
2.6 KSR8 基因的互补验证分析
为验证KSR8 基因突变导致ksr8 产生突变的表型,构建自身启动子驱动的KSR8 基因的回复载体,经农杆菌介导侵染ksr8 突变体愈伤组织并成功获得回复株系。筛选出长根性状的转基因苗进一步繁种纯化并选择出纯合植株,最终得到的转基因恢复水稻苗的表型与WT 相一致(图4-E)。
2.7 突变体ksr8 对外源精氨酸的响应分析
观察外源精氨酸处理培养7 d 后的幼苗,发现经过不同浓度精氨酸处理后突变体ksr8 和WT 的表型变化明显不同,随着精氨酸浓度的升高,WT 的根伸长受到抑制,而突变体ksr8根系在0.1、0.2 和0.5 mmol·L-1浓度下表型逐渐开始恢复,特别是主根的缺陷表型(图5-A),且随着精氨酸浓度的升高恢复越明显(图5-B),在0.5 mmol·L-1精氨酸处理下突变体ksr8 和WT 的根长基本一致,表明精氨酸参与调控突变体ksr8 的根系发育,且适当的精氨酸浓度对水稻根系的正常发育具有积极作用。
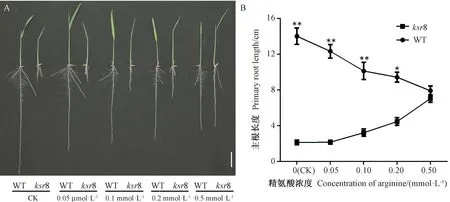
图5 添加外源精氨酸对水稻根发育的影响Fig.5 Effect of the exogenous addition of arginine on root growth
3 讨论
水稻根长作为根系最重要的性状,具有极强的可塑性[20]。目前已克隆的水稻根长相关基因有20 多个,大多数在不同的代谢途径和复杂的信号通路中起作用[4]。OsGNA1 编码葡糖胺-6-磷酸乙酰转移酶,参与尿苷二磷酸-N-乙酰葡糖胺的合成,是维持水稻根细胞的正常代谢和形态所必需的[21];OsGLU3 编码一个β-1,4-葡聚糖内切酶,能通过调控细胞壁的松驰来调节根的伸长[11];OsCCC1 编码K+/Na+/Cl-协同转运蛋白,通过调控K+/Na+/Cl-平衡以维持细胞渗透势,参与细胞伸长[22];OsKASI编码β-酮脂酰-酰基载体蛋白合酶,通过参与脂肪酸合成来调控水稻根系发育[10];OsARF12 编码一个生长素应答基因的转录激活因子,通过影响生长素信号传导以介导水稻根的伸长[23]。这些基因突变后均造成突变体主根、不定根和侧根变短,本研究筛选到的突变体ksr8 的根系表型与上述突变体类似,通过基因图位克隆发现KSR8 基因编码一个精氨酰琥珀酸裂解酶。
氨基酸作为含氮的小分子有机化合物不仅是构建细胞、修复组织的基础材料,还是合成核苷酸、激素、生物碱及多胺等多种含氮化合物的前体物质[24],在植物的生长发育、养分吸收及应对某些非生物胁迫等方面都具有重要的作用[25-26]。精氨酸作为植物体内功能最多的一种氨基酸,其生物合成途径有8 个步骤,涉及乙酰谷氨酸合成酶、乙酰谷氨酸激酶、乙酰谷氨酸还原酶、乙酰鸟氨酸氨基转移酶、乙酰谷氨酸鸟氨酸乙酰基转移酶、鸟氨酸氨甲酰基转移酶、精氨酰琥珀酸合成酶以及精氨酰琥珀酸裂解酶8 种酶的催化反应[27]。目前,有关精氨酸合成途径基因调控植物根系发育的报道较少,拟南芥TUMOR PRONE5(TUP5)基因编码乙酰鸟氨酸氨基转移酶(acetylornithine aminotransferase,ACOAT),催化精氨酸生物合成的第四步,该基因突变造成根系变短,突变体tup5-1 的短根表型可以通过添加外源精氨酸来恢复[28]。研究发现一个编码精氨酰琥珀酸裂解酶的基因OsASL1 参与调控水稻根系的正常发育,突变体osred1 呈短根表型,添加外源精氨酸可以恢复突变体的短根表型[29-30]。本研究通过图位克隆技术克隆到的KSR8 基因也编码精氨酰琥珀酸裂解酶,该酶催化精氨酸生物合成的最后一步,但测序结果显示ksr8 和osred1 的突变位点不同,表明突变基因ksr8 和OsASL1 基因等位。
本研究结果显示,OsASL1 基因突变会导致突变体ksr8 和osred1 的根系发育严重受阻,且两者的短根表型与伸长区细胞变短和分生区细胞分裂缺陷有关,转基因互补试验证实OsASL1 基因突变导致短根表型,外源添加精氨酸均可恢复两者的根系缺陷表型。但ksr8和osred1 在突变方式以及表型上存在差异,从突变方式来看,osred1 是粳稻品种Nipponbare 在愈伤组织再生过程中引起的突变品系,OsASL1 基因第2 外显子内(CDS 419 bp 处)的G 突变成了T,导致其蛋白序列第140 位的精氨酸(Arg)突变成了亮氨酸(Leu),从而引起短根表型;而突变体ksr8 则是由籼稻Kasalath 经EMS诱变后筛选得到,该突变性状是由OsASL1 基因的第3 外显子内发生点突变造成的,其CDS 序列653 bp 处的G 突变成A,导致编码的第218 个氨基酸精氨酸(Arg)突变成赖氨酸(Lys)。从表型上看,突变体osred1 和ksr8 的地上部存在差异,osred1 幼苗株高与野生型相似,而7 d 苗龄ksr8 的株高仅为野生型的59.43%,表明OsASL1 基因不同背景和位点的突变对地上部生长发育的影响有所不同。此外,本研究还统计了突变体ksr8 成熟期的农艺性状,发现其株高、分蘖数、每穗实粒数等重要的农艺性状都受到显著影响,表明OsASL1 不仅参与水稻根系的生长发育,而且与水稻单产密切相关。
对水稻根系发育缺陷突变体的挖掘和研究,使得对水稻根系发育遗传调控机制的认识取得了重大进展。本研究对突变体ksr8 的表型鉴定、遗传分析、图位克隆及转基因互补验证等分析表明精氨酸是水稻根正常伸长所必需的,为进一步探究精氨酸调控植物根系细胞分裂和细胞伸长的分子机制提供了理论基础。
4 结论
本研究在水稻中克隆得到OsASL1 基因,该基因编码催化精氨酸合成通路最后一个步骤的精氨酰琥珀酸裂解酶。转基因互补试验证实OsASL1 的点突变引起ksr8 的短根表型,分析发现ksr8 根的分生区细胞分裂功能存在缺陷,伸长区细胞显著变短,表明OsASL1 的突变可能会抑制水稻根细胞的正常分裂与伸长,最终导致根系变短。此外,结果显示添加外源精氨酸可以恢复ksr8 的根系缺陷表型,这表明适量的精氨酸在水稻根系伸长发育过程中发挥重要作用。因此,OsASL1可能通过参与精氨酸生物合成途径来调节水稻根系游离精氨酸的浓度,进而影响根细胞的分裂与伸长,最终决定水稻的根系性状。本研究为明确OsASL1 在水稻根系发育过程中的作用机理奠定了基础,并为进一步揭示精氨酸调控植物根细胞正常分裂与伸长的分子机制提供了宝贵的基因资源和理论依据。

