温度胁迫对幼体大海马基因转录表达的影响
潘 霞 徐永健 宁 燕 沈锡权
(宁波大学海洋学院,浙江 宁波 315211)
海马(Hippocampus)是中国水产经济中重要的高价值海水鱼类,在中药、海洋水族以及纪念品市场有很大的贸易成交量[1-2]。中医认为,海马具有补气活血、补肾壮阳的功效,是治疗阳痿、不育等疾病的佳品[3-4]。大海马(Hippocampus kudaBleeker)广泛分布在热带印度洋-太平洋地区,通常生活在较浅的近海栖息地,包括红树林、海草床和河口等[5]。海马的生长适温范围为12~33℃,最适温度为19~28℃,但其对温度急性变化的适应能力差,常由于水温的急剧变化而患病甚至死亡[6]。水温是影响鱼类生长发育的重要环境因素之一,水温骤变影响鱼类的摄食、代谢、生长,还可能造成分解代谢加强,合成代谢减弱[7]。为了减轻和避免海马养殖过程中温度骤变所产生的有害影响,有必要研究高/低温影响大海马的分子生理机制。
分析温度骤变前后的转录组学,可以较好地反映大海马对温度的应激调控。转录组测序(RNA-Seq)结合了转录组测序的实验方法和数字基因表达谱的信息分析方法,可用于研究特定生物过程中基因的差异表达,具有通量高、重复性好、检测范围广等优点[8],已被证明是许多非模型鱼对各种试验条件转录反应的可靠评估方法[9],其中在硬骨鱼研究中主要涉及发育、适应性进化、免疫应答和应激反应等[10]。此外,RNASeq 也被用于研究硬骨鱼温度适应和驯化所涉及的分子机制,如鲶鱼[11]、虹鳟鱼[12]和斑马鱼[13]。当前,对海马的研究主要集中在温度、盐度、疾病等生理生化层面,鲜有研究采用RNA-Seq 技术分析温度胁迫下大海马的转录表达变化。本研究以大海马幼体为研究对象,采用RNA-Seq 技术对温度骤变前后大海马肝脏组织进行转录组测序,分析不同试验组之间基因转录表达的差异,以期挖掘温度应激调节的候选标志基因,为阐明其分子机制提供理论基础。
1 材料与方法
1.1 试验材料
大海马(H.kuda)幼体由宁波大学海马养殖研究实验室培育。挑选健康、活力良好的幼体,体重为0.301 2±0.027 6 g,体长为5.35±0.18 cm,两者均无显著性差异。在循环水养殖系统中暂养1 周,以避免其他环境因素的干扰。暂养温度为25±0.5℃,盐度25‰,充氧DO>5 mg·L-1,试验用海水为经砂滤后的天然海水,每天定时投喂2 次,摄食2 h 后进行吸污。试验水温设置:对照组(CK)25℃,高温胁迫组(H-test)31℃,低温胁迫组(L-test)19℃,盐度均为25‰。温度胁迫12 h 后,每组随机取5 尾大海马的肝脏置于冻存管,液氮速冻,于-80℃冰箱中保存备用。
1.2 RNA 提取、文库构建和测序
参考Liu 等[11]的方法,通过混样以消除个体之间的差异。采用RNAiso plus 试剂盒(大连宝生物有限公司)从肝脏样品中提取总RNA。采用K5500 分光光度计(北京凯奥科技发展有限公司)测量260、280 nm波长处的吸光度值,并用1%琼脂糖电泳检查RNA 样品的纯度和完整性。采用Bioanalyzer 2100 系统(Agilent Technologies,美国)评估RNA 的浓度和完整性。每个样品各取2 μg RNA,采用NEBNext® UltraTMRNA 文库制备试剂盒(New England Biolabs,美国)按照制造商的建议构建测序文库。在Illumina 平台上测序,测序策略为PE150[安诺优达基因科技(北京)有限公司]。
1.3 转录组的组装、注释和差异表达基因分析
使用Perl 脚本处理原始数据以确保用于信息分析的数据质量,包括去除接头污染的Reads、低质量的Reads 以及含N 比例大于5%的Reads。过滤后得到的Clean Data,统计其质量、数据量等性状,包括过滤后的总序列中质量值大于30(错误率小于0.1%)的碱基数的比例(clean Q30 bases rate,Q30)、数据量、碱基含量等。采用Trinity 软件进行组装,对得到的全长转录本进行评估,然后进行开放阅读框(open reading frame,ORF)预测和功能分析。采用RPKM 方法计算基因表达量[14],DEGseq v1.18.0 软件[15]用于差异表达基因(differentially expressed genes,DEGs)分析。选取Q≤0.05 和|log2 ratio |≥1 的基因为DEGs,对其进行GO基因本体(Gene Ontology)富集分析和京都基因与基因组百科全书KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析。
1.4 实时荧光定量PCR(RT-qPCR)分析
选取13 个DEGs 对RNA-Seq 结果进行验证,根据转录组文库中的Unigene 序列,用Primer Premier 5 软件设计特异性引物(表1)。以β2-微球蛋白(beta-2microglobulin,B2M)为内参基因,采用2-ΔΔCt法[16]计算目的基因的相对表达水平。采用TB Green Premix Ex TaqTMⅡ(Tli RNaseH Plus)(TaKaRa,大连)进行定量表达检测,在Eppendorf realplex4中进行。每组共9 尾鱼,3 尾大海马肝脏为一个混样,设3 个重复。
2 结果与分析
2.1 大海马肝脏mRNA 测序结果及从头组装
高通量测序显示(表2),CK、H-test 和L-test 组分别获得49 556 386、49 404 042、48 043 100 个原始读段(raw reads)。过滤后分别获得47 880 348、47 987 534和46 520 778 个clean reads。Q30 值均在94%以上,说明该数据可靠。由表3可知,高质量的测序数据用Trinity 软件组装后生成了86 712 个转录本,长度在200~2 000 bp 之间,平均长度为1 443.25 bp,N50 长度为2 485 bp。所得转录本序列进一步组装处理后获得42 264 个单基因簇(Unigene),平均长度为1 122.71 bp,N50 为2 223 bp。其中,在200~600 bp 范围内的Unigenes 占53.27%,600~1 000 bp 占12.41%,1 000~2 000 bp 占16.30%,2 000 bp 以上的Unigenes 为18.02%。
2.2 基因功能注释
将获得的Unigene 数据信息分别在蛋白质家族域数据库(Pfam)、蛋白质序列数据库(Swiss-Prot)、非冗余蛋白数据库(Nr)、真核生物蛋白相邻类的聚簇(KOG)、基因本体论数据库(GO)和东京基因与基因组百科全书(KEGG)等数据库比对注释。由表4可知,Nr 数据库中注释的Unigenes 所占比例最多,达53.64%;核酸序列数据库(Nt)注释的Unigenes 占44.49%;19 506 个Unigenes 在GO 数据库中得到了注释,占46.15%;KEGG 数据库注释的Unigenes 最少,共12 046 个。GO 分为分子功能(molecular function)、生物过程(biological process)和细胞组成(cellular component)3 个部分。利用Trinotate 的注释结果,统计每个GO 条目中注释到的基因,并根据二级GO 条目得到统计结果(图1)。生物学过程的主要类别是细胞过程,占74.74%,其次是生物调节和代谢过程,分别占56.7%和49.7%;在分子功能类别中最主要的类别是结合功能(72.88%)和催化活性(35.33%);细胞组成部分中代表性的类别为细胞部分(87.25%)、细胞器(57.24%)和细胞器部分(45.36%)。在KOG 数据库中15 454 个基因注释到了25 个直系同源组(图2),其中信号转导机制(T,21.26%)与一般功能预测(R,21.06%)代表了最大的类群,其次是翻译后修饰/蛋白质周转/分子伴侣(O,8.29%)。
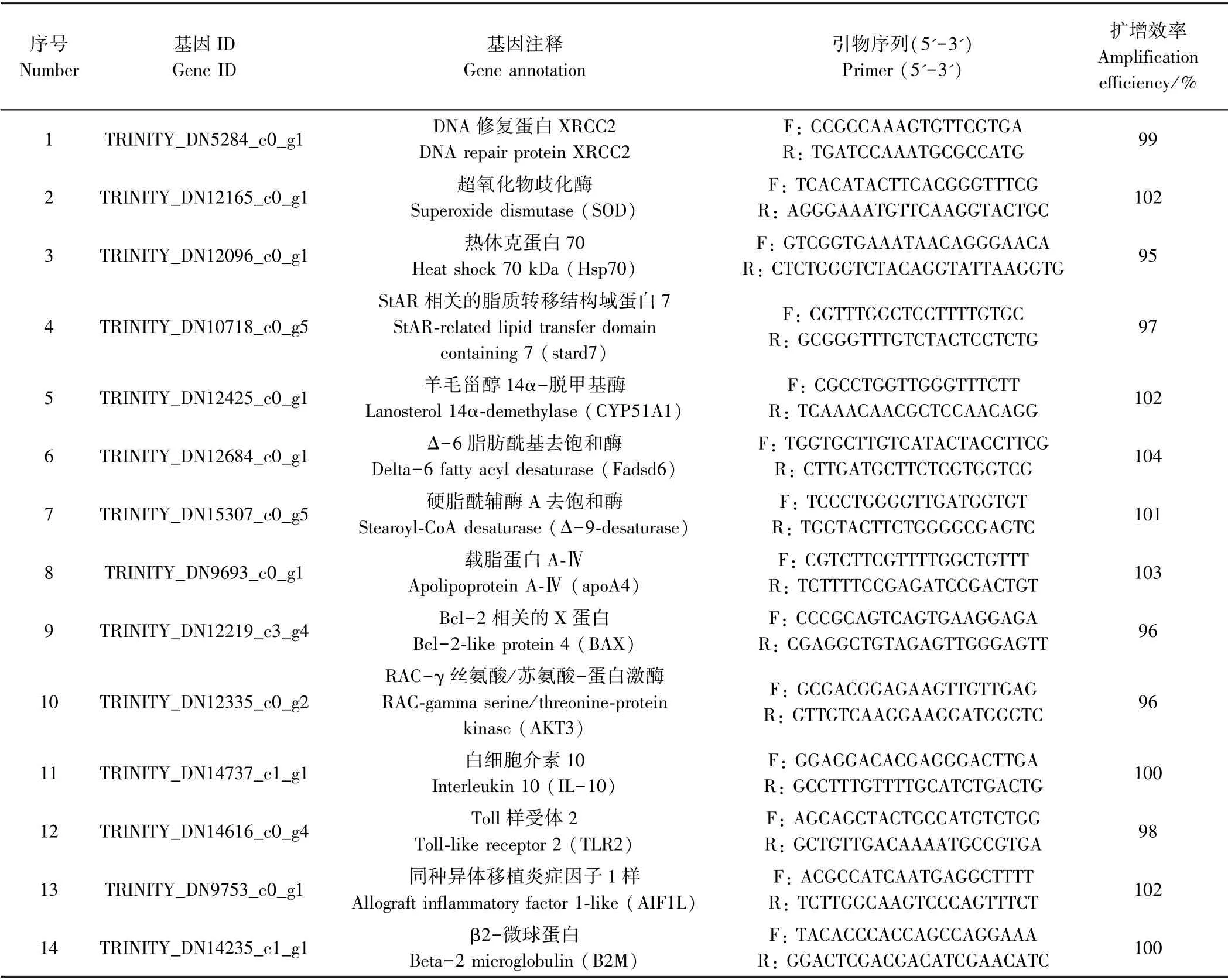
表1 RT-qPCR 所用基因及其引物序列Table 1 Genes used in RT-qPCR and their primer sequences
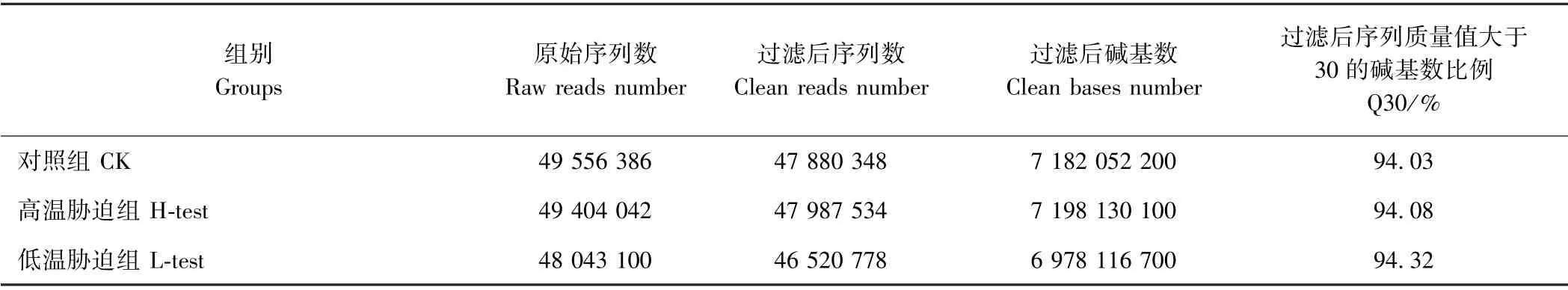
表2 大海马测序数据的统计汇总Table 2 Statistic summary of the sequencing data of H.kuda
由图3可知,H-test vs CK 获得14 009 个差异表达基因,其中显著上调5 543 个,显著下调8 466 个;Ltest vs CK 获得20 030 个差异表达基因(14 016 个差异基因显著上调,6 014 个差异表达基因显著下调)。高温胁迫组上调基因数量低于下调基因,而低温胁迫组中上调基因数量占比更高。由图4可知,两两比对后三组均显著差异表达的基因有2 851 个,H-test vs CK 与L-test vs CK 之间有7 324 个差异表达基因相同,而6 685 个差异基因仅在H-test vs CK 显著表达,12 706 个差异基因仅在L-test vs CK 显著表达。
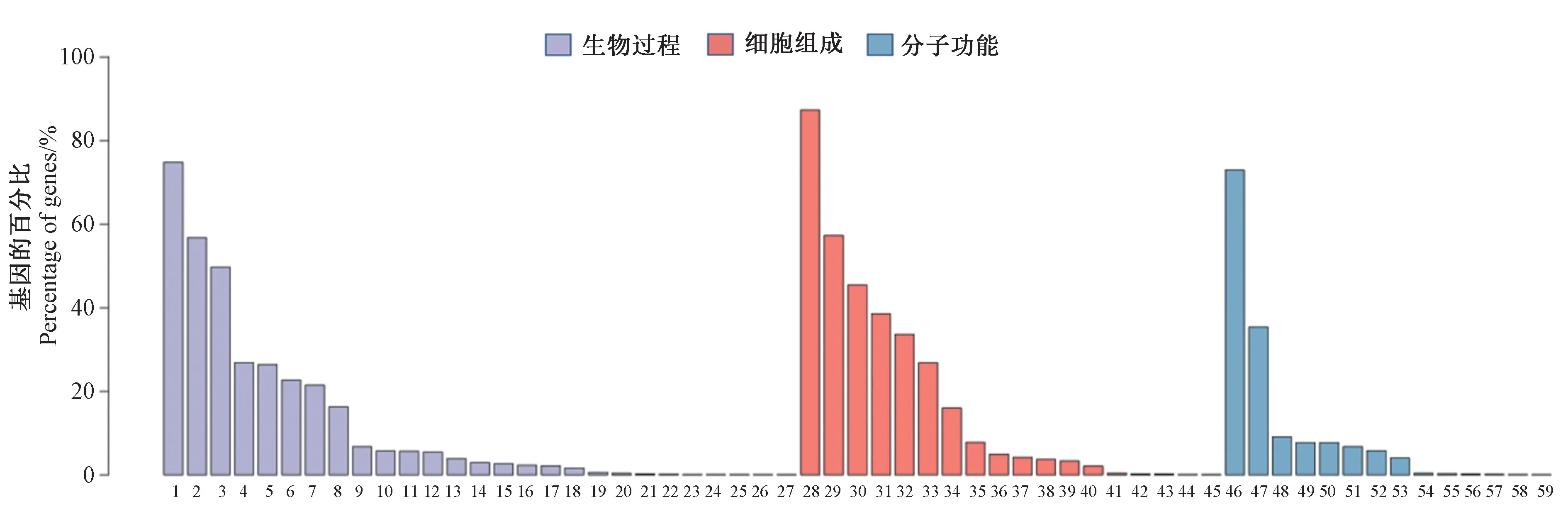
图1 GO 统计柱状图Fig.1 GO statistics histogram

表3 组装结果统计表Table 3 Assembly result statistics
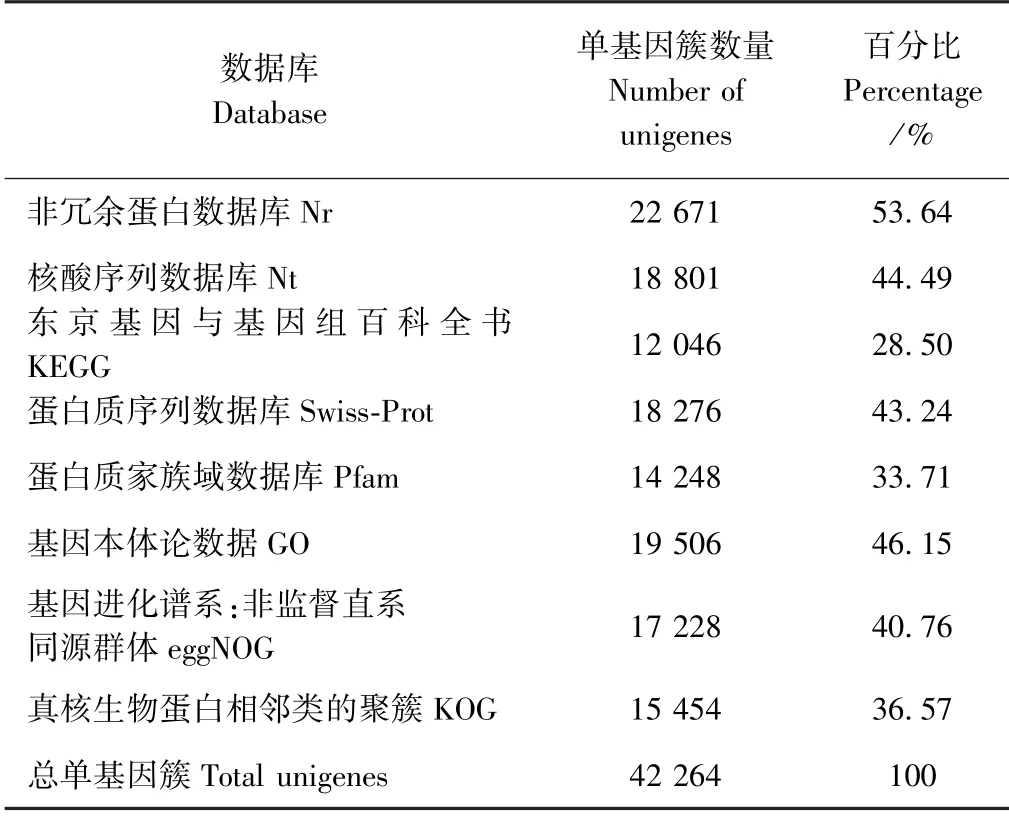
表4 各个数据库的注释汇总表Table 4 Summary of comments in each database
2.3 差异基因的KEGG 富集分析
KEGG 是一个综合数据库,大致分为系统信息、基因组信息和化学信息三大类,有助于了解生物系统的高级功能和实用性,如在基因和分子水平了解细胞、生物和生态系统的信息,其对差异表达基因的Pathway注释分析有助于进一步解读基因的功能[17]。差异表达基因在KEGG 数据库中富集,以Q<0.05 为标准,对KEGG 中每个Pathway 应用超几何检验进行富集分析,找出差异表达基因中显著性富集的Pathway。其中Q 值为多重假设检验校正之后的P值,Q 值越小,表示差异表达基因在该通路中的富集显著性越高[18]。本研究中,H-test vs CK 的差异表达基因富集到332 条通路,显著富集的通路主要是蛋白质消化吸收、类固醇生物合成以及细胞外基质ECM-受体相互作用,L-test vs CK 的差异表达基因富集到332 条通路,显著富集的通路为同源重组及DNA 复制。

图2 KOG 功能分类统计图Fig.2 KOG function classification chart

图3 大海马肝脏转录组中差异表达基因个数统计图Fig.3 Statistical diagram of differentially expressed genes in liver transcriptome of H.kuda

图4 大海马肝脏转录组中差异基因韦恩图Fig.4 Venn diagram of differential gene in liver transcriptome of H.kuda
表5、表6 为富集得到的前20 个KEGG 代谢通路,其中高温胁迫组中免疫途径(如ECM-受体相互作用、IgA 肠道免疫网络、军团菌病、PI3K-Akt 信号通路等)、代谢通路(如蛋白质消化吸收、类固醇生物合成、脂肪消化吸收、甘油酯代谢等)及细胞凋亡(依赖于铁的程序性细胞死亡)等受到影响。涉及的显著表达基因主要有SOD、HSP70、HSP90、PIK3R、CYCS、CASP9、CASP3、P21、Akt、IL-10、TLR、CCR9、MHC2 等。低温胁迫主要涉及DNA 损伤修复(如同源重组、DNA 复制、细胞周期、核苷酸切除修复、碱基切除修复等)及代谢(花生四烯酸代谢、谷胱甘肽代谢、糖酵解等)等过程。筛选发现SOD、HSP70、HSP90、P21、P53、BAX、HSP70、HSP90、StARD7、ApoA4、CYP51、Fadsd6、MSH、DDB2、XRCC2、RAD52、Ogg1、PMS2 等基因在低温应激中发挥重要作用。
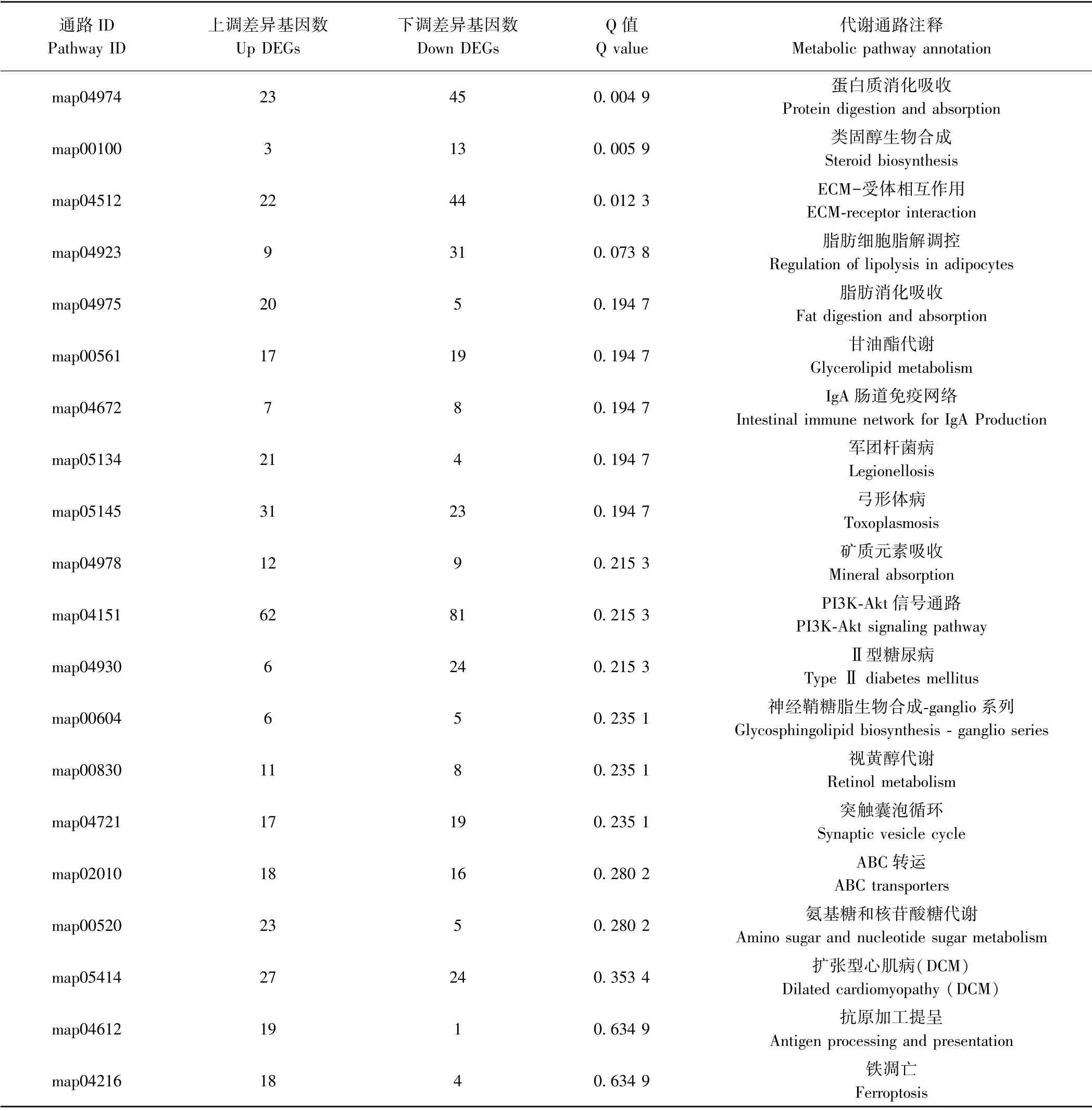
表5 H-test vs CK 差异基因富集的前20 个KEGG 代谢通路Table 5 Top 20 KEGG metabolic pathways enriched in H-test vs CK differential genes
2.4 实时荧光定量PCR 结果
为验证基于RNA-Seq 方法检测的结果是否准确,随机选取13 个差异表达基因(表1)进行验证。以B2M作为内参基因,采用RT-qPCR 相对定量方法检测这些基因在试验组与处理组中的转录表达差异。将RT-qPCR 方法检测结果与转录组分析结果进行比较,结果表明,13 个被测基因的RT-qPCR 相对表达与RNA-seq 相对表达水平趋势基本一致(图5、图6),证明了转录组分析结果的可靠性。

表6 L-test vs CK 差异基因富集的前20 个KEGG 代谢通路Table 6 Top 20 KEGG metabolic pathways enriched in L-test vs CK differential genes

图5 高温胁迫组RT-qPCR 及RNA-Seq 的比较分析Fig.5 Comparative analysis of RT-qPCR and RNA-Seq in H-test

图6 低温胁迫组RT-qPCR 及RNA-Seq 的比较分析Fig.6 Comparative analysis of RT-qPCR and RNA-Seq in L-test
3 讨论
夏季高温或冬季寒潮[19]以及人工养殖过程中换水等水温骤变对水产生物的生长、发育和摄食等方面均有较大影响[20]。本研究分析了高/低温胁迫处理的幼体大海马肝脏转录组变化,高/低温胁迫组与对照组相比分别获得差异表达基因14 009 个和20 030 个,表明温度胁迫可能激活了多种细胞代谢,以应答温度应激对大海马幼体造成的伤害。高/低温胁迫均造成了抗氧化以及细胞凋亡方面相关基因表达的显著改变,如超氧化物歧化酶(SOD)、热休克蛋白(HSP70、HSP90)、细胞色素C(CYCS)、半胱天冬酶- 9(CASP9)、半胱天冬酶-3(CASP3)、细胞周期蛋白依赖性激酶抑制剂(P21)、肿瘤蛋白P53、Bcl-2 相关的X蛋白(BAX)等。此外,高温胁迫组中免疫途径中磷脂酰肌醇3-激酶调节亚基(PIK3R)、P21、RAC-γ 丝氨酸/苏氨酸-蛋白激酶(Akt)、白细胞介素10(IL-10)、Toll 样受体(TLR)等基因表达发生显著变化。而低温胁迫组中脂肪酸合成和DNA 损伤修复的相关基因表达差异显著,如StAR 相关脂质转移结构域蛋白7(StARD7)、载脂蛋白A-Ⅳ(ApoA4)、羊毛甾醇14α-脱甲基酶(CYP51)、Δ-6 脂肪酰基去饱和酶(Fadsd6)、DNA 错配修复蛋白(MSH)、DNA 损伤结合蛋白DDB2、DNA 修复蛋白XRCC2、DNA 修复蛋白RAD52、8-氧代鸟嘌呤糖基化酶(Ogg1)、错配修复核酸内切酶PMS2 等。此外,本研究发现(图3)低温胁迫组上调基因数是高温胁迫组的2.6 倍,说明低温胁迫较高温胁迫组诱导了更多基因表达,在斑马鱼幼体[21]和大黄鱼幼体[19]中也发现了这样的现象,可能与大海马幼体阶段的耐寒能力有关。
温度胁迫会增加水生生物体内的活性氧(reactive oxygen,ROS)含量,其积累到一定程度会激发体内抗逆性和抗感染的重要生物分子HSP70、HSP90[22]和SOD等基因的表达量显著上调[23]。本研究中,高/低温胁迫处理均造成了HSP70、HSP90 和SOD等抗氧化相关基因显著上调,可能是为了消除体内的ROS,而热休克蛋白(heat shock proteins,HSPs)作为分子伴侣可防止有害蛋白质聚集,促进蛋白质正确折叠并帮助修复[24]。
细胞凋亡指为维持内环境稳定,由基因控制的细胞自主的有序死亡。高/低温胁迫均会导致细胞凋亡相关基因表达差异显著,但两者表达差异基因不同。本研究发现高温胁迫组中显著上调的基因主要是P21、CYCS、CASP9 和CASP3。而低温胁迫组差异表达的凋亡相关基因有P53、P21、BAX。细胞色素C 大量释放会激活Caspase-9,进而激活Caspase-3 后诱导细胞凋亡[25]。P53 参与多种修复DNA 损伤途径,如染色质重塑、碱基切除修复等[26]。而P21 是位于P53 基因下游的细胞周期蛋白依赖性激酶抑制因子,主要作用是减少受损DNA 的复制和积累,抑制细胞凋亡[27]。此外,BAX表达Bcl-2 相关的X 蛋白,通过抗氧化机制影响细胞凋亡[28]。本研究结果表明,高温胁迫激活了caspase 依赖的细胞凋亡途径,而低温胁迫则造成与抑制细胞凋亡的相关基因上调,并激活大量DNA 损伤修复基因,以抵抗低温伤害。
生物体受到温度、pH 值等刺激或细胞毒性损伤时,PI3K-Akt 信号传导途径会调节细胞凋亡、蛋白质合成和细胞周期等重要过程[29]。本研究结果表明,在高温胁迫下,PI3K-Akt 信号途径相关基因的表达受到显著影响(表5),共有62 个基因上调,81 个基因显著下调。此途径中的2 个关键基因PIK3R1 以及AKT3的表达均显著下调。而低温胁迫下,PI3K-Akt 信号传导途径总体未受到较大影响。Sun 等[30]在杂色鲍(Haliotis diversicolor)中也发现在热应激或缺氧及病原体攻击时,PI3K、AKT基因表达显著下调。此外,此途径中涉及免疫的差异基因有IL-10、TLR等显著上调,显著下调的差异基因有CC 趋化因子受体9 型(CCR9)、主要组织相容性复合物(MHC2)等。IL-10可下调T 辅助细胞因子(Th1 和Th2)、趋化因子和MHC Ⅱ类抗原的表达,是免疫和炎症的关键调节因子[31]。TLR 信号通路也在先天免疫防御机制中起关键作用[32]。以上结果表明,高温胁迫相较低温胁迫更可能导致大海马体内免疫系统紊乱,最终导致患病率上升。
本研究中,低温胁迫组中与脂肪酸代谢等有关的基因,如Fadsd6、ApoA4、StARD7 和CYP51 等基因表达显著上调,而高温胁迫组中仅ApoA4 显著上调。鱼的脂肪酸代谢对温度变化很敏感[33],膜脂肪酸去饱和被认为是鱼适应低温的一种重要机制,对维持膜的流动性、酶活力和细胞的正常功能至关重要[34]。研究发现,低水温可以增加硬骨鱼类Δ6-去饱和酶基因表达,而水温升高导致几种淡水鱼的Δ6-去饱和酶活性降低[35]。这可能是因为低温胁迫导致鱼体细胞中脂肪酸组成发生改变,增加膜脂的不饱和脂肪酸比率,以维持细胞膜流动性。载脂蛋白可能用于细胞增殖和组织修复期间支持细胞生长材料的运输。而StAR 蛋白是介导胆固醇生物合成中线粒体转运的限速蛋白[36],CYP51 是CYP 超家族中进化最保守的成员,而且是甾醇生物合成的关键酶[37]。本研究中低温胁迫导致类固醇及不饱和脂肪酸等相关基因表达上调,而在高温胁迫中相反,可能是因为脂肪酸对于大海马幼体抵抗低温应激有重要作用。
环境刺激会造成氧化和抗氧化系统之间的平衡被打破,导致DNA 受到损伤。细胞周期调节、蛋白质伴侣蛋白、DNA 修复等过程有降低DNA 损伤的作用[38]。本研究中,低温胁迫组富集了多条DNA 损伤修复途径(表6),如同源重组、DNA 复制、细胞周期、嘧啶代谢、核苷酸切除修复、碱基切除修复、错配修复、嘌呤代谢等。筛选得到的上调基因有MSH、DDB2、XRCC2、RAD52、Ogg1、PMS2 等。上述基因中,高温胁迫中显著上调的仅有PMS2,说明低温胁迫可能导致鱼体内产生DNA 损伤,诱导修复基因显著表达以抵抗低温应激。
4 结论
本研究采用RNA-Seq 技术,在新一代Illumina 测序平台,采用PE150 测序策略,构建了幼体大海马肝脏转录组数据库,获得了大量幼体大海马的转录组数据信息,并分别构建高温和低温应激后的基因表达数据库,对3 个数据库进行从头拼接、组装和分析,挖掘了温度胁迫相关的基因。通过转录组研究手段了解幼体大海马的温度应激反应,并初步了解其所涉及的重要过程和途径,为进一步研究温度应激的确切机制提供了基础,而且有助于预防极端温度对大海马造成损伤。

