炎症微环境对大鼠间充质干细胞增殖及Sirt6 表达水平的影响
王 开, 荆得宝, 于素平, 刘雪阳
(第二军医大学附属公利医院口腔科,上海 200135)
炎症性吸收是导致颌骨缺损的主要因素之一。颌骨缺损、 牙齿缺失往往伴有衰老趋势的出现,这不仅影响咀嚼功能和身心健康,甚至会诱发其他的系统性疾病。 如何重塑颌骨形态、抑制炎症性吸收,具有重要意义。 骨髓间充质干细胞(BMSCs)是一种具有多向分化潜能的细胞,可以通过体外诱导定向分化为成骨细胞,成为骨形成的基础,为研究颌骨重塑提供了可靠的来源。
Sirt6 是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖的组蛋白,是沉默配型信息调节蛋白家族(Sirtuin)的重要成员。 研究表明,Sirt6 不仅具有调节炎症反应的作用, 而且对多种细胞具有抗衰老的作用[1-4]。研究证明,Sirt6 是破骨细胞的抑制因子, 但是具体的发病机制尚不明确。 本研究基于牙周病的高发病率和颌骨破坏导致炎性衰老, 甚至会诱发其他系统性疾病为背景, 探讨炎症状态下,Sirt6 在大鼠BMSCs 中定向分化成骨中的作用, 为Sirt6 是否可作为靶向因子促进成骨提供理论基础。
1 材料和方法
1.1 实验动物
3~4 周龄SD 大鼠2 只,体质量为250~300 g/只,雌雄不限,由同济大学实验动物中心提供。
1.2 实验试剂及仪器
DMEM 培养基(Gibco 公司,美国),胎牛血清(杭州四季青公司, 中国),L-抗坏血酸400 μL(Sigma公司, 美国),β 甘油磷酸钠2 mL (Sigma 公司,美国),地塞米松20 μL(Sigma 公司,美国),ELISA 检测试剂盒(Sigma 公司,美国),低温冷冻离心机(卢湘仪离心机仪器有限公司, 中国), 酶标仪(BMG LABTECH 公司,德国),Nanodrop 2000 分光光度计(Thermo 公司,美国),倒置相差显微镜(Olympus 公司,日本),RT-PCR 荧光定量仪(ABI 公司,美国)。 本实验完成于第二军医大学附属公利医院中法合作中心实验室。
1.3 实验方法
1.3.1 SD大鼠BMSCs体外分离培养与鉴定 取SD 大鼠1 只,颈椎脱臼法处死,浸泡于75%乙醇中约5~10 min, 无菌手术器械取出双侧股骨及胫骨,去除附着肌肉,将其浸泡于适量培养基中。 针筒吸取适量培养基插入一端干骺端,将骨髓中细胞冲至培养皿中,反复几次,直至股骨及胫骨发白。 收集此细胞悬液,用200 滤网过滤,去除稍大的杂质,将过滤后的细胞悬液收集至离心管中,800 r/min 离心5 min,弃上清液,加入适量DMEM 培养基混匀后接种于培养瓶中培养,37 ℃、5%CO2饱和湿度孵育箱中培养48~72 h,更换培养基,注意动作轻柔。此后每隔3 d 更换培养基1 次。于9~12 d 后形成多个细胞集落, 长满瓶底约70%~80%后用0.25%胰酶消化,1∶2 传代培养[5-6]。流式细胞仪检测CD34、CD40、CD90、CD29 等表面分子, 其后进行BMSCs 的诱导分化,证实其成骨细胞分化、脂肪细胞分化等干细胞特性。
1.3.2 CCK-8法检测炎症微环境下大鼠BMSCs的增殖能力 取第3 代大鼠BMSCs, 将生长至70%~80%的细胞消化,离心,稀释至1×104个/mL,在96 孔板中加入100 μL/孔细胞悬液。 实验分为对照组,实验组(LPS 诱导组、LPS 过表达Sirt6 组)。 将合成的Sirt6 质粒测序后转染入BMSCs 中, 检测转染效率满足过表达率,构建过表达Sirt6 组,对照组不加入LPS; 实验组加入浓度为10 μg/mL LPS 0.1 mL/孔。分别观察12、24、48、72 h,每组设3 个复孔。 酶标仪测定450 nm 处的吸光度(A)值。
1.3.3 BMSCs体外多向分化能力的测定 取第3代生长良好的大鼠BMSCs 以1×105个/mL 的密度接种于6 孔板中,待细胞生长至70%汇合时加入成骨诱导液,21 d 后茜素红染色;成脂诱导:取第3 代生长良好的BMSCs 以1×105个/mL 的密度接种于6 孔板中, 待细胞生长至70%汇合时加入成脂诱导液,21 d 后油红O 染色。
1.3.4 免疫荧光技术检测Sirt6蛋白的分布 取第3 代大鼠BMSCs 消化,离心,稀释至1×104个/mL,然后接种在培养皿中的小盖玻片上, 对照组加少许培养液。 待细胞贴壁,加足量的干细胞培养基,实验组加入浓度为10 μg/mL LPS 2 mL, 培养72 h,用丙酮在室温下固定5 min,0.01%磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤;分别加入异硫氰酸荧光素 (fluorescein isothiocyanate, FITC)及4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)标记的Sirt6 抗体30 μL,室温暗处孵育1 h,0.01% PBS 洗涤,缓冲甘油封片,荧光显微镜下观察。
1.3.5 ELISA检测炎性因子TNF-α、IL-1β、IL-6的表达 用浓度为10 μg/mL 的LPS 刺激BMSCs,根据实验要求收集不同时间点(12、24、48、72 h)的细胞周围培养基,使用ELISA 试剂盒测定培养基中炎性因子TNF-α、IL-1β、IL-6 的含量。实验方法参照试剂盒说明书。 酶标仪波长450 nm 处时,读A值,根据标准品所制得标准曲线得到TNF-α、IL-1β、IL-6的含量值。
1.3.6 RT-PCR检测Sirt6的mRNA表达水平 LPS诱导组、 对照组和LPS 过表达Sirt6 组的细胞培养12、24、48、72 h 时,按照TRLzol 试剂说明书的要求提取细胞总RNA, 根据反转录试剂盒说明书要求采用特异性下游引物法反转录生成cDNA。Sirt6 上游 引 物:5'-AGGGTTGTCGCCATACGC-3', 下 游 引物:5'-GGAGGACTGCCACATCAGC-3';GAPDH 上游引物:5'-GGAGTCTACTGGCGTCTTCAC-3', 下游引物:5'-ATGAGCCCTTCCACGATGC-3'。 PCR 条件为95 ℃预变性60 s;95 ℃30 s、54 ℃45 s、72 ℃60 s,共30 个循环;72 ℃延伸10 min。检测Sirt6 的扩增效率,实验重复3 次取均值。采用2-ΔΔCt法计算mRNA 的相对表达量, 并灰度扫描进行Sirt6 表达的半定量分析。
1.3.7 Western blot技术检测BMSCs细胞中Sirt6的表达 分别于细胞培养时段12、24、48、72 h 时,收集对照组和LPS 诱导组细胞,加入去铁胺(deferoxamine,DFO)药物作用24 h,用预冷PBS 冲洗2 次,然后加入50 μL 细胞裂解液, 在振荡器上震荡数次,充分裂解后在冰上放置20 min,离心半径5 cm、12 000 r/min 离心5 min, 收集上清液行定量分析。取已定量的总蛋白进行12%SDS-聚丙烯酰胺凝胶电 泳 (SDS-polyacrylamide gel electrophoresis,SDSPAGE)实验,电转移至硝酸纤维素膜上,放入5%牛血清白蛋白(albumin from bovine serum,BSA),室温封闭过夜。 取出膜,于摇床上用TBST 缓冲液洗膜3 次, 每次10 min, 加入TBST 缓冲液稀释的Sirt6(Abcam 公司,1∶200),4 ℃孵育过夜。TBST 缓冲液洗膜3 次, 每次10 min, 加入辣根过氧化物酶(horseradish peroxidase,HRP) 标记的羊抗兔二抗(碧云天公司,1∶2 000) 和HRP 标记的羊抗小鼠二抗(碧云天公司,1∶2 000)室温孵育2 h。 TBST 缓冲液洗膜3 次,每次10 min。 将膜置于化学发光检测试剂(试剂A∶试剂B=1∶1)中反应2 min,取出膜,甩去多余液体,保鲜膜包好后在暗室中用X 线胶片感光、显影、定影,凝胶分析系统分析蛋白的表达。
1.4 数据分析
用GraphPad Prism 6 软件进行分析,2 组之间差异用t检验,多组间比较则采用单因素方差分析,P<0.05 认为差异有统计学意义。
2 结果
2.1 流式细胞仪检测BMSCs 中CD34、CD40、CD90、CD29 的表达
流式细胞仪检测结果显示:CD29 的阳性表达量>90%,CD90 的阳性表达量>90%; 而CD40 的阳性表达量<5%,CD34 的阳性表达量<5%。 此结果证明所培养的细胞为BMSCs(图1)。
2.2 CCK-8 检测不同条件下BMSCs 的增殖情况
绘制的细胞生长曲线表明, 细胞培养24 h 后,LPS 过表达Sirt6 组细胞增殖率高于LPS 诱导组及对照组,差异有统计学意义(P<0.05),且随着时间的延长,细胞增殖均具有逐渐增加趋势,LPS 诱导组的增殖趋势逐渐平缓(图2)。

图1 流式细胞仪检测BMSCs 细胞标记物Figure 1 Expression of BMSCs markers by flow cytometry
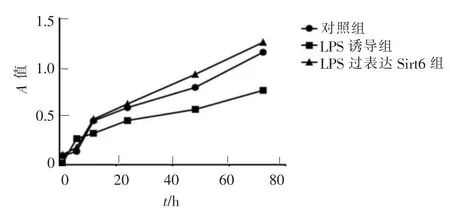
图2 CCK-8 检测不同条件下BMSCs 的增殖曲线Figure 2 Proliferation curves of BMSCs under different conditions by CCK-8
2.3 茜素红和油红O 染色测定
成骨诱导21 d 后,镜下可见钙结节形成,证明所培养的细胞具有成骨能力(图3A);成脂诱导21 d后,可见明显的脂滴状物形成,证明细胞也具有成脂能力(图3B)。
2.4 免疫荧光染色显示Sirt6 的表达
BMSCs 细胞爬片上,对照组DAPI 及FITC 染色结果显示Sirt6 蛋白的荧光表达分布 (图3C、3D);LPS 诱导组DAPI 及FITC 染色结果显示Sirt6 在细胞爬片上的表达(图3E、3F),证明Sirt6 在BMSCs 细胞核上呈阳性表达。

图3 BMSCs 的成骨、成脂分化和Sirt6 的免疫荧光表达Figure 3 Osteogenic differentiation and lipogenic differentiation of BMSCs and immunofluorescence expression of Sirt6
2.5 ELISA 检测BMSCs 培养基中炎性因子TNFα、IL-1β、IL-6 的表达
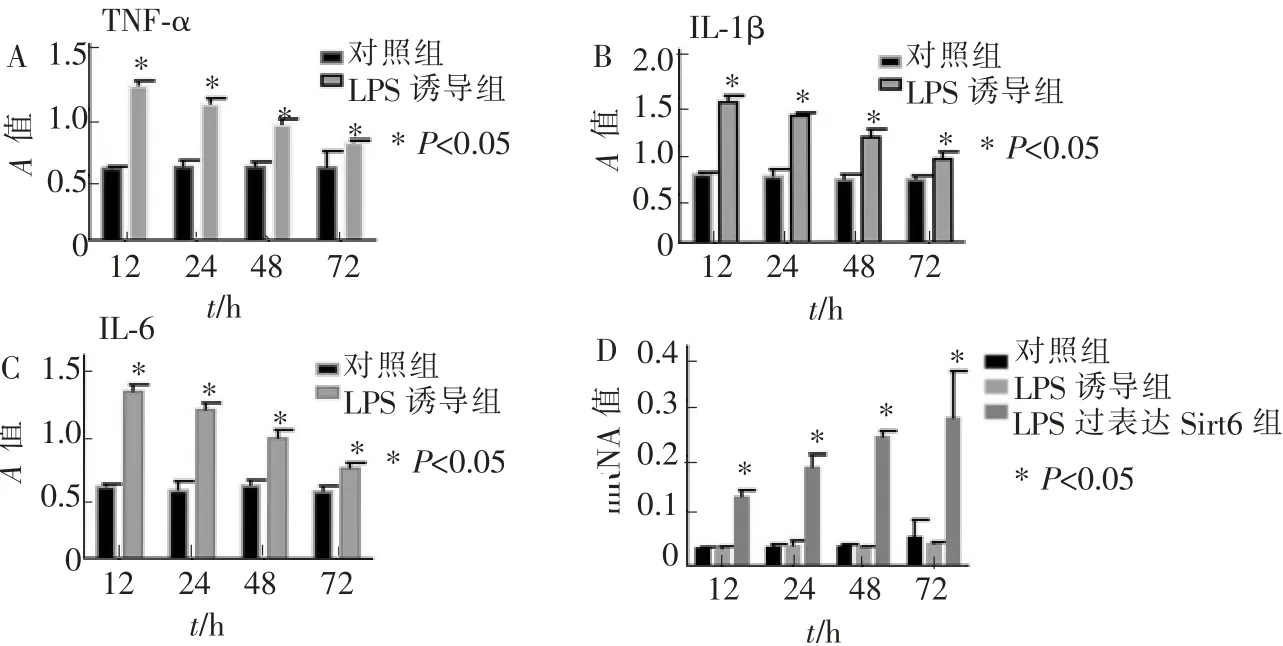
图4 炎性因子TNF-α、IL-1β、IL-6 的表达及Sirt6 的mRNA 水平Figure 4 Expression of inflammatory factors TNF-α、IL-1β、IL-6 and Sirt6 mRNA levels
如图4A~C 所示,与对照组相比,同一时间点LPS 诱导组中TNF-α、IL-1β、IL-6 的含量均呈现高表达,差异具有统计学意义(P<0.05);随着时间的延长,TNF-α、IL-1β、IL-6表达量逐渐出现下降趋势(P<0.05)。
2.6 RT-PCR 检测Sirt6 的mRNA 水平
同一时间段内, 相对于LPS 诱导组和对照组,LPS 过表达Sirt6 组中Sirt6 的mRNA 表达水平显著升高(P<0.05),差异具有统计学意义;随着时间的推移, 不同时间点内Sirt6 的mRNA 表达水平呈现显著性升高,差异有统计学意义(P<0.05,图4D)。
2.7 Western blot 技术检测BMSCs 细胞中Sirt6 的表达
Western blot 检测结果显示, 与对照组比较,同一时间点,LPS 诱导组中Sirt6 蛋白的表达均出现下降,差异具有统计学意义(P<0.05),且随着时间的推移,Sirt6 的蛋白表达并没有出现显著性下降, 差异无统计学意义(P>0.05)。 详见图5。
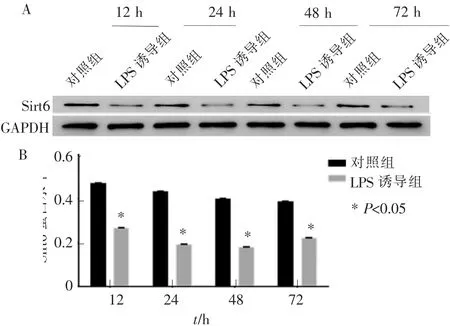
图5 Western blot 技术检测BMSCs 中Sirt6 的表达Figure 5 Expression of Sirt6 under different conditions by western blot
3 结论
牙周炎症的长期存在, 导致颌骨的广泛吸收、牙齿松动及脱落, 进而面容发生炎性衰老的趋势,影响咀嚼功能及全身营养吸收。 大量的研究表明,口腔炎症微环境和全身系统性疾病有着密切的关系[7-9]。 牙周炎微环境中, TNF-α、IL-1β 及IL-6 是主要的促炎因子,在炎症反应及骨病理、生理过程中起重要的作用,并且炎症因子可以通过多种复杂信号通路调控干细胞的生物学特性, 例如NF-κB、Wnt/Ca+、ATK/p38-MAPK 等信号通路。 炎症因子TNF-α 不仅可以抑制成骨细胞分化及矿化结节的形 成, 而且TNF-α 和IL-1β 在体外可以抑制BMSCs 的成脂分化能力。 本研究发现,同一时间点LPS 诱导组中TNF-α、IL-1β、IL-6 的含量均呈现高表达,LPS 诱导组中炎症因子抑制了BMSCs 的增殖能力。然而,也有学者认为在炎性条件下TNF-α 会刺激骨的形成,并推断TNF-α 具有不同的功能,可能与TNF-α 的干预时间或骨形成的不同阶段有关[10]。
Sirt6 是广泛存在于哺乳动物中烟酰胺腺嘌呤二核苷酸(NAD+)依赖的一种组蛋白,是沉默配型信息调节蛋白家族(Sirtuin) 的重要成员。 研究表明,Sirt6 是炎症反应及衰老相关疾病的关键调控蛋白,Sirt6 能够与核因子κB(nuclear factor kappa-B,NFκB)的RELA 亚型相互作用, 使NF-κB 靶基因启动子上组蛋白3 的赖氨酸9 (histone H3 lysine 9,H3K9) 位点去乙酰化, 以减弱NF-κB 的信号, 减少下游炎症靶基因转录, 从而减轻细胞衰老、 凋亡及相关炎症反应等生物学效应。
Zhang 等[11]的研究发现,热量限制6 个月后的衰老小鼠在敲除Sirt6 后, 会诱发NF-κB 过度激活和细胞衰老加速。结果表明,抑制Sirt6 的表达,可以促发炎症反应,加速衰老;而过表达Sirt6 则可以抑制NF-κB 转录活性, 抑制炎症反应, 延缓衰老。Lappas 等[12]利用LPS 处理脐带内皮细胞,发现Sirt6的表达显著降低, 细胞内释放大量炎性因子(TNFα、IL-1β、IL-6), 而过表达Sirt6 可以明显抑制炎症因子的表达。 本研究中,ELISA 实验表明,经10 μg/mL LPS 刺激后可以产生炎症微环境, 细胞内可以分泌大量TNF-α、IL-1β、IL-6, 随着时间的推移,TNF-α、IL-1β、IL-6 的表达量逐渐降低,表明BMSCs具有调控炎症因子的作用;而过表达Sirt6 后,炎症微环境中的TNF-α、IL-1β、IL-6 出现了显著性的降低,说明Sirt6 蛋白具有抑制炎症因子的作用。 免疫荧光实验结果也验证了这一结论。 而炎症状态下,过表达Sirt6 则可以提高炎症状态下BMSCs 的增殖速率,说明Sirt6 也具有抑制炎性因子,并促进BMSCs 增殖的作用。Lee 等[13]在研究人关节滑膜细胞时也发现,过表达Sirt6 能明显抑制IL-1β 和TNF-α 诱发的炎症反应。
综上所述,牙周炎症微环境中大量炎性因子致使颌骨发生骨吸收与骨重塑过程。 炎症等多种因素抑制了BMSCs 的分化和增殖能力, 成骨细胞生成数量急剧下降,破骨细胞活跃,骨破坏明显。 抗衰老蛋白Sirt6 通过与NF-κB 的亚单位RelA/p65 直接结合而起到抑制NF-κB 活性的作用,从而实现抑制炎症和抵抗衰老的双重功能。 然而,BMSCs 中Sirt6 蛋白在调控并促进干细胞增殖和抑制衰老等功能方面的作用,还有待于进一步探索和验证。

