糖尿病大鼠颌骨结构及颌骨骨髓间充质干细胞成骨分化的研究
陆玖青, 吕佳姝, 谢亚佳, 甄 蕾
(1. 复旦大学附属口腔医院,上海市口腔病防治院牙周科;2. 复旦大学附属口腔医院,上海市口腔病防治院口腔内科;3. 复旦大学附属口腔医院口腔生物医学工程实验室,上海 200001)
糖尿病(diabetes mellitus, DM)是一种以高血糖为特征的危害人体健康的全身性疾病,常伴有骨代谢异常,引起继发性骨量减少和骨质疏松等糖尿病性骨病。 研究显示,糖尿病患者发生牙周炎和进行性牙槽骨吸收的风险显著增高[1-2],进而导致牙齿松动脱落, 给牙槽骨缺损修复和种植修复带来困难。骨髓间充质干细胞(BMSCs)是一种具有多向分化潜能的干细胞,与长骨来源的BMSCs 相比,颌骨来源的BMSCs 具有取材方便、 成骨分化能力强等特点[3],逐渐成为口腔骨缺损修复的重要种子细胞。 但是糖尿病对颌骨BMSCs 生物学特性的影响及机制,目前还未完全阐明。 本研究旨在分析糖尿病对大鼠颌骨结构和颌骨来源BMSCs 成骨分化能力的影响,并初步探讨其可能的机制,为糖尿病患者牙槽骨缺损修复和种植修复提供一定的实验依据。
1 材料和方法
1.1 主要试剂和仪器
α-MEM 培养基(Gibco 公司,美国),胎牛血清(Gibco 公司,美国),青链霉素(Gibco 公司,美国),胰酶(Gibco 公司,美国);链脲佐菌素(Sigma 公司,美国),抗坏血酸(Sigma 公司,美国),β-甘油磷酸钠(Sigma 公司,美国),地塞米松(Sigma 公司,美国),茜素红S(Sigma 公司,美国),十六烷基吡啶(Sigma公司,美国);CCK-8 细胞增殖检测试剂盒(碧云天生物技术有限公司,中国),ALP 染色试剂盒(碧云天生物技术有限公司,中国),ALP 活性检测试剂盒(碧云天生物技术有限公司,中国),BCA 蛋白浓度测定试剂盒(碧云天生物技术有限公司,中国),细胞核蛋白、浆蛋白抽提试剂盒(碧云天生物技术有限公司,中国),ECL 显色液(碧云天生物技术有限公司,中国),羊抗兔二抗(碧云天生物技术有限公司,中国);TRIzol 试剂(Tiangen 公司,中国),cDNA 第一链合成试剂盒(Tiangen 公司,中国),荧光定量PCR 检测试剂盒(Tiangen 公司,中国);NF-κB p65 核蛋白(CST 公司,美国),HDAC1 单克隆抗体(CST 公司,美国)。
CO2培养箱,超微量核酸蛋白定量仪(Thermo 公司,美国);倒置荧光显微镜(Leica 公司,德国);全波长多功能酶标仪(Biotek 公司,美国);荧光定量PCR 仪(Roche 公司,美国)。
1.2 实验方法
1.2.1 分组与建模 SPF 级6 周龄SD 雄性大鼠12 只,体重(200±10) g,购自上海杰思捷实验动物有限公司,动物生产许可证号:SCXK(沪)2018-0004。所有大鼠常规适应性饲养1 周,随机分为正常对照组和糖尿病组,禁食、不禁水12 h,糖尿病组大鼠腹腔一次性注射新鲜配制的链脲佐菌素(65 mg/kg),对照组大鼠腹腔注射等量柠檬酸-柠檬酸钠缓冲液。分别于注射后3、7 d 时,所有大鼠禁食12 h 后尾静脉采血测量空腹血糖值,以2 次血糖值均>16.7 mmol/L 视为糖尿病建模成功。 建模成功后,2 组大鼠继续饲养8 周,每周监测血糖。
1.2.2 Micro-CT扫描 糖尿病建模成功8 周后,所有大鼠用戊巴比妥钠麻醉,颈椎脱臼处死。 分离上、下颌骨,上颌骨彻底剥离软组织后用4%多聚甲醛固定1 周,micro-CT 扫描,三维图像重建。 取上颌第一磨牙根分叉区域行骨小梁形态分析,测量分析骨体积分数(BV/TV)、骨小梁数目(Tb.N)、骨小梁间隙(Tb.Sp)等骨形态学参数。分别取第一磨牙和第二磨牙的颊、近颊、远颊、腭、近腭、远腭6 个位点,测量牙槽嵴顶至釉牙骨质界的距离,计算牙槽骨吸收。
1.2.3 颌骨BMSCs原代培养 将“1.2.2”中分离得到的正常对照组和糖尿病组大鼠下颌骨浸泡在75%乙醇溶液中,迅速转移至超净台;用消毒好的器械将下颌骨上的肌肉、 筋膜等结缔组织剔除干净,于含1%青链霉素的PBS 中冲洗2 遍; 用咬骨剪将下颌骨的上、下两端剪开,用5 mL 无菌注射器吸取α-MEM 溶液,反复冲洗至骨髓腔发白;冲洗液吸入离心管内,1 500 r/min 离心5 min。 弃上清液,用含10%胎牛血清及1%青链霉素的α-MEM 以1×106个/mL 的密度接种于10 cm 培养皿中, 置于37 ℃、5%CO2恒温培养箱中培养,48 h 后换液, 之后每3 d换液1 次,直至细胞达80%融合时传代培养。
1.2.4 CCK-8法检测细胞增殖 取正常对照组和糖尿病组细胞, 按2 000 个/孔的密度接种于96 孔板中,常规培养。 于培养的第1~7 天,每孔加入10 μL CCK-8 工作溶液,37 ℃下孵育2 h, 每组设5 个复孔,酶标仪于450 nm 处测定吸光度值,绘制增殖曲线。
1.2.5 ALP 染色和活性测定 取正常对照组和糖尿病组细胞,按以1×105个/mL 的密度接种于12 孔板中,常规培养48 h 后更换为含100 μg/mL 抗坏血酸、2 mmol/L β-甘油磷酸钠和10 nmol/L 地塞米松的成骨诱导液,继续培养7 d。 ALP 染色:弃去原培养液,PBS 清洗3 次,4%多聚甲醛固定10 min, 每孔加入500 μL BCIP/NBT 染色液,室温避光孵育15 min,PBS 清洗后拍照。 ALP 活性测定: 弃去原培养液,PBS 清洗3 次,每孔细胞加入500 μL 细胞裂解液充分裂解细胞,BCA 法测定蛋白浓度。 每孔吸取50 μL 加入96 孔板中,同时设置空白对照组和标准品组,每组设5 个复孔。 加入50 μL 显色液37 ℃孵育10 min,加入终止液终止反应,酶标仪405 nm处测定吸光度值, 并根据标准曲线计算ALP 表达量。
1.2.6 茜素红染色和定量检测 取正常对照组和糖尿病组细胞, 按2×105个/mL 的密度接种于6 孔板中, 常规培养48 h 后更换为成骨诱导液继续培养21 d。 茜素红染色: 弃去原培养液,PBS 清洗3 次,4%多聚甲醛固定10 min,1%茜素红染液染色5 min,PBS 清洗后拍照。 茜素红定量检测:拍照后的样本每孔中加入1 mL 2%十六烷基吡啶洗脱茜素红染料10 min,分别吸取200 μL 洗脱液置于96 孔板中,每组设5 个复孔,酶标仪570 nm 处测定吸光度值。
1.2.7 实时定量PCR检测成骨相关基因表达 取正常对照组和糖尿病组细胞, 按2×105个/mL 的密度接种于6 孔板中,常规培养48 h 后更换为成骨诱导液继续培养7 d。 培养结束后,PBS 清洗3 次,每孔加入1 mL TRIzol 试剂裂解细胞,提取总RNA,超微量核酸蛋白定量仪测定RNA 浓度。cDNA 第一链合成试剂盒反转录合成cDNA。 以GAPDH 为内参,进行荧光定量PCR 扩增,检测2 组细胞中成骨相关基因Runx2和OCN的mRNA 表达水平。 扩增引物由上海生工生物工程股份有限公司合成。
1.2.8 Western blot 检测NF-κB p65核蛋白表达 取正常对照组和糖尿病组细胞, 按2×105个/mL 的密度接种于6 孔板中,常规培养48 h 后,离心收集细胞,按细胞核蛋白、浆蛋白抽提试剂盒说明提取核蛋白,BCA 法测定细胞蛋白浓度。 各孔取10 μg 蛋白上样,5%~12%聚丙烯酰胺凝胶电泳进行蛋白分离,电转膜至预处理的PVDF 膜。 加入5%脱脂奶粉置室温封闭1 h。 TBST 洗膜3 次,每次10 min,分别加入一抗,4 ℃下孵育过夜。加入辣根过氧化物酶标记的二抗, 室温孵育1 h。 TBST 缓冲液洗膜3 次,ECL 发光法显影。 Image J 软件分析蛋白条带灰度值。 核蛋白以HDAC1 为内参,NF-κB p65 蛋白与内参比值代表目的蛋白表达水平。
1.3 统计学分析
数据使用SPSS 17.0 软件进行统计分析,2 组间比较采用独立样本t 检验,P<0.05 认为差异有统计学意义。
2 结果
2.1 血糖监测
所有大鼠建模前空腹血糖均在5 mmol/L 左右,随机抽取6 只建立糖尿病大鼠模型。 如图1 所示,1 周后血糖监测结果显示, 糖尿病组的6 只大鼠均建模成功, 空腹血糖持续稳定在25 mmol/L 以上,并维持8 周;正常对照组大鼠空腹血糖稳定在5 mmol/L 左右。
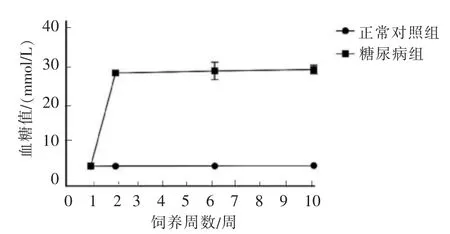
图1 大鼠血糖测定Figure 1 The concentration of blood glucose in rats
2.2 2 组大鼠牙槽骨吸收和颌骨骨形态参数比较
Micro-CT 结果显示,与正常对照组相比,糖尿病组大鼠牙槽骨吸收增加, 颌骨骨体积分数(BV/TV)降低,骨小梁数目(Tb.N)减少,骨小梁间隙(Tb.Sp)增加,差异均有统计学意义(P<0.05,图2)。
2.3 2 组大鼠细胞增殖能力比较
CCK-8 结果显示,2 组大鼠细胞在第1 天和第2 天时的增殖能力未见明显差异,但从第3 天开始,正常对照组细胞增殖能力显著高于糖尿病组,差异有统计学意义(P<0.05,图3)。
2.4 2 组细胞ALP 活性比较
2 组细胞成骨诱导7 d 后,ALP 染色结果显示,糖尿病组细胞紫色结晶明显少于正常对照组(图4A);ALP 活性检测结果显示, 糖尿病组ALP 活性较正常组下降,差异有统计学意义(P<0.05,图4B)。
2.5 2 组细胞基质矿化能力比较
2 组细胞分别成骨诱导培养21 d 后茜素红染色观察, 正常对照组成骨诱导后可见大量矿化结节,而糖尿病组细胞成骨诱导后仅见少量小面积的矿化结节(图5A)。 茜素红半定量分析结果显示,糖尿病组细胞体外矿化结节的形成能力较对照组显著降低,差异有统计学意义(P<0.05,图5B)。
2.6 成骨相关基因检测
2 组细胞成骨诱导培养7 d 后荧光定量PCR 结果显示, 与正常对照组比较, 糖尿病组细胞Runx2和OCNmRNA 的表达量显著下降, 差异有统计学意义(P<0.05,图6)。

图3 2 组细胞增殖能力比较Figure 3 Comparison of the proliferation activity

图4 2 组细胞ALP 活性Figure 4 Comparison of the ALP activity
2.7 NF-κB p65 核蛋白表达
NF-κB p65 蛋白活化入核是NF-κB 信号通路激活的标志, 因此本实验比较了2 组细胞NF-κB p65 核蛋白的表达。 Western blot 结果显示与正常组比较,糖尿病组细胞NF-κB p65 核蛋白表达量显著增加,差异有统计学意义(P<0.05,图7)。

图2 2 组大鼠上颌骨牙槽骨吸收和骨形态分析Figure 2 Micro-CT images showing maxillary alveolar bone resorption and the morphometric evaluations of rats

图5 2 组细胞钙结节染色及半定量分析Figure 5 Comparison of the alizarin red staining and semiquantitative assay

图6 2组细胞成骨基因表达Figure 6 Comparison of osteogenic gene expression
3 讨论
糖尿病是一种严重危害人类健康的全身代谢性疾病,可引起继发性骨量减少和骨质疏松等糖尿病性骨病。 糖尿病患者骨量减少和骨质疏松发病率为40%~70%, 并且骨质疏松性骨折的发病风险相对非糖尿病人群,增加了约2 倍[4-5],同时糖尿病患者发生进行性牙槽骨吸收和颌骨骨质疏松的风险亦显著提高[6-7]。 研究认为糖尿病可影响长骨结构,导致骨密度降低,骨小梁稀疏、数目减少,从而加大骨质疏松性骨折的发病风险。 但是糖尿病对颌骨微结构的影响,目前报道较少[8]。 本研究建立实验性糖尿病大鼠模型,利用micro-CT 研究糖尿病对牙槽骨吸收和颌骨结构的影响,结果表明,糖尿病可加速模型大鼠牙槽骨吸收, 使颌骨骨体积分数(BV/TV)降低,骨小梁数目(Tb.N)减少,骨小梁间隙(Tb.Sp)增加,从而导致颌骨的骨质疏松。

图7 2 组细胞NF-κB p65 核蛋白表达Figure 7 Comparison of the nuclear protein expression of NF-κB p65
BMSCs 是一种具有自我更新和多向分化潜能的干细胞,其成骨分化功能降低是骨质疏松症发病的重要机制。 与正常来源的BMSCs 相比,糖尿病来源的BMSCs 成骨分化能力显著减弱[9];高糖培养下BMSCs 脂肪生成标记物表达和衰老表型增加,成骨分化标记物表达降低[10]。 高糖微环境通过糖原合成酶激酶-3 抑制大鼠BMSCs 的增殖、 迁移和成骨分化[11]。颌骨来源的BMSCs 是口腔中具有代表性的间充质干细胞之一,具有与长骨来源BMSCs 相类似的生物学特性,能够向成骨细胞、脂肪细胞、内皮样细胞和神经元细胞等分化[3];颌骨BMSCs 具有来源丰富、取材方便、体外扩增能力强等特点,被认为是口腔再生医学领域重要的种子细胞。 有研究发现,体外高糖培养条件可降低正常颌骨BMSCs 的成骨分化[12]。 本实验成功分离培养糖尿病大鼠颌骨BMSCs,与正常大鼠BMSCs 相比,细胞增殖能力降低,ALP 活性和钙结节形成减少, 成骨相关基因Runx2和OCNmRNA 表达下降。上述结果表明糖尿病可影响颌骨BMSCs 的成骨分化能力。
研究发现NF-κΒ 信号通路与细胞成骨分化密切相关。体内转染特异性NF-κB 抑制基因可防止由于卵巢切除引起的成年小鼠骨量丧失[13],体外抑制NF-κB 活性可促进BMSCs 分化和矿化[14];同时NFκB 通路的激活与炎症状态下牙周膜干细胞成骨分化能力减弱有关[15-16]。 在非激活状态下,NF-κB p65:p50 二聚体和IκB 蛋白形成复合物位于细胞浆中,当外界刺激使NF-κB 信号通路激活后, IκB 蛋白被磷酸化而降解,释放NF-κB p65:p50 二聚体,经过转录后调控NF-κB p65 蛋白进入细胞核发挥功能。本实验发现糖尿病大鼠来源颌骨BMSCs 的NF-κB p65 核蛋白表达增加, 因此推测这可能与糖尿病状态下颌骨BMSCs 的成骨分化能力减弱相关, 但具体作用机制有待进一步研究。

