血清Lp-PLA2、Hcy及hs-CRP联合检测对急性冠状动脉综合征辅助诊断的临床价值
宋 倩,赵 冬,刘亚东,刘瀚泽
(1.延安大学附属医院检验科;2.延安大学附属医院心脑血管病区检验科;3.延安大学医学院,陕西 延安 716000)
缺血性心血管疾病是全球范围内发病率和死亡率最高的疾病,其主要病死原因是急性冠状动脉综合征[1](Acute oronary Syndrome,ACS)。脂蛋白相关磷脂酶A2(Lipoprotein association phospholipase A2,Lp-PLA2)和同型半胱氨酸(homocysteine,Hcy)是近年来热门的心血管病危险因子,与心血管疾病密切相关[2-4],超敏C反映蛋白(High-sensitivity C-reactive protein,hs-CRP)已被广泛研究,是心血管事件的独立标志物,有专家建议将hs-CRP水平纳入冠心病患者的初始评价体系中[5]。本研究通过检测ACS患者血清Lp-PLA2、Hcy、hs-CRP水平,探讨其对急性冠状动脉综合征(Acute coronary syndrome,ACS)的辅助诊断价值。
1 对象与方法
1.1 研究对象
收集2019年1月至12月延安大学附属医院心血管内科就诊的ACS患者140例,其中不稳定心绞痛(UnstableAngina,UA)患者60例(UA组),平均年龄(58±11.9岁),男性31例,女性29例;急性心肌梗死80例(AMI组),平均年龄(59±10.8)岁,男性43例,女性37例。所有ACS患者诊断均符中华医学会中ACS诊断标准[6],且所有纳入患者均为首次诊断ACS。排除标准:陈旧性心肌梗死,心肌炎、心源性休克及心脏瓣膜病等其他心脏病史。选取同期本院体检中心的表观健康人群100例为健康对照组(healthy controlsgroup,HC组),平均年龄(59±12.6)岁,男性45例,女性55例。所有入选对象均排除恶性肿瘤、严重肝肾功能不全、全身性感染、自身免疫性疾病及血液系统疾病等。
1.2 仪器与试剂
血清Lp-PLA2、Hcy均使用BECKMANCOULTERAU2700全自动生化分析仪测定。Lp-PLA2(连续检测法)使用上海德赛配套试剂盒、校准品及质控品。Hcy(循环酶法)使用宁波美康配套试剂盒、校准品及质控品。hs-CRP(散射比浊法)使用深圳国赛特种蛋白分析仪及配套试剂盒、校准品及质控品。所有操作均严格按照SOP文件规定进行。所测定项目室内质控及室间质评均在控。
1.3 方法
所有ACS患者均在确诊后,并在未治疗之前,使用促凝管采集空腹静脉血5ml,健康体检于当日清晨使用促凝管采集空腹静脉血5 ml,30 min内以3000 r/min离心10 min,测血清定Lp-PLA2、Hcy及hs-CRP水平,所有检测在2 h内完成。
1.4 统计学方法
所有数据采用SPSS 20.0和MedCalc 15.2.2软件进行统计分析。计数资料用百分比(%)表示,使用χ2检验,正态分布的计量资料用均数±标准差表示,多组间比较使用方差分析,两两之间比较使用LSD-t检验;非正态分布的计量资料采用中位数表示(四分位数间距)[M(P25,P75)],多组之间比较使用Welch近似方差分析,多重比较使用Dunnet′sT3检验。联合诊断使用Logistic回归分析。用MedCalcl 15.2.2软件受试者工作曲线(ROC)评价所观察指标的诊断性能,计算曲线下面积(AUC)。AUC的比较采用delong检验。P<0.05视差异有统计学意义。经过单样本Kolmogorov-Smirnov正态检验,除年龄呈正态分布外,Lp-PLA2、Hcy、hs-CRP均呈非正态分布,故年龄采用单因素方差分析,Lp-PLA2、Hcy、hs-CRP采用Welch近似方差分析。
2 结果
2.1 受试者各项实验室检测结果
HC组、UA组和AMI组血清Lp-PLA2、Hcy、hs-CRP水平差异有统计学意义(均P<0.05),多重比较显示AMI组Lp-PLA2和Hcy水平均高于UA组(t2=23.317、1.799,均P<0.05),hs-CRP水平无差异(t2=1.918,P=0.105);AMI组血清Lp-PLA2、Hcy和hs-CRP水平均高于HC组(t1=20.811、1.600、2.695,均P<0.05,见表1)。
2.2 单独检测与联合检测分别对急性心肌梗死的诊断价值
各指标单独检测时,选择各项指标实验室检测结果做分析(表2),评价其单独检测的诊断价值;联合检测时,组合各指标进行联合监测(表2),评价Lp-PLA2、Hcy和hs-CRP联合检测的诊断价值。诊断界值取约登指数(YoudenIndex,YI)最大处(YI=敏感度+特异度)所对应的实验室结果或预测值概率,此时各观察指标的诊断性能最大。
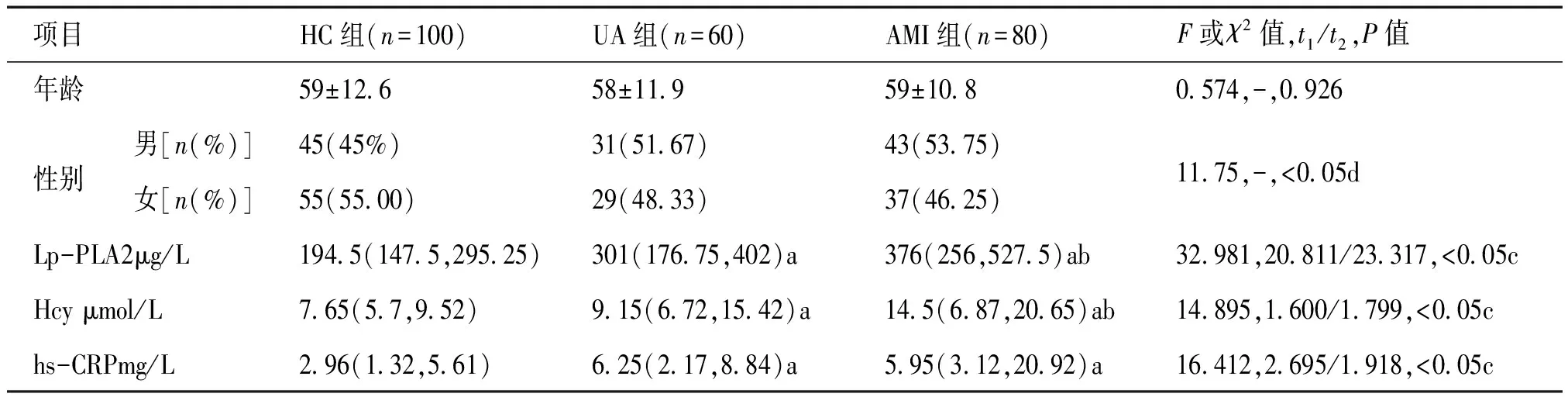
表1 各指标实验室检测结果
注:a表示与HC组相比P<0.05;b表示与UA组相比P<0.05;c为Welch近似方差分析;d为χ2检验;t1:AMI组与HC组比较的t值;t2:AMI组与UA组比较的t值。

表2 各指标对急性心肌梗死的诊断性能
单独检测时,按照AUC从小到大依次为:Lp-PLA2(0.781)、Hcy(0.728)、hs-CRP(0.581),即Lp-PLA2的诊断价值最高,hs-CRP最低。对AUC统计分析结果显示:Lp-PLA2与Hcy差异无统计学意义(z=0.934,P=0.35),但Lp-PLA2与Hcy均高于sh-CRP(z=3.769、2.44,均P<0.05)。
所观察指标两两联合检测时,其AUC从大到小依次为Lp-PLA2+Hcy(0.838)、Lp-PLA2+hs-CRP(0.785)、hs-CRP+Hcy(0.752),即两两联合检测时Lp-PLA2+Hcy的诊断价值最高。对AUC的统计分析结果显示:Lp-PLA2+hs-CRP与hs-CRP+Hcy之间无差异(z=0.632,P=0.527),Lp-PLA2+Hcy高于hs-CRP+Hcy和Lp-PLA2+hs-CRP(z=2.437、2.194,均P<0.05)。
所观察指标Lp-PLA2+Hcy+hs-CRP(AUC=0.838)三项联合检测与Lp-PLA2+Hcy(AUC=0.838)联合检测相比,其诊断性能差异无统计学意义(z=0.187,P=0.852)。与单独一项检测相比,Lp-PLA2+Hcy诊断性能高于Lp-PLA2、Hcy和hs-CRP(z=2.260、2.888、4.988,均P<0.05)。Lp-PLA2+Hcy两项联合检测时,以达到本研究所观察指标的最大诊断性能(AUC=0.838),且诊断特异度较高(Se=77.5%,Sp=81.7)。
3 讨论
Lp-PLA2是巨噬细胞等炎症细胞分泌的,释放入血后可与低密度脂蛋白(LDL)、高密度脂蛋白(HDL)及脂蛋白(a)[Lp(a)]相结合,个体Lp(a)低水平时,血液中20%的Lp-PLA2与HDL结合,80%的Lp-PLA与LDL结合[7],当个体Lp(a)水平过高时,Lp(a)中的Lp-PLA2水平是相同摩尔数LDL中Lp-PLA2水平的1.5~2倍[8]。Lp-PLA2是心血管病的独立风险因子,其水平升高可使斑块不稳定性增加或破裂[9],研究表明,Lp-PLA2与斑块的不稳定性相关,通过破坏具有保护作用的纤维帽导致纤维帽变薄、脂质核心增大形成易损斑块及使动脉粥样硬化(AS)斑块破裂[10],引起心血管事件突发。Lp(a)和LD中的磷脂在血管内膜上被氧化为氧化磷脂(OxPL),Lp-PLA2可进一步水解OxPL产生游离氧化脂肪酸(OxFFP)和溶血磷脂酰胆碱(lyso-PC),沉积到动脉壁上,促进AS进展[7]。OxFFP和lyso-PC还可激活蛋白水解酶加快AS斑块破裂,导致血管内皮损伤。此外,OxFFP和lyso-PC还可引起单核细胞趋化性改变,诱导炎症因子活化,使更多的巨噬细胞、白细胞及单核细胞进入斑块形成Lp-PLA2和炎症细胞的正反馈调节回路,加速AS的进展[11]。
Hcy是蛋氨酸代谢的中间产物,具有内皮细胞和多种神经元毒性[12]。Hcy可以减弱一氧化氮(NO)对血管内皮细胞的保护,增加血管壁厚度并损伤血管内皮细胞和平滑肌细胞,使细胞黏附分子-1(Cell adhesion molecule-1,CAM-1)、单核细胞趋化蛋白-1(Monocyte chemotactic protein-1,MCP-1)、白细胞介素-8(Interleukin-8,IL-8)等分泌增加,促使单核细胞及T细胞进入血管病变区域,产生炎症反应,Hcy还可使细胞内的活性氧簇(ROS)增加,Toll样受体(TLR4)和过核因子-κB(NF-κB)过表达,抑制环氧化酶(COX)活性及COX-17表达,使内皮细胞凋亡。另外,Hcy可破坏超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GP),增加Hcy诱导的氧化应激。此外,Hcy可激活Ⅴ、Ⅹ、Ⅻ等凝血因子,抑制前列腺素和肝素合成,使机体处于血栓前状态。最后,Hcy还可导致机体DNA去甲基化水平降低而致病[13]。
CRP是一种急性时相反应蛋白,血液中hs-CRP的半衰期为19 h,因此大多数情况下hs-CRP是比较稳定的,但是hs-CRP容易受血脂水平、吸烟、血压等指标影响[5]。血液中的hs-CRP水平和ACS患者心血管事件风险相关,目前,临床根据hs-CRP范围<1 mg/L、1-3 mg/L和>3 mg/L来评估心血管病的低、中、高风险[14],hs-CRP既是炎症标志物,同时也参与炎症反应。hs-CRP可与泡沫细胞、补体复合物等沉积到动脉管壁,通过免疫介导产生大量炎症介质,造成血管内皮细胞损伤。hs-CRP还可诱导单核细胞表达细胞因子,激活凝血及纤溶系统,使机体凝血系统失衡而增加心血管事件[15]。
本实验结果显示ACS组血清Lp-PLA2、Hcy、hs-CRP水平均高于健康对照组,且AMI组Lp-PLA2、Hcy水平高于UA组,表明Lp-PLA2、Hcy可以作为AMI早期诊断的标志物,根据ROC曲线分析,单一检测时Lp-PLA2的诊断性能最高(AUC=0.781),但是Hcy灵敏度最高(Se=71.3%)。
结合临床医生的诊疗习惯,本研究选择了单一检测和联合检测共7种方案对AMI的诊断性能进行评价,其中Lp-PLA2+Hcy+hs-CRP联合检测(AUC=0.838)和Lp-PLA2+Hcy联合检测(AUC=0.838)对AMI的诊断性能最高,且以上两种方案的AUC无统计学差异(z=0.187,P=0.852),虽然Lp-PLA2+Hcy+hs-CRP联合检测诊断AMI的灵敏度最大(Se=78.8%),但与Lp-PLA2+Hcy联合检测相比,不能显著提高对AMI的诊断性能。从影响因素、检测成本及诊断的特异性综合考虑,选择Lp-PLA2+Hcy联合监测对AMI的诊断较合理。

