PARP抑制剂HD199胶囊的研制
徐克耐,王国成,王征,李德馨,李宏玲
(1 天津大学药物科学与技术学院,天津300072;2 天士力控股集团有限公司天士力研究院,天津300400)
卵巢癌是女性生殖系统常见的恶性肿瘤之一,死亡率居妇科恶性肿瘤首位[1]。我国年新发卵巢癌5.2 万余例,死亡2.25 万例;发病率年增加6.3%,死亡率年增加21.6%,呈显著上升趋势[2]。肿瘤细胞减灭术联合化疗是卵巢癌患者初始治疗选择之一,但晚期患者即使经治疗获得完全缓解,仍有70%~80%出现复发,复发性卵巢癌患者的无进展生存期逐次缩短,且患者多次复发后对铂类药物的耐药性增加,治疗的难度和治疗方案的选择越来越困难,严重影响患者的生存和生活质量。近年来,大量的研究致力于开发新的、有潜力的卵巢癌靶向治疗药物,以期达到目标[3]。
聚二磷酸腺苷核糖多聚酶(poly ADP-ribose polymerase,PARP)抑制剂是一类新型的卵巢上皮癌靶向治疗药物,大量研究证明,PARP 抑制剂对复发性卵巢癌患者具有较好的疗效和安全性,可显著延长其无进展生存期(progression-free survival,PFS)。PARP抑制剂的使用使卵巢癌治疗从原来的化疗期间等待,复发后再化疗,转变为两次化疗之间加入维持治疗的新模式,有效延长PFS达3年以上,并降低复发风险。PARP 抑制剂在全球的获批及各国治疗指南[4]的推荐下,已经成为复发性卵巢癌患者的有效治疗选择之一。
HD199 是化学合成的全新结构的PARP 抑制剂,水溶性好,口服生物利用度高,在肿瘤动物模型上显示了很好的抑瘤效果。同靶点药物已有四个获得FDA 批准上市,用于卵巢癌术后的维持治疗和晚期三阴性乳腺癌的治疗。已上市的PARP抑制剂均为口服固体制剂,分子量在500左右,化学结构中含内酰胺的双环或类似双环的结构,酰胺键旁边有疏水性小取代基,或者含有双环中的疏水性大基团[5],因此往往溶解性不高,生物利用度不理想,需要通过制剂手段加以弥补。资料[6-9]显示,奥拉帕利(Olaparib)为难溶性药物,处方中通过加入增溶剂和乳化剂达到促进吸收、改善口服生物利用度的目的;瑞卡帕利(Rucaparib)、尼拉帕利(Niraparib)和他拉唑帕利(Talazoparib)为提高溶解度,分别采用右旋樟脑磺酸盐和甲苯磺酸盐,他拉唑帕利还需通过控制原料粒径达到所要求的释放度。
HD199 的临床研究拟采用便于剂量调整的硬胶囊剂。与同类药物相比,HD199 具有良好的溶解性;但美中不足,处方前研究表明,HD199 原料药略有引湿性,外观呈絮状、质轻(松密度0.295 g/cm3)易结块,流动性差(休止角为55.5°、压缩度为44.4%);同时,高温会导致HD199 一定程度的化学降解。本文在了解和分析HD199 理化性质的基础上,从选择合适的辅料入手,采用适宜的制备工艺,目标是解决HD199流动性差的问题,同时避免主成分的降解,研制出符合质量要求的HD199 胶囊。在临床研究确定了合适的给药剂量后,本文将从改善制剂属性着手,研究更合适HD199 的新型口服制剂。例如将药物包封到微胶囊,能避开水分、空气及光线的影响,又能增加药物的稳定性、提高药物利用率和安全性[10-11];再者亲水小分子药物的缓释微球可以延长药物的作用时间,改善药物的体内药动学特征,具有制备操作简单,智能靶向等特点[12-13]。
1 实验材料和方法
1.1 试剂与仪器
HD199原料药,纯度99.2%(批号20160107),自制(天士力控股集团有限公司);乳糖,药用辅料级,德国美剂乐集团;二氧化硅,药用辅料级,安徽山河药用辅料股份有限公司;硬脂酸镁,药用辅料级,浙江中维药业有限公司;2号不透明白色明胶空心胶囊,药用辅料级,苏州胶囊有限公司。
BT-1000粉体综合特性测试仪,丹东市百特仪器有限公司;MS2000 马尔文激光粒度测定仪,美国麦奇克有限公司;Cary 60紫外可见分光光度仪,安捷伦科技有限公司;RC806D溶出仪,天津市天大天发科技有限公司;JJ-1000 型电子天平:常熟市双杰测试仪器厂;高效液相色谱仪1260,安捷伦科技有限公司。
1.2 方法
1.2.1 粉体学性质测定
休止角、松密度和振实密度:采用BT-1000粉体综合特性测试仪,按说明书操作,每个样品平行测定3次,取平均值。
粒径及粒径分布:采用MS2000 马尔文激光粒度测定仪(干法进样检测)。
引湿性:按照《中国药典》2015 年版第四部通则,(9103)药物引湿性实验指导原则,与恒温干燥器温度25℃±1℃,相对湿度80%±2%(硫酸铵饱和溶液)下,将装有厚度约1mm 的供试品的称量瓶敞口放置,分别于2h、4h、6h、8h、10h、12h、24h取出,精确称量,计算吸湿增重百分比。
1.2.2 HD199胶囊的制备
首先将处方量的HD199与二氧化硅(SiO2)按照等量递加法初步混合,混合粉过60 目筛,再过100目筛;再加入处方量的稀释剂,置于自封袋内混合20min,再加入处方量的硬脂酸镁混合10min,即得中间体混粉。根据混粉中主药HD199 的含量计算理论囊重;按照理论囊重用胶囊板进行胶囊的手工灌装,即得HD199胶囊。
1.2.3 HD199胶囊含量检测方法
色谱柱为Zorbax SB-C18(250×4.6nm,5μm);检测波长299nm;柱温40℃;流速1.0mL/min;进样量20μL;流动相中A 为0.01mol/L 磷酸氢二铵缓冲液(pH5.5),B为甲醇,A、B体积比为80∶20。
1.2.4 HD199胶囊有关物质检测的HPLC条件
色谱柱为Zorbax SB-C18(250×4.6nm,5μm);检测波长299nm;柱温40℃;流速1.0mL/min;进样量20μL;流动相中A 为0.01mol/L 磷酸氢二铵缓冲液(pH 5.5),B为甲醇。按照峰面积归一化法计算样品中各杂质的百分含量和杂质总量。

表1 有关物质色谱梯度洗脱方法
1.2.5 HD199胶囊溶出曲线的测定
照溶出度测定法(2015 年版《中国药典》四部通则0931第一法),转速为75r/min,溶出介质为pH6.8 磷酸盐缓冲液,分别于5min、10min、15min、30min 和45min 取样,取溶出液8mL,经0.45μm 纤维滤膜滤过,同时补加等量同温溶剂。取续滤液5mL 置10mL 量瓶中,并用溶出介质稀释至刻度,摇匀,作为供试品溶液;另取HD199 对照品适量,加溶出介质溶解制成每1mL 中含HD199 约25μg 的溶液,作为对照品溶液。分别取供试品溶液及对照品溶液,照紫外-可见分光光度法(中国药典2015 年版四部通则0401),在299nm处测定吸光度,计算溶出度并绘制累积溶出曲线。
2 实验结果与讨论
2.1 助流剂的筛选
HD199 流动性差,为了获得填充所需要的流动性,首先考虑加入助流剂改善物料粉体学性质。微粉硅胶又称胶体SiO2因为粒径小,是常用助流剂当中效果最好的,同时还能够改善吸湿和粘连[14]。作为助流剂微粉硅胶用量一般为处方总量的0.1%~5%,首先研究了微粉硅胶用量对HD199 粉体学性质的影响,结果见表2。用量在API质量的0~7.5%的范围内,随着用量的增加,HD199 的粉体性质有明显的改善:休止角由55.5°降低到45.6°,压缩度由44.4%下降到30.7%,表明物料的流动性明显增加;当继续增加SiO2用量到API 质量的10%,并不能进一步增加API的流动性。这与文献[15]的报道相一致,即达到最好的流动性标准的助流剂通常会有一个最佳的浓度值。因此,对于HD199,助流剂微粉硅胶的最佳用量为API的7.5%。
2.2 稀释剂的筛选
固体口服制剂中常用的稀释剂(填充剂)主要有微晶纤维素、一水乳糖、预胶化淀粉等。三种稀释剂各具特点,都具有良好的流动性和可压性。分别选择三种稀释剂中流动性较好的型号(表3)进行研究。
2.2.1 稀释剂粒径的考察

表2 SiO2助流剂比例对HD199粉体学性质的影响
硬胶囊填充工艺研究时,除了满足物料流动性的要求,保证原辅料混合的均一性,避免在胶囊填充过程中混合物料发生分层现象至关重要,这决定了胶囊的重量和药物含量的均一性。颗粒的流动性大体上与粒径呈正相关,如果组成粉体混合物的颗粒间有较大的粒径差异,在混合过程中就会表现出不同的运动特征,进而导致混合不均匀,甚至分层[16]。因此,按照1.2.1 节方法分别测定HD199、微晶纤维素、一水乳糖、预胶化淀粉的粒径及粒径分布,结果列于表3中。对比各稀释剂与HD199原料药的粒径分布特征,其中乳糖粒径及粒径分布与HD199更为接近,可作为处方的首选。
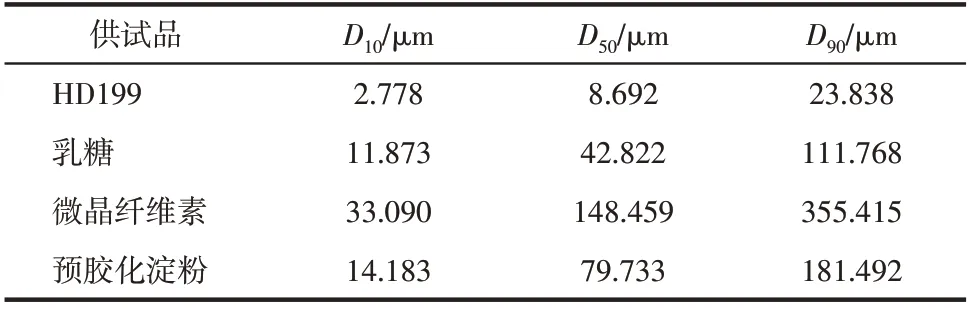
表3 三种稀释剂粒径分布特征值测定结果
2.2.2 稀释剂对处方流动性的影响
固体口服制剂中稀释剂的用量一般占到25%~85%,考虑到HD199临床拟用剂量和胶囊壳填充量的限制,初步确定稀释剂用量为HD199 的1.5 倍,微粉硅胶用量为HD199 的7.5%,润滑剂硬脂酸镁为处方总量的1%。按照1.2.2 节的方法分别以乳糖、微晶纤维素和预胶化淀粉为稀释剂制备三批HD199胶囊,分别称为处方1(乳糖)、处方2(微晶纤维素)、处方3(预胶化淀粉)。取各处方的混粉,分别测定休止角、松密度、振实密度、压缩度、引湿性等粉体学性质,进行比较分析,结果见表4和图1;并进一步对比川北方程指导处方筛选,结果见表5。
研究结果显示三个处方混合粉的休止角和压缩度相对原料药粉末均有很大改善,但处方1的休止角和压缩度均最小,流动性最好,明显优于处方2和处方3。川北方程的计算结果也给出了同样的结果,即处方1的a值和1/b值最小,表明处方1的流动性和充填性最佳。在引湿性上(图1),三个处方均在可接受的范围。

表4 各处方的粉体学性质(n=3)

表5 各处方样品的川北方程

图1 三种稀释剂及各处方吸湿增重比变化趋势
2.2.3 稀释剂对胶囊释放行为的影响
稀释剂的选择要求兼顾填充过程顺利和药物溶出,在某些情况下,满足了填充条件就会阻碍药物的释放,因此需要综合考虑。分别取2.2.2 节制备的三批胶囊,按照1.2.5 节的方法绘制三种胶囊的溶出曲线,如图2所示。处方3的5 min 溶出偏低,分析可能与预胶化淀粉遇水产生一定的黏性有关,10 min 溶出度比较3 个处方没有显著差异,15 min都能够达到药物全溶出,因此从溶出度方面考虑,3个处方没有显著区别。

图2 三种处方的溶出曲线
对于水溶性药物,当处方中含有的乳糖达到50%时溶解度几乎没有变化;当乳糖的含量增加到80%时,药物从胶囊中的溶出速率明显迟缓,这可能是由于溶解竞争机制造成的[17]。因此,选择乳糖用量为HD199 的1.5 倍(约处方总量的60%)也较为合适。综合以上实验结果确定HD199 胶囊的处方组成为HD199/微粉硅胶/乳糖/硬脂酸镁(质量比为1∶0.075∶1.5∶0.025)。
2.3 原辅料相容性考察
将乳糖、二氧化硅、硬脂酸镁和胶囊壳(剪成碎片使用)分别与主药按一定比例混合均匀后,分别置于强光照射(总照度不低于1.2×106Lux·h)、高温(60℃)、高湿(92.5%RH,25℃)条件下放置,于第0天、5天、10天、30天取样,按照1.2.3节方法测定HD199 的含量,并计算相对于0 天HD199含量的相对含量,结果见表6;按照1.2.4节方法测定有关物质的总量,结果见表7。
2.4 工艺重现性
按照处方1 和1.2.2 节描述制备3 批HD199 胶囊,批号分别为201610181,201610182,201610183。制备的三批胶囊以1.2.5 节方法绘制溶出曲线,如图3所示,三批胶囊的溶出曲线一致,表明工艺重现性良好。
3 结论
PARP 抑制剂HD199 是全新结构的化药1 类肿瘤靶向药物。本研究在不改变晶型的前提下,通过筛选合适的助流剂、稀释剂解决了原料药流动性差的问题;采用粉末直接填充胶囊工艺,避免制粒过程中药物暴露在高温下而导致的主成分的降解。采用常规辅料制备的临床研究用HD199 胶囊剂,剂量便于灵活调整;处方合理,药物溶出快速、完全、批间一致性好;制备工艺简单易行,适于工业放大生产。

图3 3批HD199胶囊的溶出曲线
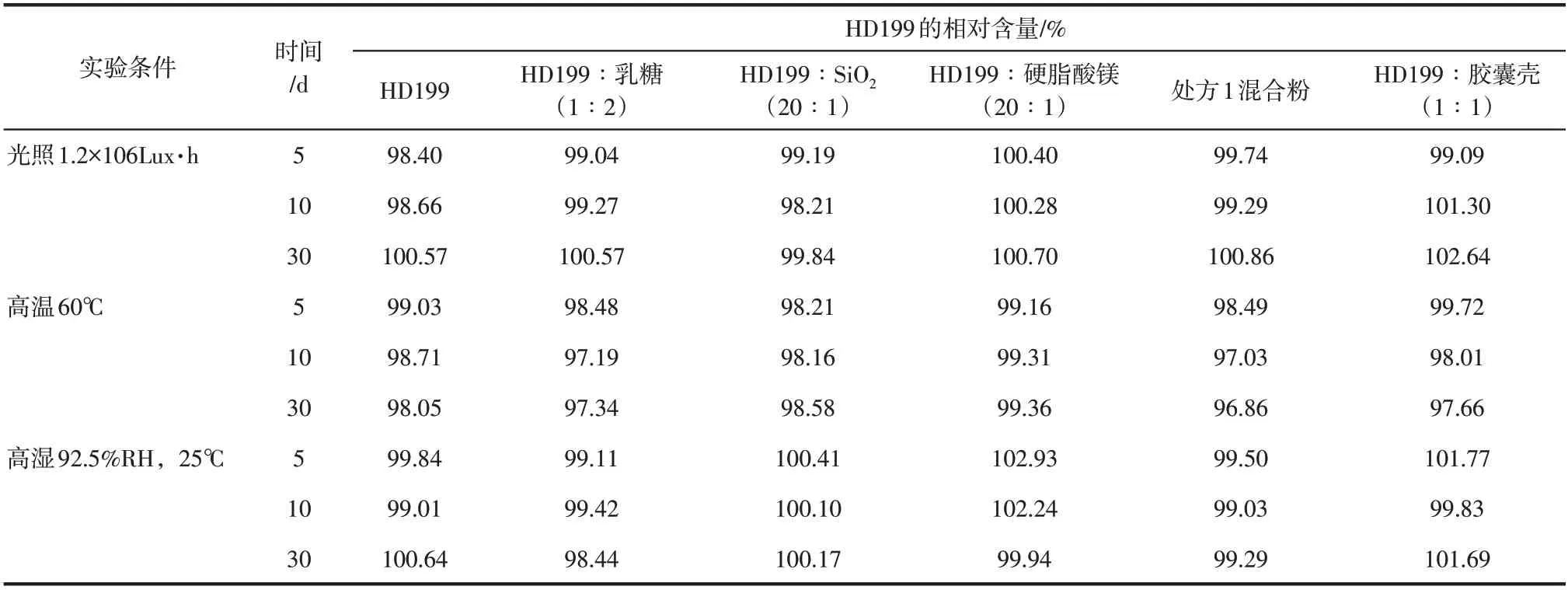
表6 HD199与辅料的相容性(HD199的相对含量)

表7 HD199与辅料的相容性(总杂质含量)

