脓毒症患儿脂代谢指标及高敏肌钙蛋白T水平的变化和临床意义研究
张群群,金志鹏,王琪,苏军
(郑州大学附属儿童医院,河南省儿童医院,郑州儿童医院内科监护室,河南 郑州 450000)
临床上脓毒症的发生率具有一定的上升趋势,流行病学研究认为,脓毒症的发病率可达272~382/1 万人左右[1]。儿童由于处于生长发育阶段,机体免疫功能相对较差,容易发生感染性疾病并进展为脓毒症,临床上脓毒症的发生能够导致患儿多器官功能衰竭的发生,并导致患者远期致残率和病死率的上升[2]。
在揭示脓毒症的发病机制的过程中发现,不同的生物学因子的波动,能够导致组织器官损伤、加剧缺氧性氧化应激障碍等,进而促进脓毒症的病情进展[3]。高密度脂蛋白(HDL-C)能够稳定血脂代谢,减轻高血脂代谢导致的氧化应激性损伤,并稳定血管内皮细胞功能,从而抑制脓毒症的病情进展[4];低密度脂蛋白(LDL-C)、甘油三酯(TG)及胆固醇(TC)的上升,能够加剧高血脂症表现,导致体内的氧化应激性损伤并提高微血栓形成风险[5];高敏肌钙蛋白T(hs-TnT)能够在心肌细胞早期损伤的过程中显著上升,其对于心血管系统病变风险的评估具有重要意义。部分研究者报道了血脂代谢紊乱与脓毒症的病情关系,认为其可以显著促进脓毒症的病情进展[6],但缺乏对于血脂相关指标与患者体内炎症因子等的关系研究。为了揭示脓毒症患儿脂代谢相关指标及高敏肌钙蛋白T 水平的变化和临床意义,本次研究收集了相关病例探讨了血脂代谢指标和hs-TnT 的波动情况,报告如下。
1 资料与方法
1.1 患者一般资料 选取2016 年10 月-2018 年 2月在我院接受治疗的脓毒症患儿为研究对象。⑴年龄≤12 周岁;⑵符合脓毒症的诊断标准;⑶无其他严重基础疾病者;排除标准:⑴不愿参与本项研究;⑵近期有其他感染性疾病;⑶合并免疫功能障碍者。根据纳入排除标准共纳入病例数40 例,男25 例,女 15 例,年龄 4~12 岁,平均(7.05±1.03)岁;健康对照组纳入排除标准:⑴年龄≤12 周岁;⑵平素体健,近期无感染性疾病,共纳入40 例,男27例,女 13 例,年龄 3~12 岁,平均(6.98±1.01)岁。两组患儿的一般资料比较无差别,具有可比性。本项研究经医院伦理委员会评审通过,且所有患儿家属均知情同意。
1.2 检测方法 采集入院后静脉血,离心后收集上清液,采用免疫发光法检测hsTnT、IgG、IgA 和IgM水平, 检测仪器为美国Bio-Bad 全自动酶标仪,配套试剂盒购自罗氏检测公司;采用全自动生化法检测 HDL-C、LDL-C、TC、TG、IL-10、IL-6 和 IL-12值,配套试剂盒购自南京碧云天生物检测公司。
1.3 评价指标 观察两组研究对象HDL 等脂代谢水平、高敏肌钙蛋白T、免疫指标和炎症因子水平的差异,并分析HDL 等脂代谢水平、高敏肌钙蛋白T 与免疫指标、炎症因子水平的相关性。
1.4 统计学处理 数据录入后,采用SPSS 11.5 软件进行分析。计数和计量资料分别采用例和均数±标准差表示。两组HDL 等脂代谢水平、高敏肌钙蛋白T、免疫指标和炎症因子水平的比较采用t 检验进行分析,采用Pearson 相关分析法分析HDL 等脂代谢水平、高敏肌钙蛋白T 与免疫指标、炎症因子水平的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 两组研究对象HDL 等脂代谢水平、高敏肌钙蛋白T 水平的比较 观察组患儿的HDL 水平明显低于对照组,LDL-C、TC、TG 和 hsTnT 水平明显高于对照组 (t=-9.974、-4.968、-6.554、-29.013,P<0.001)。见表1。
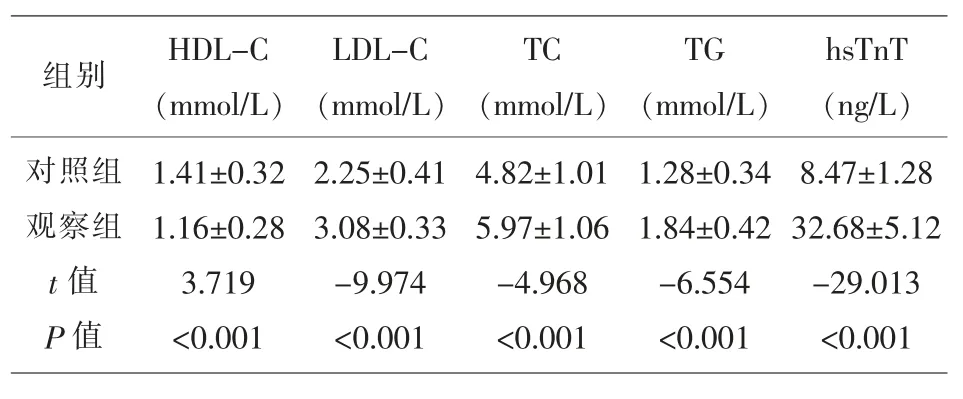
表1 两组研究对象HDL 等脂代谢水平、高敏肌钙蛋白T 水平的比较
2.2 两组研究对象免疫指标的比较 观察组患儿的 IgG、IgA 和 IgM 水平均低于对照组 (t=9.269、12.158、5.852,P<0.001),见表2。
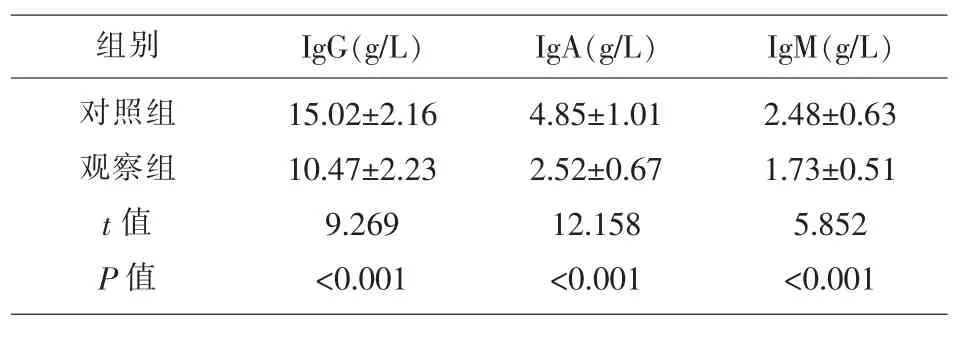
表2 两组研究对象免疫指标的比较
2.3 两组研究对象炎症因子水平的比较 观察组患儿的IL-10、IL-6 和IL-12 水平均高于对照组(t=-21.719、-27.575、-24.533,P<0.001),见表3。
2.4 脓毒症患儿脂代谢水平、高敏肌钙蛋白T 与免疫指标、炎症因子的相关性 脓毒症患儿HDL-C水平与 IgG、IgA 和 IgM 水平正相关,与 IL-10、IL-6 和 IL-12 水平负相关,LDL-C、TC、TG 和 hsTnT水平与 IgG、IgA 和 IgM 水平负相关,与 IL-10、IL-6 和 IL-12 水平正相关,见表4。
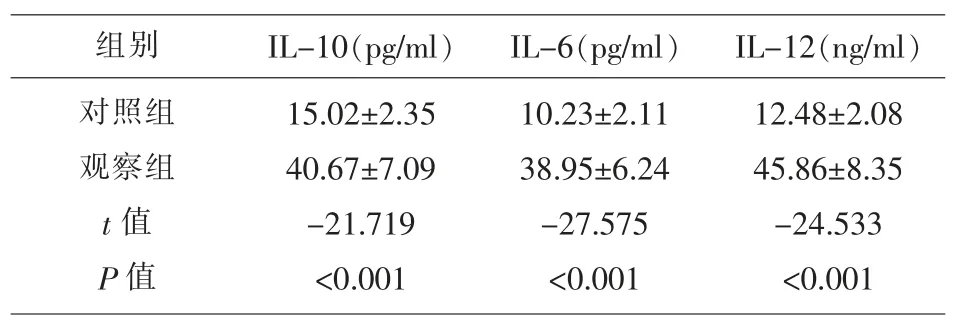
表3 两组研究对象炎症因子水平的比较

表4 脓毒症患儿脂代谢水平、高敏肌钙蛋白T 与免疫指标、炎症因子的相关性
3 讨论
作为临床上较为常见的感染性疾病,脓毒血症的发生可以导致血管内皮氧化应激障碍、肺通气或者肺换气功能障碍及心脏泵血功能的异常,促进患者致残率或者病死率的上升[7,8]。在一项聚集113例样本量的多中心随访研究中,可以发现脓毒血症并发心力衰竭及多器官功能障碍的几率可分别达27%、19%[9]。临床上通过影像学检查评估脓毒症的病情或者发生风险,但影像学检查评估脓毒症的灵敏度较低,漏诊率较高,对于疾病的动态监测能力不足。另外虽然有部分血清学指标如C 反应蛋白等,能够在指导早期脓毒症的诊断及临床预后过程中发挥一定的参考价值,但C 反应蛋白等常规指标的诊断灵敏度或者特异度较低[10,11]。本次研究对于血脂代谢指标或者hsTnT 的分析研究,能够为后续血清学诊断学方面的研究提供前期理论基础。
LDL-C、TG 或者TC 的高表达,能够导致血脂代谢的紊乱,促进脓毒症患者的肝肾组织或者肺部组织的浸润、上皮细胞的损伤和血流动力学的紊乱。LDL-C、TG 或者TC 的表达上升不仅能够导致血管内皮细胞的损伤,加剧血流动力学紊乱,同时还能够诱导体内的级联式炎症反应的发生[12];HDL-C 的表达上升,能够稳定血脂代谢环境,降低血管内皮细胞的凋亡程度,并能够降低血管内微血栓的形成风险[13];hsTnT 是重要的肌酐蛋白家族成员,其作为灵敏度较高的肌钙蛋白,在心肌细胞膜损伤的早期即可出现显著的改变[14]。部分研究者认为HDL-C 的表达下降或者LDL-C 等的上升,是促进脓毒症患者感染性病情加重的重要诱因,但缺乏对于相关指标与脓毒症患者体内炎症性指标或者免疫功能指标的关系研究。
本次研究血清学指标可见,脓毒症患者中LDL-C、TC、TG 和 hsTnT 的表达浓度明显高于正常对照人群,而HDL-C 的表达浓度明显的下降,提示了血脂代谢紊乱或者心肌酶谱指标在脓毒症患者的病情发生发作过程中可能发挥了一定的作用,通过汇集国内外文献,笔者认为血脂代谢指标或者hsTnT 的表达波动与脓毒症的关系可能与下列机制有关[15]:⑴HDL-C 的表达下降,导致重要内脏血管内皮的凋亡程度的增加,血管的损伤或者持续性痉挛表现更为明显,缺血性的组织器官的损害更为显著;⑵LDL-C、TG 等指标的上升,能够导致微血栓的形成,增加了氧化应激性损伤程度;⑶在脓毒症的病情进展过程中,早期即可合并有明显的心肌细胞膜的损伤,此时hsTnT 的浓度即可明显的上升,敏感性较高。苗强等[16]研究者也认为,在脓毒症患者中,hsTnT 的表达浓度可平均上升40%以上,同时在发病的6~8h 内,hsTnT 的浓度即可显著的上升。但部分研究者并不认为TG 或者TC 等非特异性的血脂代谢指标与脓毒症的发生具有关联,不同的研究结论间的差别,考虑可能与血脂代谢指标的检查灵敏程度或者检测时机等因素的差别有关。IgG、IgA 和IgM 是评估患者体液免疫功能的重要指标,IgG、IgA 和IgM 的下降能够导致感染性病情扩散风险的上升,脓毒症患者中IgG、IgA 和IgM 的浓度明显的下降,提示其体内的体液免疫功能的抑制,这主要由于脓毒症患者病原体扩增过程中对于浆细胞的成熟能力的抑制作用有关。IL-10、IL-6 和IL-12 是评估患者体内炎症反应程度的重要指标, 脓毒症患者中IL-10、IL-6 和IL-12 的浓度明显的上升,提示了其体内炎症反应激活的表现较为明显,这主要由于脓毒症患者体内病原体释放的致病颗粒的诱导激活效应有关。相关关系分析可见, 脓毒血症患者体内的血脂代谢水平或者hs TnT 水平与患者体液免疫功能指标或者炎症因子指标均密切相关,提示了血脂水平可能影响到了机体免疫反应或者炎症反应等病理过程。
本次研究的创新性在于探讨了血脂水平和hsTnT 水平与脓毒症患者体液免疫功能的关系。综上所述,脓毒症患儿HDL 和hsTnT 水平均较高,且与炎症因子 IL-10、IL-6、IL-12 和免疫功能指标IgG、IgA、IgM 具有一定的相关性。

