APE1-AAbs水平与直肠癌患者病理学特征的关系及其诊断价值
王长起,王运启,王欣科,李凯
(南阳油田总医院普外科,河南 南阳 473132)
直肠癌是临床上较为常见的消化系统恶性肿瘤,其长期占据消化道肿瘤病死率的前三位[1]。临床上在具有高蛋白饮食的人群中,直肠癌的发病风险可明显上升,其远期生存预后的恶化更为明显[2]。通过对于直肠癌发病过程中相关生物学机制的研究,能够为直肠癌的诊断及临床预后的评估提供参考。肿瘤基因代谢调控因子的改变,能够在直肠癌的病情进展过程中发挥作用。脱嘌呤脱嘧啶核酸内切酶(apurinic/apyrimidinicendonuelease1,APE1-AAbs)作为核酸代谢修饰因子,其能够通过影响到癌基因的激活,增加肿瘤基因的突变风险,最终促进癌细胞诱导的肿瘤细胞异常增殖转录过程。APE1-AAbs 对于直肠腺体上皮细胞遗传物质的调控,能够增加癌细胞内信号通路的激活程度,最终促进恶性肿瘤的发生[3,4]。为了揭示APE1-AAbs 的表达与直肠癌患者的病情关系,从而为直肠癌的诊断及治疗提供参考, 本次研究选取2015 年2 月-2018 年1 月我院确诊的直肠癌患者80 例,探讨了APE1-AAbs 的表达及其与直肠癌患者的病情关系。
1 对象与方法
1.1 对象 选取 2015 年 2 月-2018 年 1 月我院确诊的直肠癌患者80 例为直肠癌组、40 例健康体检对象为对照组。直肠癌组,男 48 例、女 32 例;年龄37~77 岁, 平均 54.4±10.0 岁;TNM 分期:Ⅰ期 20例、Ⅱ期 32 例、Ⅲ期 22 例、Ⅳ期 6 例;病理学分化程度:高分化20 例、中分化35 例、低分化 25 例;病灶直径>5.0cm 38 例;发生淋巴结转移35 例。对照组,男 20 例、女 20 例;年龄 40~79 岁,平均55.0±8.6 岁。两组研究对象的年龄、性别比较,差异均无统计学意义(P>0.05)。
1.2 相关标准 诊断标准:直肠癌的诊断标准参考中华医学会制定的标准[5]。纳入标准:⑴患者年龄范围19~79 岁;⑵直肠癌患者均经过肠镜取活组织病理学检查证实;⑶接受本研究相关检查前,患者无放化疗病史;⑷对照组为健康体检正常人员;⑸本研究符合《赫尔辛基宣言》相关医学伦理学标准。排除标准:⑴伴有其他部位的恶性肿瘤;⑵未经病理学检查证实;⑶伴有免疫功能疾病、类风湿性疾病。
1.3 APE1-AAbs 检测方法 采用外周静脉血3~5ml,室温下放置5~10min,自然分层后抽取上层清亮液体待测。采用贝克曼库尔特UniCel DxI 800 化学发光免疫分析仪进行APE1-AAbs 的检测,EasyBlot ECL 化学发光显色试剂盒购自赛默飞公司。
1.4 统计分析 本研究中所有数据的分析均采用SPSS21.0 版本,APE1-AAbs 检测结果等计量指标采用±s 表示,组间比较采用t 检验;性别组间比较采用χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 两组APE1-AAbs 检测结果比较 直肠癌组患者的血清APE1-AAbs 水平显著高于对照组,差异具有统计学意义(P<0.05),见表1。
表1 两组APE1-AAbs 检测结果比较()

表1 两组APE1-AAbs 检测结果比较()
组别 n直肠癌组对照组P 值80 40 APE1-Aabs(μg/ml) t 值3.53±1.35 1.95±0.77 6.8560.000
2.2 血清APE1-AAbs 诊断直肠癌的价值 血清APE1-AAbs 水平鉴别诊断直肠癌的灵敏度为84.26%、特异度为71.54%、漏诊率为15.74%、误诊率为28.46%、ROC 曲线下面积AUC 值0.771,见图1。
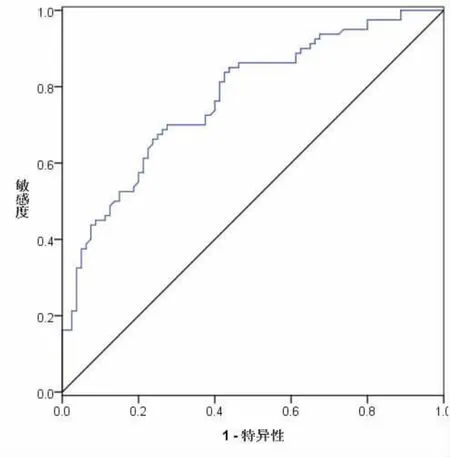
图1 血清APE1-AAbs 诊断直肠癌的ROC 曲线
2.2 不同临床病理学特征的直肠癌患者血清APE1-AAbs 检测结果比较 TNM 分期(Ⅲ期+Ⅳ期)、低分化、发生淋巴结转移的直肠癌组患者的血清APE1-AAbs 水平显著高于TNM 分期(Ⅰ期+Ⅱ期)、高中分化、未发生淋巴结转移的患者,差异具有统计学意义(P<0.05);不同年龄、性别、病灶直径的直肠癌患者血清APE1-AAbs 水平差异均无统计学意义(P>0.05),见表2。
3 讨论
临床上直肠癌的发病具有一定的年轻化趋势,在长期饮食不规律、高热量、高蛋白、低纤维素饮食的群体中,直肠腺体上皮细胞损伤修复过程异常,能够显著促进直肠癌发生[6]。临床观察发现,直肠癌患者的5 年生存率较低,其远期总体生存时间不超过32 个月[7,8]。通过对于直肠癌的早期诊断,能够在直肠癌的早期手术治疗或者新型辅助化疗方面发挥作用, 从而改善直肠癌患者的整体临床预后。现阶段主要采用糖链蛋白199 或者癌胚抗原等指标辅助诊断直肠癌,虽然糖链蛋白199 等指标能够在直肠癌的早期诊断过程中发挥作用[9]。但依靠糖链蛋白199 等指标诊断直肠癌的灵敏度或者特异度仍然较低,其对于直肠癌患者临床病理特征评估的一致性率不足40%[10,11]。基因调控障碍,能够在癌细胞的早期发生过程中发挥作用,本次研究通过对直肠癌患者体内基因调控因子APE1-AAbs 的分析, 能够在揭示直肠癌病情进展原理的同时,为临床上直肠癌的治疗提供参考。
表2 不同临床病理学特征的直肠癌患者血清APE1-AAbs 检测结果比较()
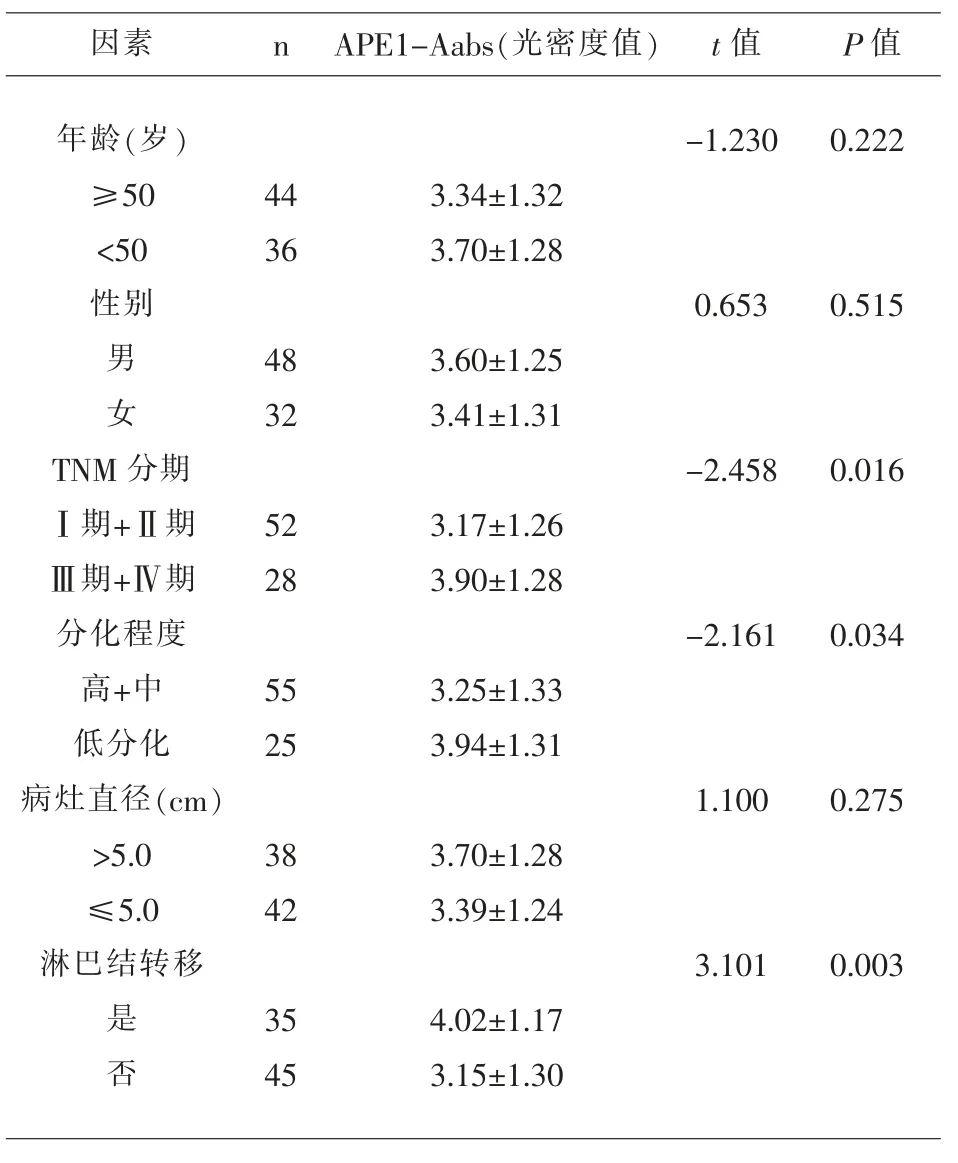
表2 不同临床病理学特征的直肠癌患者血清APE1-AAbs 检测结果比较()
因素 n APE1-Aabs(光密度值) t 值P 值年龄(岁)≥50<50性别-1.2300.222 44 36 3.34±1.32 3.70±1.28 0.6530.515男 女48 32 3.60±1.25 3.41±1.31 TNM 分期Ⅰ期+Ⅱ期Ⅲ期+Ⅳ期分化程度高+中低分化病灶直径(cm)>5.0≤5.0淋巴结转移-2.4580.016 52 28 3.17±1.26 3.90±1.28-2.1610.034 55 25 3.25±1.33 3.94±1.31 1.1000.275 38 42 3.70±1.28 3.39±1.24 3.1010.003是 否35 45 4.02±1.17 3.15±1.30
APE1-AAbs 是核酸限制性内切酶, 其通过对于癌细胞内癌基因P16 的内切修饰作用,能够提高癌细胞核转录的活性, 加剧癌细胞过度增殖的风险。分子生物学领域的机制研究认为,APE1-AAbs还能够提高癌细胞转录上游启动子和增强子的激活程度, 最终增加肿瘤细胞的核转录障碍风险[12]。部分研究者已经探讨了核酸内切酶相关因子在消化道肿瘤患者中的表达情况,认为在消化道肿瘤患者中, 核酸内切酶相关因子的表达浓度明显上升[13,14],但缺乏对于APE1-AAbs 的诊断学具体价值分析。
本次研究发现, 在直肠癌患者体内APE1-AA bs 的表达浓度明显高于良性或者正常对照人群,统计学差异较为显著,表明APE1-AAbs 在直肠癌患者中存在较为明显的上升趋势。之所以存在较高的APE1-AAbs 表达,主要由于癌基因代谢调控紊乱,诱导了核酸切除修复的障碍,导致核酸切除修复酶活性的异常,最终促进了 APE1-AAbs 的反馈性上升。有其他研究者也认为,在直肠癌患者病灶组织中,APE1-AAbs 的表达浓度可随着直肠癌患者病情的进展而上升,特别是在5 年生存率较低或者短期内病情进展风险较高的患者中,APE1-AAbs 的表达浓度上升更为明显[15]。诊断学价值分析可见,在直肠癌患者中,APE1-AAbs 的诊断灵敏度和特异度均较为理想, 其诊断的效能均可接近80%左右, 但仍然存在APE1-AAbs 漏诊和误诊的风险。临床上对于高危直肠癌人群,必要时可以通过联合APE1-AAbs 及其他肿瘤标志物,从而提高直肠癌的筛查效能。在探讨APE1-AAbs 的表达与直肠癌患者临床病理特征的关系过程中,发现在临床分期较高、淋巴结明显转移或者直肠癌细胞分化不良的患者中,血清APE1-AAbs 的表达浓度较高,提示了APE1-AAbs 的表达对于直肠癌患者临床病理特征的影响。这主要由于APE1-AAbs 的上升,能够提高癌细胞基因调控转录因子的活性,增加了癌细胞的浸润和粘附能力,促进了直肠腺体病变细胞对于邻近组织或者淋巴结的侵袭过程,最终影响到了相关临床病理特征的进展;而APE1-A Abs 对于癌细胞分化调控的影响,主要由于其能够干预到癌细胞分化诱导因子cyc 的代谢,从而影响到癌细胞分化成熟过程[16,17]。
综上所述,在直肠癌患者中,血清APE1-AAbs的表达浓度明显上升,检测血清APE1-AAbs 水平对于直肠癌的诊断及病理学特征评估均具有一定的临床价值。

