P53蛋白、Rictor蛋白表达水平与子宫内膜癌病理特征的关系
王丽娟,贺全勤,赵盼
(驻马店中心医院妇科,河南 驻马店463000)
流行病学研究发现,子宫内膜癌的发病率可接近在586~687/1 万人左右[1],在合并有相关高危因素的人群中, 子宫内膜癌的发病率可持续性的上调。临床上子宫内膜癌的发生,能够导致患者远期生存时间的缩短,增加患者的肿瘤恶病质的发生风险[2]。P53 蛋白能够通过提高癌细胞核DNA 的分裂速度,促进癌细胞的异常转录和分化,进而导致子宫内膜腺体细胞恶性病变的发生[3];Rictor 蛋白是mTOR 信号通路上的效应分子,其能够通过提高癌细胞的G1/S 期细胞比例,影响到P53 蛋白的水平,进而促进早期恶性肿瘤细胞的发生和转移[4]。部分研究者探讨了P53 蛋白的表达与子宫内膜癌的关系,认为P53 蛋白的表达上升与子宫内膜癌的发生密切相关[5],但缺乏对于Rictor 蛋白的表达分析研究。为了揭示P53 蛋白、Rictor 蛋白的表达与子宫内膜癌的病情关系, 本次研究选取我院2016 年3 月至2017 年2 月收集的90 例子宫内膜癌组织,探讨了P53 蛋白、Rictor 蛋白的表达及其与患者的病情关系。
1 资料与方法
1.1 临床资料 选取我院 2016 年3 月-2017 年2月收集的90 例子宫内膜癌组织(内膜癌组)、正常子宫内膜组织90 例(对照组)。
内膜癌组,年龄 39~64 岁,平均 53.5±8.2 岁,FIGO 分期:Ⅰ期 20 例、Ⅱ期 38 例、Ⅲ期 26 例、Ⅳ期6 例;组织学分化:高分化29 例、中分化38 例、低分化23 例;淋巴结转移阳性39 例;血管浸润15例。对照组,年龄 41~65 岁,平均 54.0±8.8 岁。两组研究对象的年龄比较,差异无统计学意义(P>0.05)。
纳入标准:⑴子宫内膜癌患者的诊断标准参考中华医学会制定的标准[6];⑵患者年龄≤65 岁;⑶所有子宫内膜癌患者的诊断均经过手术后病理学检查证实;⑷正常子宫内膜组织标本来源于卵巢或子宫肌瘤手术获取的正常子宫内膜标本;⑸本研究经医学伦理委员会的批准。
排除标准:⑴伴有其他部位恶性肿瘤、放化疗病史;⑵伴有其他感染性疾病;⑶免疫性疾病;⑷近半年具有激素相关药物治疗史。
1.2 免疫组化检测方法 石蜡包埋,连续性切片厚度3μm,60℃烤片 60min,常规脱水后,采用 EDTA进行抗原修复,加入10μl 蒸馏水,加入10%过氧化氢 5μl,室温下孵育 30min,磷酸盐缓冲液(PBS)洗涤 3 次(每次 3min),加入P53 蛋白、Rictor 蛋白的单克隆抗体(1:1000 购自罗氏检测公司),37℃孵育60min,PBS 洗涤 3 次(每次 3min),分别加入 HRP 标记的P53 蛋白、Rictor 蛋白二抗 (1:2000 购自罗氏公司),37℃孵育 20min,PBS 洗涤3 次 (每次 3min),加入DAB 后,PBS 冲洗和复染, 脱水后在显微镜下进行观察。
1.3 免疫组化结果判断标准 免疫组化染色读片判断标准:Rictor 蛋白的阳性染色为黄色、棕黄色甚至更深的颜色且定位在子宫内膜上皮细胞的细胞质,P53 蛋白的阳性染色为黄色、棕黄色甚至更深的颜色且定位在子宫内膜上皮细胞的细胞核内;⑴依据染色深浅:无色(0 分)、淡黄色(1 分)、染色为棕黄色(2 分)、如果染色为褐色或者黑色(3分);⑵依据阳性细胞占比进行评分:占比范围≤10%(1 分)、占比范围 11%~50%(2 分)、占比范围51%~75%(3 分)、占比范围>75%(4 分),染色深浅评分与阳性细胞占比评分之乘积总分<3 分为阴性、≧3 分为阳性。
2 结果
2.1 两组标本中的P53 蛋白、Rictor 蛋白阳性表达率比较 子宫内膜癌组织中的P53 蛋白、Rictor 蛋白阳性表达率分别为48.89%、52.22%均显著的高于对照组的8.89%、12.22%, 差异具有统计学意义(P<0.05),见表1、图1、图2。
表1 两组标本中的P53 蛋白、Rictor 蛋白阳性表达率比较()
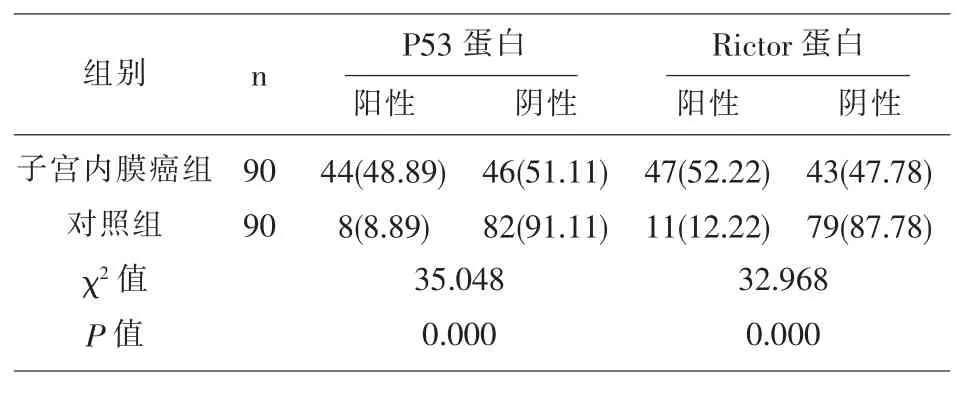
表1 两组标本中的P53 蛋白、Rictor 蛋白阳性表达率比较()
组别 n P53 蛋白阳性 阴性Rictor 蛋白阳性 阴性子宫内膜癌组对照组χ2 值P 值90 90 44(48.89)8(8.89)35.048 0.000 46(51.11)82(91.11)47(52.22)11(12.22)32.968 0.000 43(47.78)79(87.78)
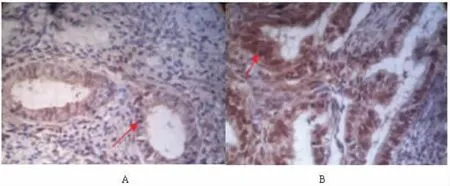
图1 P53 蛋白免疫组化结果,A 为正常子宫内膜组织、B 为子宫内膜癌组织,可见子宫内膜癌细胞细胞质中的棕色颗粒表达明显增多较正常子宫内膜细胞(×400)
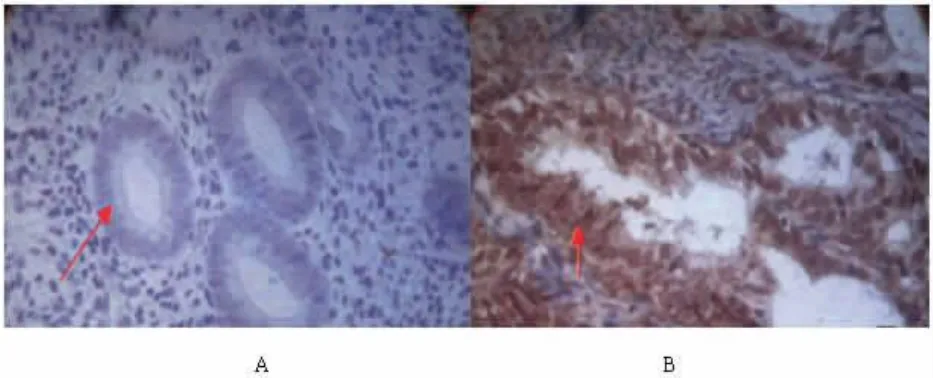
图2 Rictor 蛋白免疫组化结果,A 为正常子宫内膜组织、B 为子宫内膜癌组织,可见子宫内膜癌细胞细胞核中的棕色颗粒表达明显增多较正常子宫内膜细胞(×400)
2.2 不同病理学特征的子宫内膜癌组织中的P53蛋白、Rictor 蛋白阳性表达率比较 不同FIGO 分期、不同组织学分化程度、是否发生脉管浸润的子宫内膜癌组织中的P53 蛋白阳性表达率差异均具有统计学意义(P<0.05);不同FIGO 分期、不同组织学分化程度、是否发生脉管浸润、是否发生淋巴结转移子宫内膜癌患者的Rictor 蛋白阳性表达率比较,差异具有统计学意义(P<0.05);见表2、表3。
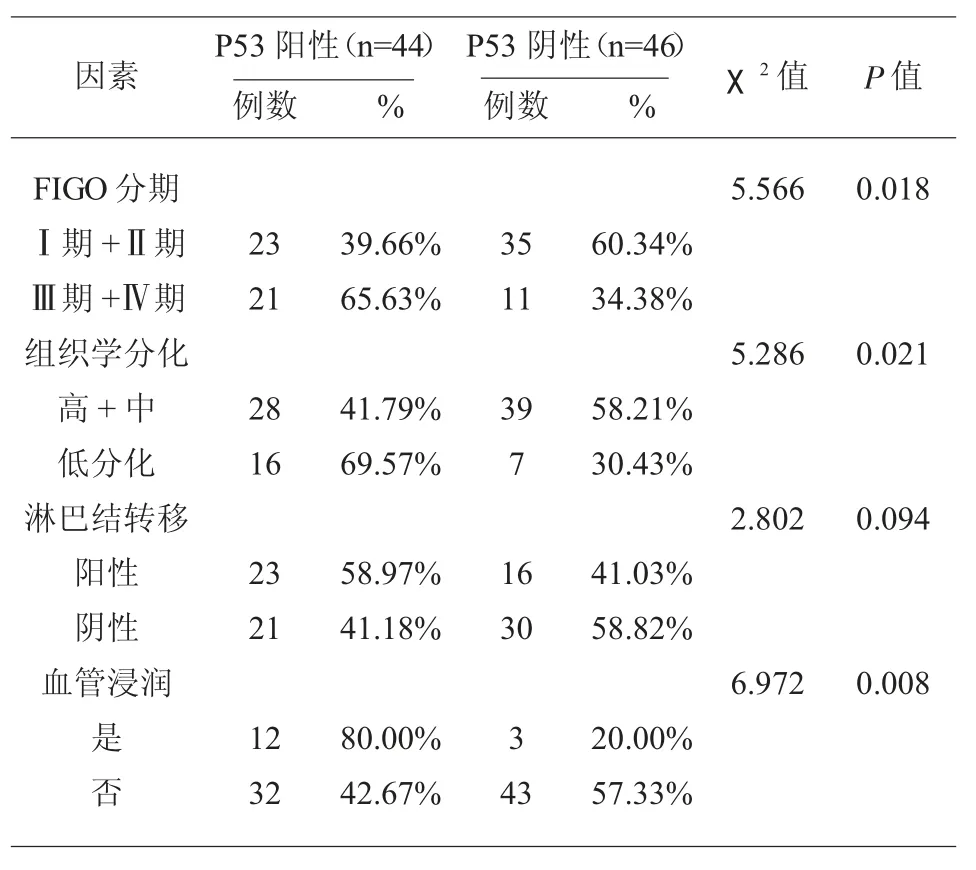
表2 不同病理学特征的子宫内膜癌组织中的P53 蛋白阳性表达率比较
3 讨论
子宫内膜腺体细胞的异常增殖或者分裂,能够显著促进子宫内膜癌的发生,特别是在肥胖、吸烟或者合并有雌激素受体敏感性改变的人群中,子宫内膜癌的发病率可进一步的上升[7]。临床上的观察发现, 子宫内膜癌患者的5 年生存率不足45%,其治疗后的远期无瘤生存时间或者无进展生存期也无明显的改善[8,9]。现阶段缺乏对子宫内膜癌病情评估的分子指标, 虽然P53 等肿瘤标志物,能够在子宫内膜癌的诊疗过程中发挥作用,但单独P53 评估子宫内膜癌的局限性较为明显。本次研究通过对于子宫内膜癌患者病灶组织中P53 蛋白、Rictor 蛋白的表达分析研究, 能够为临床上子宫内膜癌的联合评估提供参考,同时能够降低单独P53评估的假阳性率。
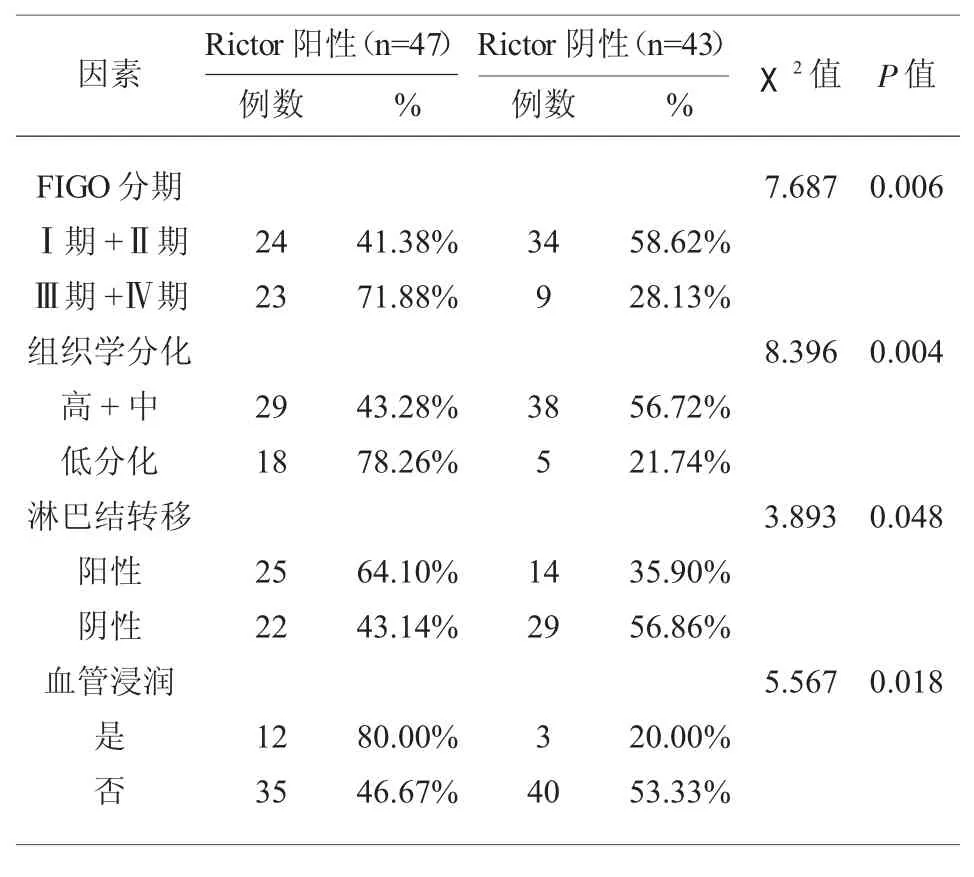
表3 不同病理学特征的子宫内膜癌组织中的Rictor 蛋白阳性表达率比较
P53 蛋白主要存在于子宫内细胞核内部,结构上含有脯氨酸及多重丝氨酸结构,其能够通过结合下游糖蛋白配体,进而促进多种恶性肿瘤信号通路的激活,促进癌细胞的持续性浸润和转移过程。P53蛋白能够影响到转录上游启动子的激活程度,进而促进癌细胞的异常转录和翻译,加剧癌细胞核基因的突变风险[10]。相关研究还认为,P53 蛋白对于癌细胞内MAPK 信号通路的上调作用,能够影响到肿瘤细胞的早期发生[11];Rictor 蛋白主要存在于子宫内膜细胞质内, 是mTOR 信号通路效应分子,能够通过提高肿瘤细胞间质成分的分解,提高金属蛋白酶的激活程度,进而为肿瘤细胞的转移提供基础。Rictor 蛋白对于癌细胞周期的调控作用,能够影响到癌细胞跨越G0 期的速度,进而干预到肿瘤的中晚期病情进展[12]。部分研究者探讨了P53 蛋白的表达与子宫内膜癌的关系[13],但缺乏对于P53 的表达与子宫内膜癌的临床病理特征的分析,同时缺乏对于Rictor 蛋白的探讨。
本次研究可以发现, 在子宫内膜癌病灶组织中,P53 蛋白、Rictor 蛋白的表达阳性率水平均明显的上升,高于正常对照组病灶组织,统计学差异较为显著,提示了P53 蛋白、Rictor 蛋白的高表达,均能够影响到子宫内膜癌的发生发展过程。试图探讨P53 蛋白、Rictor 蛋白的高表达对于肿瘤发生的影响, 分析可能由于下列病理性因素有关[14,15]:⑴P53 蛋白的表达上升, 能够促进癌细胞内NF-KB或者MAPK 信号通路的激活,导致癌细胞的基因错配修复能力的下降;⑵Rictor 蛋白的表达上升,能够干预到上皮-间质转换过程,提高细胞的变形能力,进而促进癌细胞的粘附和浸润过程。沈运等[11]研究者也发现, 在子宫内膜癌病灶组织中,P53 蛋白的表达阳性率可平均上升35%~55%以上,在合并有明显的盆腔内转移或者腹水的患者中,P53 蛋白的表达阳性率可进一步的上升。在探讨P53 蛋白、Rictor 蛋白的表达与子宫内膜癌临床病理特征的关系过程中,可以发现P53 蛋白的高表达与患者临床分期、组织学分级或者脉管浸润密切相关,提示了P53 蛋白的表达与子宫内膜癌的综合性病情的关系,这主要由于P53 蛋白的表达上升,能够提高癌相比的浸润深度,促进其对于盆腔内淋巴结组织的粘附,进而加剧了相关临床病理特征的进展。而在FIGO 分期较晚、组织学分化程度较差、发生脉管浸润、发生淋巴结转移的患者中,Rictor 蛋白的表达同样明显的上升,提示了Rictor 的表达与子宫内膜癌的病情关系,这主要由于Rictor 蛋白的表达上升,能够导致癌细胞的生物学特征的恶化,进而促进相关临床病理的进展。单独P53 蛋白、Rictor 蛋白在诊断子宫内膜癌的过程中具有一定的局限性,而通过联合P53 蛋白、Rictor 蛋白,能够避免单一指标灵敏度低导致子宫内膜癌病情评估不足的缺陷。
综上所述, 在子宫内膜癌病灶组织中,P53 蛋白、Rictor 蛋白的表达阳性率均明显上升, 同时P 53 蛋白、Rictor 蛋白的表达与子宫内膜癌的临床病理特征密切相关。

