杂质铝对磷酸酯混合萃取剂从铵盐浸出液中萃取稀土的影响
马驰远, 徐珊, 徐源来, 周芳, 池汝安
武汉工程大学 化工与制药学院绿色化工过程教育部重点试验室,湖北 武汉 430073
引 言
风化壳淋积型稀土广泛分布于我国南方地区,是以离子相形态存在的特有矿产资源[1],具有规模大、储量丰富、放射性低、开采容易、提取稀土工艺简单、成本低、产品质量好等特点[2]。由于风化壳淋积型稀土矿为黏土矿物[3],成分复杂,所含稀土品位低,目前广泛采用电解质浸取的第三代原地浸出工艺开采稀土。即在矿体顶部注入铵盐类浸出液,渗透流经矿体,浸出液中的铵根离子能置换出吸附在黏土矿物表面的稀土离子,使之进入浸出液,经导流管,在矿体底部收集富含稀土的浸出液。但由于原地浸出的选择性较差,得到的浸取液的化学组成复杂且稀土浓度低,稀土浓度一般为0.5~2 g·L-1,杂质含量高,其中的铁、硅等杂质的含量高达250 mg·dm-3左右,而Al3+的含量更是达到200 ~ 3 000 mg·dm-3[4]。这些杂质离子对稀土的富集提纯过程会产生较大的负面影响[5],例如造成萃取剂在萃取过程中的乳化[6-7],严重影响萃取效果,所以工业上常采用沉淀等方法将其预先除去或大幅降低其浓度。
目前工业上稀土浸出液的处理方法是先沉淀除去杂质离子,用草酸或碳酸氢铵将稀土沉淀分离,将稀土沉淀烘干后煅烧、酸液溶解,再进行稀土的萃取分离提纯[8-10]。这个处理过程较为繁琐,能源消耗大,且含酸溶液的使用会给后续的酸废水处理环节带来一定的压力,另外,多步的分离过程还会造成一定量稀土资源的损失。所以,如何直接从这种复杂的低浓度浸出液中一步法选择性分离富集稀土是迫切需要解决的难题和研究热点之一[11]。
我国的科技工作者先后探索了多种从风化壳淋积型稀土矿浸出液中提取稀土的方法,主要有沉淀浮选法、溶剂萃取法、离子交换法、液膜分离法、微生物吸附法等[12-18]。其中溶剂萃取法是用于稀土提取和分离最重要的方法之一[19]。常见的液液萃取过程主要用单种或复合P507、P204等酸性膦类萃取剂在无机酸环境下进行稀土离子萃取[20-25],以及运用目前的新型的萃取剂——二(2,4,4-三甲基戊基)次膦酸(Cyanex272)单独或复合其他萃取剂萃取稀土[26-27],也有文献报道将Cyanex272合成浸渍树脂进行稀土吸附研究[28-29]。2-乙基己基磷酸酯(单酯与二酯11混合)作为一种稀土特效萃取剂,与P204、P507、Cyanex272、TBP等萃取剂同属酸性磷酸类萃取剂,目前有文献报道关于该萃取剂在酸性环境中对稀土有较好的萃取效果[30-31],而该萃取剂在铵盐环境下的萃取应用鲜有文献报道。在实际试验中发现,该萃取剂皂化过程简便、分相快速。故本文选用此萃取剂,从常用的三种铵盐原地浸出溶液,氯化铵、硫酸铵和硝酸铵[32]中,探讨其对稀土的萃取行为,并探究浸出液中主要杂质离子Al3+对RE3+萃取行为的影响。
1 试验部分
1.1 仪器与试剂
本试验主要使用的仪器有电感耦合等离子体质谱(ICP-MS,安捷伦科技有限公司)、Nicolet 6700傅里叶变换红外光谱仪(赛默飞世尔科技公司)、XH-C旋涡混合器(常州越新仪器制作有限公司)、EL204电子分析天平(梅特勒-托利多仪器(上海)有限公司)等。
试剂有萃取剂P0261(2-乙基己基磷酸酯)(分子式如图1所示)[33](CAS:12645-31-7),由梯希爱(上海)化成工业发展有限公司生产;氯化铵、硫酸铵、硝酸铵、乙二胺四乙酸二钠盐、磺基水杨酸、氢氧化铵、盐酸、六次甲基四氨、氢氧化钠、二甲酚橙、AlCl3·2H2O均为分析纯,国药集团化学试剂有限公司生产;磺化煤油由武汉拉那白医药化工有限公司生产;Nd(NO3)3·6H2O(CAS:16454-60-7,99.9% metals basis)、La(NO3)3?6H2O(CAS:10277-43-7,分析纯 AR)均由上海阿拉丁生化科技股份有限公司生产。
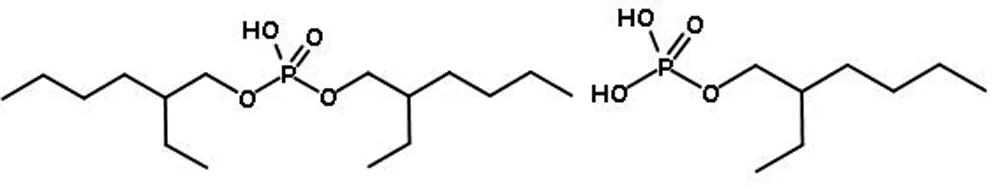
图1萃取剂的分子结构
Fig. 1 Molecular structure of extractant
1.2 试验方法
(1)
C0=Ci×E
(2)
CA=C0-Ci
(3)
上式中,E为萃取率(%),CEDTA为配置EDTA溶液浓度(mol·dm-3),V2,V1分别为萃取前后含RE3+铵盐溶液在EDTA 容量法滴定中消耗的EDTA溶液的体积(cm3),C0为萃取后萃取剂中RE3+浓度(mol·dm-3),Ci为萃取前的溶液中的RE3+浓度(mol·dm-3),CA为萃取后水相中RE3+浓度(mol·dm-3)。
2 结果与讨论
由课题组前期大量的浸出工艺研究得知,在铵根离子浓度为2 mol·dm-3时,稀土的浸出率达到最佳值,故以下试验均选用铵根离子浓度为2 mol·dm-3的溶液。同时,风化壳淋积型稀土矿浸出液中La3+、Nd3+的含量较高,均在10%以上[34],故选用这两种稀土离子进行试验。风化壳淋积型稀土矿浸出液是由铵盐(NH4Cl、(NH4)2SO4、NH4NO3等)溶液流经矿体收集所得,所以选择以上三种铵盐为背景溶液,探讨萃取剂对La3+、Nd3+的萃取行为及杂质离子铝对其萃取行为的影响。
2.1 原溶液RE浓度与萃取率E的关系
试验中,硫酸铵溶液的浓度大于0.05 mol·dm-3时,有晶体析出,而NH4Cl、NH4NO3在0.01~0.25 mol·dm-3浓度范围内均有良好的溶解性。所以分别考察了0.01~0.25 mol·dm-3NH4Cl和NH4NO3溶液、0.01~0.05 mol·dm-3(NH4)2SO4溶液中稀土离子浓度对萃取行为的影响,结果如图2所示。其中(a)、(c)、(e)图为萃取总量C0与初始稀土离子浓度Ci作图得,(b)、(d)、(f)图为萃取总量C0与该稀土浓度下的萃取率E作图得。
由图2中(a)、(c)、(e)可得,在达到饱和萃取容量前,三种铵盐溶液中,La3+、Nd3+的总萃取量C0均随着初始浓度Ci的增大而增大,C0和Ci呈正相关,Nd3+的C0要大于La3+。
三种铵盐的E的变化趋势趋于一致,Ci在0~0.03 mol·dm-3时,总萃取量C0的增幅较大,E降幅较弱;Ci在0.03 ~ 0.05 mol·dm-3,总萃取量C0的增幅变缓,E下降明显。当Ci大于0.05 mol·dm-3时,因硫酸铵中有沉淀产生故不再做讨论,NH4Cl和NH4NO3溶液中正常澄清,C0的增幅下降明显;当Ci达到0.20 mol·dm-3,C0不再增大。
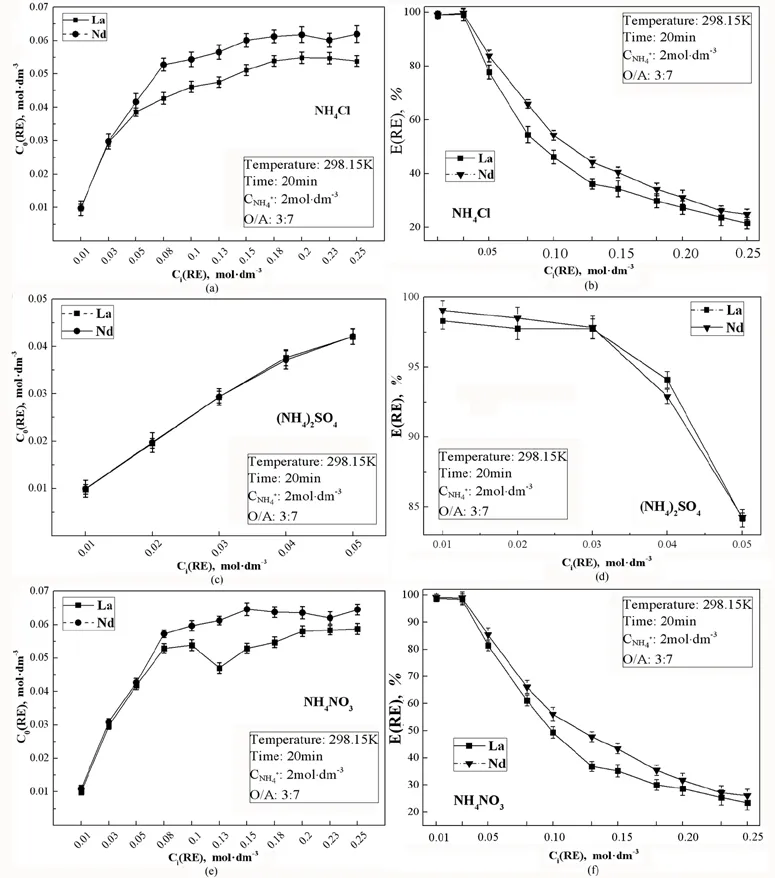
图2三种铵盐溶液中RE3+的初始浓度Ci对萃取总量C0、萃取率E的影响
Fig. 2 Effect of initial concentration Ci of RE3+on total extractionC0and extraction rateEin three ammonium salt solutions
由图2中(b)、(d)、(f)可知,三种铵盐中La3+、Nd3+的萃取率E均随稀土离子浓度Ci的增大而明显减小。即溶液中RE3+的浓度越大,则萃取剂在该RE3+浓度下萃取RE3+的萃取率E越低。Ci=0.03 mol·dm-3时,La3+、Nd3+的萃取量均为:NH4Cl体系>NH4NO3体系>(NH4)2SO4体系。Ci=0.05 mol·dm-3时,La3+的萃取量:(NH4)2SO4体系 > NH4NO3体系 > NH4Cl体系,Nd3+的萃取量:NH4NO3体系 > (NH4)2SO4体系>NH4Cl体系。
硫酸铵溶液的浓度大于0.05 mol·dm-3时,有晶体析出,故而其有限的可用区间数据无法用于其萃取等温线的完整拟合。将氯化铵和硝酸铵溶液C0与萃余水相浓度CA做图并进行拟合,得到298.15 K下两种RE3+分别在两种铵盐溶液中的萃取等温线图,如图3。
由图2、图3可知,在298 K时,NH4Cl、NH4NO3溶液中,萃取剂对Nd3+的饱和萃取量要大于La3+,La-NH4Cl、La-NH4NO3、Nd-NH4Cl、Nd-NH4NO3四种体系下Ci分别在0.20 mol·dm-3、0.20 mol·dm-3、0.18 mol·dm-3、0.15 mol·dm-3时萃取后萃取剂达到饱和萃取量,此时C0分别为0.055 mol·dm-3、0.058 mol·dm-3、0.063 mol·dm-3、0.064 mol·dm-3,之后C0随Ci的增大不再增大,达到平衡。
所以,原溶液初始RE3+浓度Ci能对萃取剂的萃取La3+、Nd3+的萃取能力产生明显影响,同等条件下,萃取剂对Nd3+的萃取效果优于La3+,Nd3+饱和萃取浓度大于La3+。
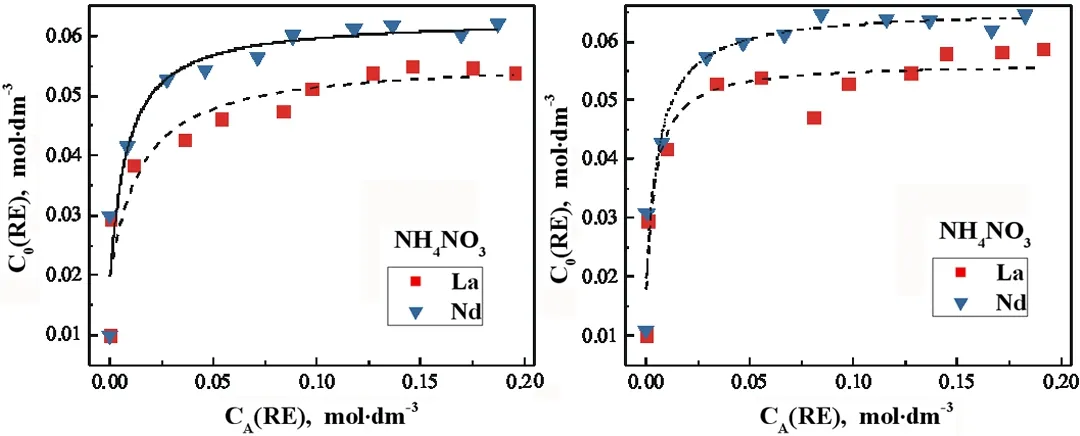
图3NH4Cl、NH4NO3溶液在298.15 K的拟合萃取等温线
Fig. 3 Fitting extraction isotherm of NH4Cl and NH4NO3solutions at 298.15K
2.2 Al浓度变化对RE萃取行为的影响
风化壳淋积型稀土矿铵浸出液中,含有主要金属杂质离子Al3+、Ca2+、Mg2+、Fe3+等,其中Al3+为主要杂质离子,含量可达200~3 000 mg·dm-3,但在萃取试验中,当Al3+浓度超过1 000 mg·dm-3时较易引起乳化,影响萃取后两相的正常分相。结合图2,当CRE=0.05 mol·dm-3时,稀土萃取率E在77.74%~85.37%,说明此时依然有较理想的萃取率,总萃取量C0达到0.039~0.043 mol·dm-3,萃取量较大,且CRE>0.05 mol·dm-3时,硫酸铵体系会有晶体产生。
综合考虑,故选CRE=0.05 mol·dm-3,Al3+浓度20 ~ 1 000 mg·dm-3开展后续试验。在原溶液RE3+浓度为0.05 mol·dm-3、NH4+浓度为2 mol·dm-3的条件下,分别将含20~1 000 mg·dm-3的Al3+加入水相,讨论不同铵盐溶液中Al3+浓度对稀土萃取率的影响,得图4。
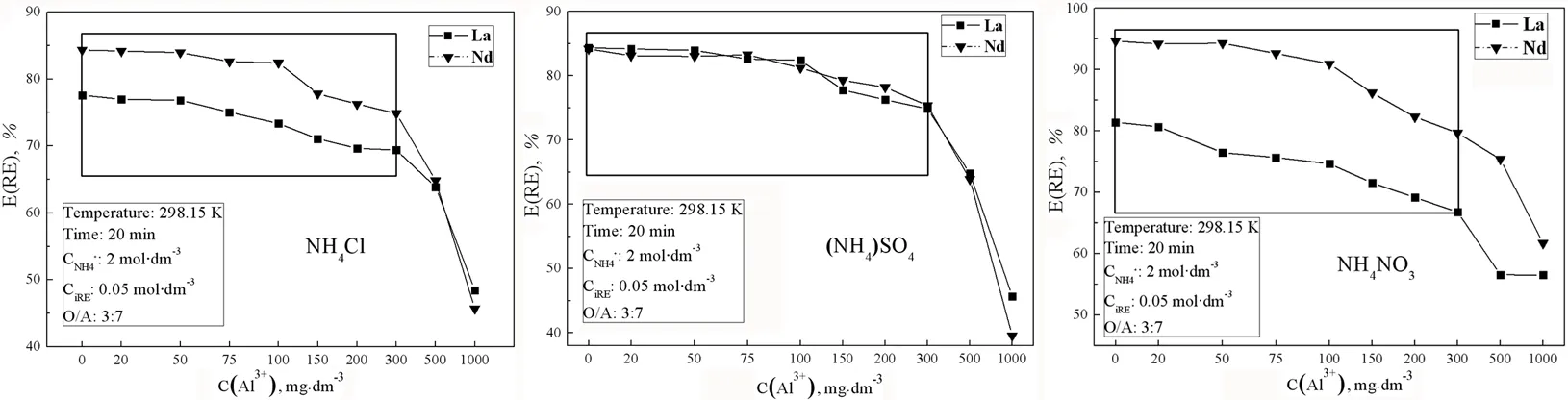
图4三种铵盐溶液中C(Al3+)对萃取率E的影响
Fig. 4 Effect of C(Al3+) on extraction rate E in 3 kind of ammonium salts solution
由图4可知,萃取剂对Nd3+的萃取效果依旧要优于La3+,三种铵盐溶液中,在(NH4)2SO4溶液下萃取效果相对最佳。Al3+的加入会降低萃取率从而对萃取行为产生影响,溶液中Al3+浓度越大,则萃取后RE3+进入有机相的浓度越低,萃取率E越小。试验中,Al3+浓度越大,萃取后有机相浑浊越发明显,当Al3+浓度在0 ~ 300 mg·dm-3范围内时,E随Al3+浓度的增大,降幅较为缓慢,当Al3+浓度大于300 mg·dm-3时,降幅明显。
Al3+浓度在300 mg·dm-3时E最大为79.69%,最小为66.81%,分别来自Nd-NH4NO3和La-NH4NO3,E损失最小为La3+-NH4Cl的8.36%,最大为La3+-NH4NO3达到14.68%。
Al3+浓度在1000 mg·dm-3时E最大为61.71%,最小为39.54%,分别来自Nd-NH4NO3和Nd-(NH4)2SO4,E损失最小为La3+-NH4NO3的24.89%,最大为La3+-(NH4)2SO4的44.65%,(NH4)2SO4溶液中达到38.59%~44.65%,为三者中最大。
另外,Al3+浓度在0~300 mg·dm-3时,(NH4)2SO4溶液的E受C(Al3+)影响最小,NH4NO3溶液的E受C(Al3+)影响最为明显;Al3+浓度在300~1 000 mg·dm-3之间,NH4NO3溶液的E受C(Al3+)影响最小,(NH4)2SO4溶液的E受C(Al3+)影响最为明显。
2.3 含铝离子时铵根浓度变化对RE萃取行为的影响
在风化壳淋积型稀土矿铵浸工艺中,RE3+的浸出率η随着NH4+的浓度增大而增大。为考察C(NH4+)变化对RE3+萃取行为的影响,本试验取CAl=200 mg·dm-3、CRE=0.05 mol·dm-3,仍选取NH4Cl、(NH4)2SO4、NH4NO3三种铵盐溶液作为背景溶液,探究铵离子浓度变化对RE3+萃取率的影响,得图5。

图5铵盐溶液中C(NH4+)对萃取率E的影响
Fig. 5 Effect of C(NH4+) on extraction rateEin 3 kind of ammonium salts solution
由图5可知,当NH4+浓度变化,其他条件不变时,萃取剂对Nd3+的萃取效果仍然优于La3+。NH4Cl、(NH4)2SO4、NH4NO3三种铵盐溶液中,萃取率E均C(NH4+)增大而减小。这是因为,溶液中C(NH4+)越大,液体的粘性变大[35-36],同种萃取剂下,底液的粘度越大则越不利于萃取过程的进行[37],另外,随着C(NH4+)的增大,溶液pH值减小,有利于游离态Al3+的形成[38],而游离态Al3+的半径小于RE3+,与酸性磷型萃取剂的结合能力更强,随着Al3+进入有机相,有机相萃取RE3+的能力下降[39],故在其他条件一致的条件下,C(NH4+)的增大不利于稀土萃取行为的进行。
2.4 萃取剂红外光谱分析
分别对磺化煤油、皂化前萃取剂、皂化后萃取剂进行红外光谱分析,得到红外分析光谱图如图6所示。
图6中,A区域为饱和C-H的伸缩震动区域,A2区域为饱和C-H的弯曲振动区域,B区域为氢键缔合P-O-H振动区域,C区域为缔合P=O键藕合振动,D区域为C-O键伸缩振动,E区域为P-O-C键藕合振动,F区域为P-O键伸缩振动[40-41]。对比图8中皂化前后的波普,萃取剂经过皂化后B处的峰强明显减弱接近于平缓,原因是因为皂化反应破坏了萃取剂原有的大部分P-O-H键,变为P-O-Na,同时含磷基团的峰均有不同程度的减弱,是因为加入稀释剂磺化煤油后使得含磷基团浓度降低,从而使得峰强减弱。同时P=O键的波数由皂化前的1 208.46 cm-1变为皂化后的1 201.58 cm-1,说明皂化后P=O仍旧以缔合形式存在,但缔合状态发生改变,键能被部分削弱。另外,皂化后的波谱中,3 397.64 cm-1处会出现平缓且透过率很弱的峰,是因为皂化反应后水分子的形成并部分残留在萃取剂中,羟基基团的存在使得此处出峰。红外图谱得出的结论能辅助的说明酸性磷类萃取剂的皂化机理。

图6萃取剂皂化前后的红外光谱图对比
Fig. 6 The comparison of FT-IR of extraction agent between the pre-saponification and post-saponification
2.5 负载有机相红外光谱分析
每组样品待萃取过程完成,静置至分相清晰且两相均匀稳定后,取各组样品有机相进行红外光谱分析,按Nd3+、La3+分类进行分析,分别得图7、图8、图9、表1、表2、表3。
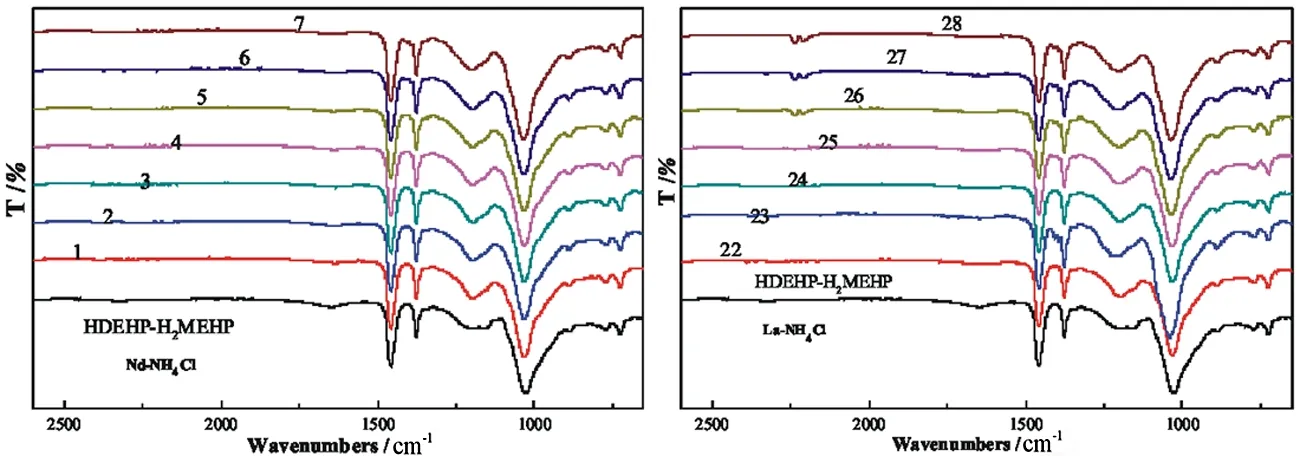
图7NH4Cl溶液中各C(NH4+)的萃后有机相FT-IR
Fig. 7 The Group of FT-IR of the extracted organic phase of each C(NH4+) in NH4Cl solution
表1NH4Cl中含P基团峰吸收频率变化
Table1 Peak absorption frequency changes of phosphorus-containing groups in NH4Cl
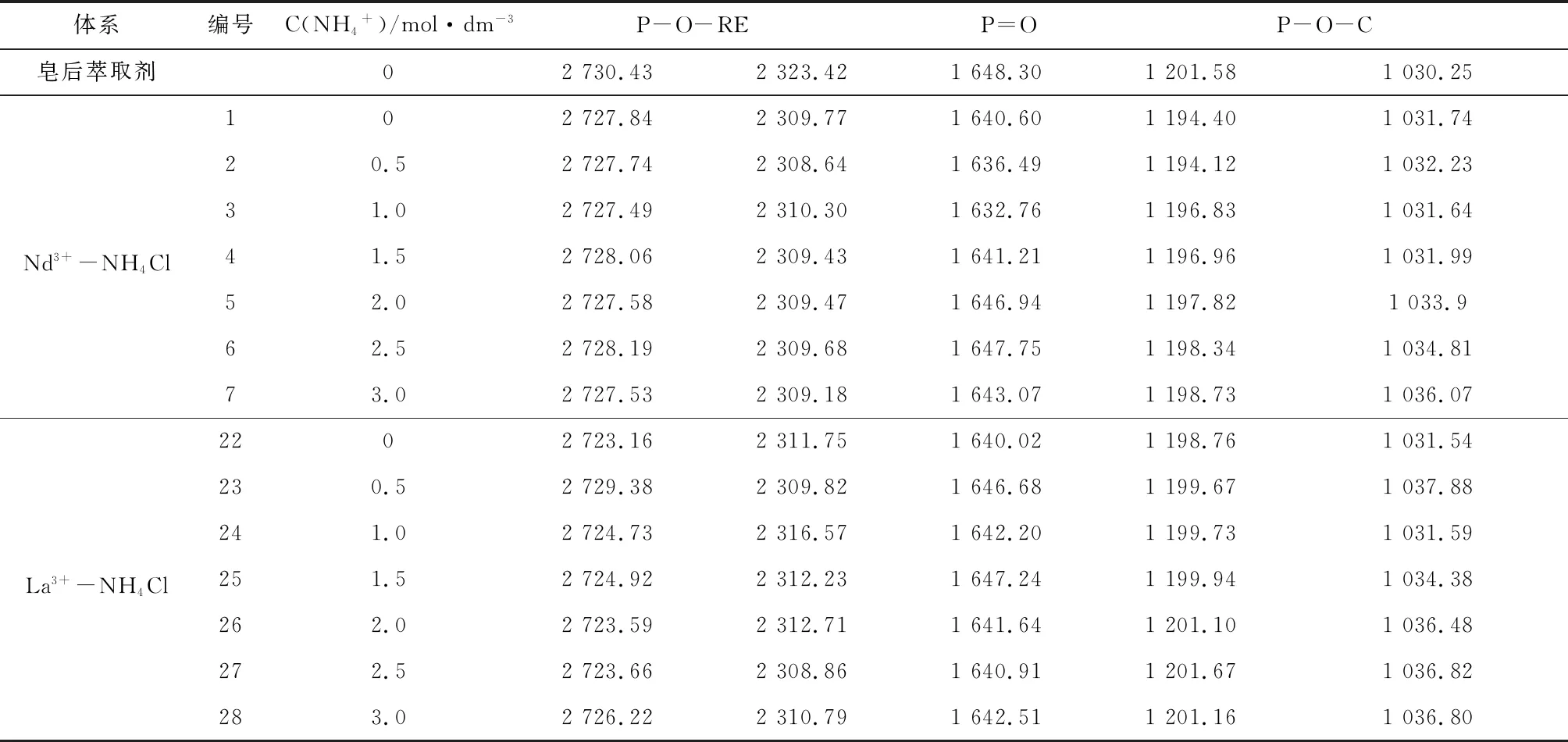
体系编号C(NH4+)/mol·dm-3P-O-REP=OP-O-C皂后萃取剂02730.432323.421648.301201.581030.25Nd3+-NH4Cl102727.842309.771640.601194.401031.7420.52727.742308.641636.491194.121032.2331.02727.492310.301632.761196.831031.6441.52728.062309.431641.211196.961031.9952.02727.582309.471646.941197.821033.962.52728.192309.681647.751198.341034.8173.02727.532309.181643.071198.731036.07La3+-NH4Cl2202723.162311.751640.021198.761031.54230.52729.382309.821646.681199.671037.88241.02724.732316.571642.201199.731031.59251.52724.922312.231647.241199.941034.38262.02723.592312.711641.641201.101036.48272.52723.662308.861640.911201.671036.82283.02726.222310.791642.511201.161036.80

图8(NH4)2SO4溶液中各C(NH4+)的萃后有机相FT-IR
Fig. 8 The Group of FT-IR of the extracted organic phase of each C(NH4+) in (NH4)2SO4solution
表2(NH4)2SO4中含磷基团峰吸收频率变化
Table2 Peak absorption frequency changes of phosphorus-containing groups in (NH4)2SO4solution
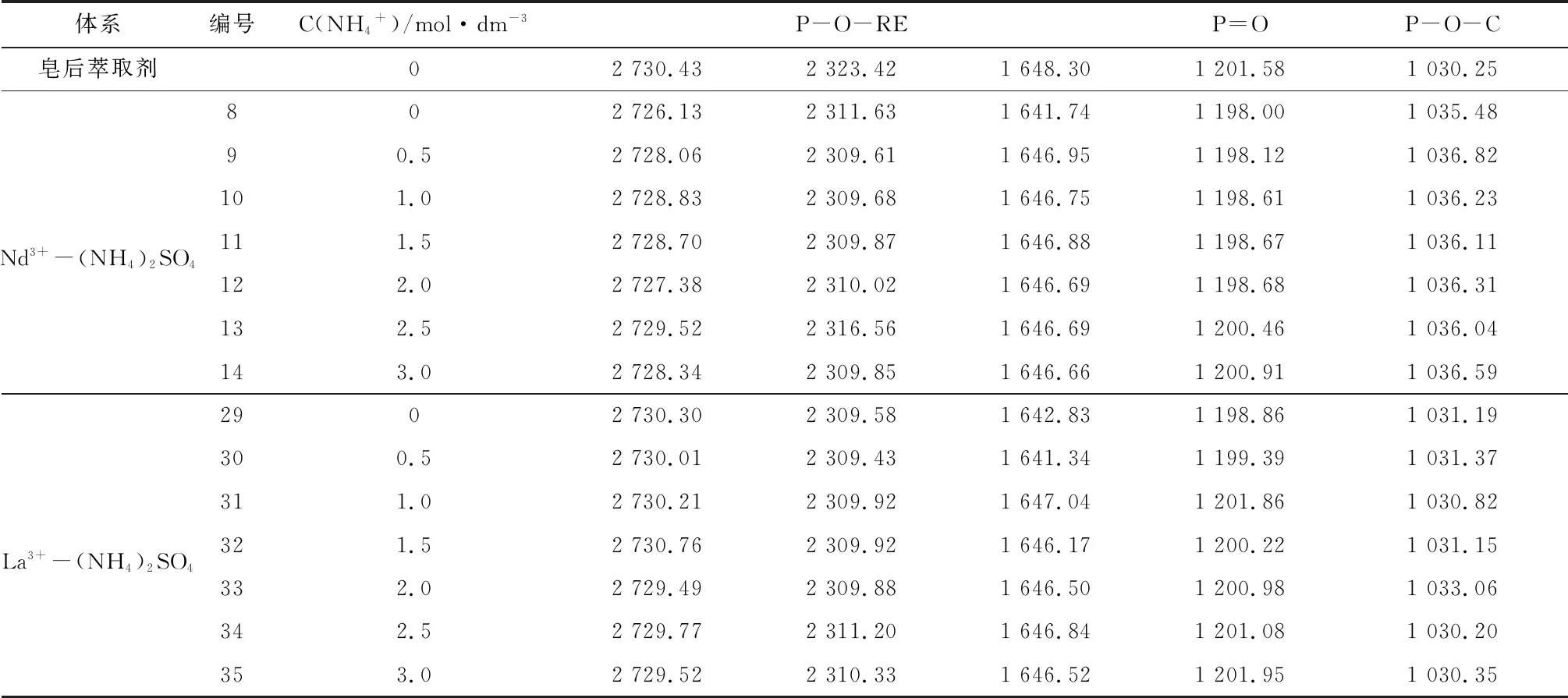
体系编号C(NH4+)/mol·dm-3P-O-REP=OP-O-C皂后萃取剂02730.432323.421648.301201.581030.25Nd3+-(NH4)2SO4802726.132311.631641.741198.001035.4890.52728.062309.611646.951198.121036.82101.02728.832309.681646.751198.611036.23111.52728.702309.871646.881198.671036.11122.02727.382310.021646.691198.681036.31132.52729.522316.561646.691200.461036.04143.02728.342309.851646.661200.911036.59La3+-(NH4)2SO42902730.302309.581642.831198.861031.19300.52730.012309.431641.341199.391031.37311.02730.212309.921647.041201.861030.82321.52730.762309.921646.171200.221031.15332.02729.492309.881646.501200.981033.06342.52729.772311.201646.841201.081030.20353.02729.522310.331646.521201.951030.35

图9NH4NO3溶液中各C(NH4+)的萃后有机相FT-IR
Fig. 9 The Group of FT-IR of the extracted organic phase of each C(NH4+) in NH4NO3solution
表3NH4NO3中含磷基团峰吸收频率变化
Table3 Peak absorption frequency changes of phosphorus-containing groups in NH4NO3solution
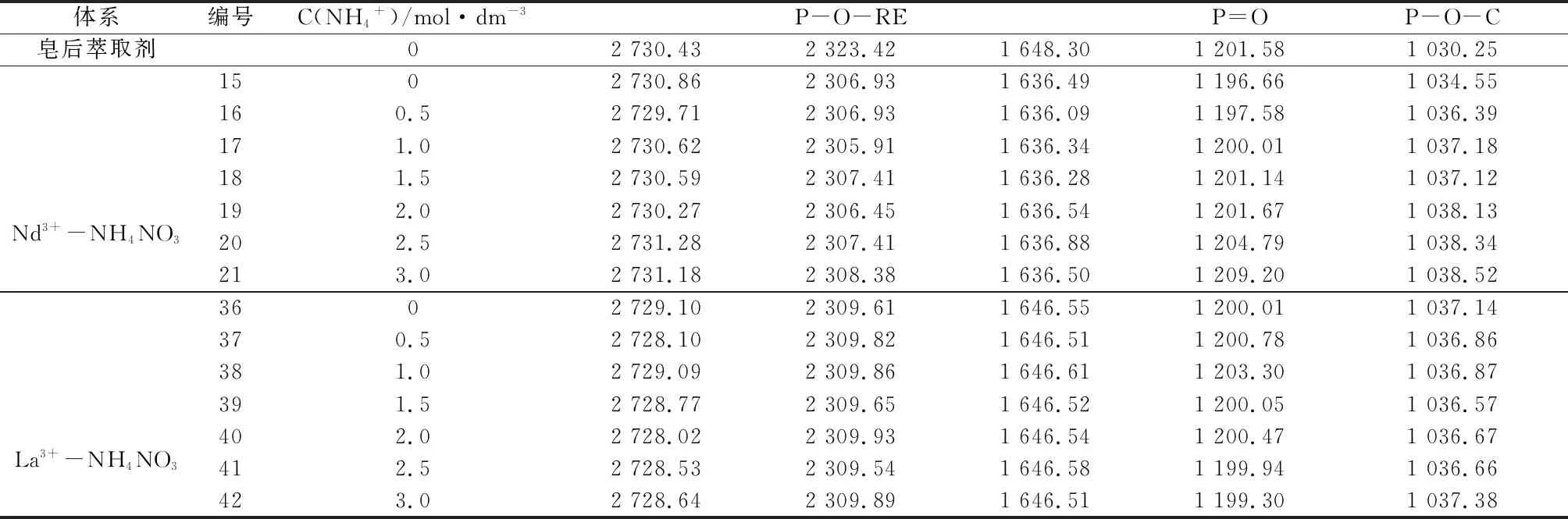
体系编号C(NH4+)/mol·dm-3P-O-REP=OP-O-C皂后萃取剂02730.432323.421648.301201.581030.25Nd3+-NH4NO31502730.862306.931636.491196.661034.55160.52729.712306.931636.091197.581036.39171.02730.622305.911636.341200.011037.18181.52730.592307.411636.281201.141037.12192.02730.272306.451636.541201.671038.13202.52731.282307.411636.881204.791038.34213.02731.182308.381636.501209.201038.52La3+-NH4NO33602729.102309.611646.551200.011037.14370.52728.102309.821646.511200.781036.86381.02729.092309.861646.611203.301036.87391.52728.772309.651646.521200.051036.57402.02728.022309.931646.541200.471036.67412.52728.532309.541646.581199.941036.66423.02728.642309.891646.511199.301037.38
在萃取过程中,P-O-H基团与P=O基团的萃后波数均较萃前波数有所减少,原因是在于金属离子进入有机相破坏了原有P-O-H基团,并使P=O不再与氢键缔合,但有新的缔合作用使P=O键能减弱,铵盐环境下,体系显酸性,且酸性磷类萃取体系中,萃取剂较RE3+优先萃取Al3+[42],故P-O-Al基团与P=O→Al配位键的形成削弱原基团的电子云,同时萃取过程中形成的P=O→RE配位键键能小于萃前萃取剂中的P=O的键能,结合表1~表3,每组样品中的P=O键能均随着NH4+浓度的增大而增大,整体趋势趋于原萃取剂的P=O键波长,说明NH4+浓度的变化会影响P=O→RE配位键的形成,从而反映出NH4+浓度的增大不利于稀土离子的萃取过程,这与结果与讨论2.3中的结论是一致的,同时,对比不同铵盐环境下La3+、Nd3+两种稀土的P=O键能,大部分情况下,Nd3+在同种铵盐溶液,同C(NH4+)的条件下P=O键能要小于La3+的,这反映出同种条件下Nd3+相对La3+与P=O更容易形成配位键P=O→RE键,即Nd3+更易被萃取,与前文所述试验结果一致。
3 结论
为从风化壳淋积型稀土矿铵盐浸出液中一步法萃取分离富集稀土,本文研究了在氯化铵、硫酸铵、硝酸铵三种铵盐浸出液中,萃取剂2-乙基己基磷酸酯(单酯与二酯11混合物)对稀土离子La3+、Nd3+的单级萃取行为,并讨论了杂质离子铝对其萃取行为的影响。试验结果表明:
(1)在2 mol·dm-3三种铵盐溶液中,萃取剂P0261均能够有效萃取稀土离子La3+、Nd3+,且对La3+的萃取总量为:(NH4)2SO4体系 > NH4NO3体系 > NH4Cl体系,对Nd3+的萃取总量为:NH4NO3体系 > (NH4)2SO4体系 > NH4Cl体系。加入Al3+后,稀土萃取率E会随Al3+浓度增大而减小,特别是当Al3+浓度在300 mg·dm-3以上时,E降幅明显增大,最大降幅从14.68% 到44.65%。且稀土的萃取率在NH4NO3溶液中受Al3+浓度变化影响最大,同时Al3+浓度增大对Nd3+的萃取影响大于La3+。
(2)分析负载有机相可知,Al3+比RE3+更易与萃取剂中的P=O形成配位键、铵根离子浓度变化会影响P=O→RE配位键的形成,从而影响萃取行为;且相同条件下Nd3+相对La3+与P=O更容易形成配位键P=O→RE键,所以Nd3+更易被萃取且萃取行为受杂质离子影响较大。
因此,如若能优化原地浸出注液收液工艺,将浸出液中铝离子的浓度控制在300 mg·dm-3以下,可以为后续使用萃取剂2-乙基己基磷酸酯一步法分离提纯稀土奠定良好的基础。
——基于正交试验优化的皂化反应法△

