不同核酸提取试剂盒在新型冠状病毒核酸检测中的比较研究
马雯 张伟宏 马瑛龙 葸静 金哲宇,5 朴文花★
新型冠状病毒(2019 Novel Coronavirus,2019-nCoV)引起的肺炎广泛传播,并在全球蔓延。国际病毒分类协会将其命名为严重急性呼吸综合征冠状病毒2(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2),随后世界卫生组织公布其基因组序列,并将该病毒导致的疾病命名为COVID-19(Corona Virus Disease 2019)[1-2]。国家卫生健康委多次印发新型冠状病毒肺炎诊疗方案,始终将逆转录实时荧光定量聚合酶链式反应(Reverse Transcription Quantitative Real-time Polymerase Chain Reaction,RT-qPCR)检测新型冠状病毒的核酸作为确诊及治疗监测的重要指标[3]。现已注册的新冠病毒核酸检测试剂多以开放阅读框架1ab(Open Reading Frame 1ab,ORF1ab)基因、核衣壳蛋白(Nucleocapsid,N)基因及包膜蛋白(Envelope,E)基因为检测对象,同时携带内源性内标(Internal Control,IC)基因,实现对新型冠状病毒的核酸检测[4]。有医院发现新冠核酸检测结果存在假阴性较高,与临床症状不相符,不同厂家检测试剂盒结果不一致等问题[5-6]。影响新冠病毒核酸检测结果的因素很多,尽管多数实验室都在关注检测试剂的性能,但实际上,核酸纯度及浓度在RT-qPCR 检测过程中也十分重要,因此基于目前所出现的问题,本实验室通过收集6种新型冠状病毒核酸提取试剂盒的基本情况,比较其核酸提取效果及RT-qPCR扩增结果等参数,综合分析试剂盒的性能,为使用者合理选择试剂提供参考依据。
1 材料与方法
1.1 标本来源
收集2020年2月15日至2020年2月29日就诊本院发热门诊的20例疑似新型冠状病毒感染者的鼻咽部拭子作为标本,按照规定转运至分子生物学实验室立即检测,检测前置于65℃水浴灭活20 min。
1.2 实验方法
使用RT-qPCR扩增新型冠状病毒核酸。所有检测严格按照《医疗机构临床基因扩增检验实验室管理办法》(国卫办医政发〔2010〕194号)[7]、《国家卫生健康委办公厅关于印发新型冠状病毒实验室生物安全指南(第二版)的通知》(国卫办科教函〔2020〕70号)[8]及《新型冠状病毒感染的肺炎实验室检测技术指南(第四版)》(国卫办疾控函〔2020〕109号)[9]相关文件进行实验操作和生物安全防护。
1.3 仪器与试剂
核酸提取使用杭州奥盛K30型干浴仪高温干浴,离心使用安徽嘉文JW-2018H 高速冷冻离心机;提取的核酸使用NanoDrop One 微紫外/可见分光光度计测量核酸浓度、核酸纯度,检测前使用各试剂盒中提供的洗脱液作空白对照;新型冠状病毒基因扩增使用ABI 7500 实时荧光定量PCR仪,检测试剂使用中山大学达安基因提供的新型冠状病毒2019-nCoV 核酸检测试剂盒(批号:2020017),设置荧光检测通道及反应程序,按照说明书要求,当N基因、ORF1ab基因及IC基因的扩增通道出现明显的S型曲线,且Ct值均≤40,可判定为阳性结果。
选择已获得国家药监局批准的可用于新型冠状病毒核酸提取纯化的试剂盒,并对试剂盒随机编号为A(中山大学达安基因股份有限公司,批号为2020003)、B(圣湘生物科技股份有限公司,批号为2020002)、C(上海之江生物科技股份有限公司,批号为P20200101)、D(上海科华生物工程股份有限公司,批号为20026530)、E(江苏硕世生物科技股份有限公司,批号为20200110)、F(罗氏诊断有限公司,批号为43556600)。
4个阳性标本提取的核酸使用各公司试剂盒内提供的洗脱液按照1∶400,1∶800,1∶1 600,1∶3 200的稀释度倍比稀释,立即进行RT-qPCR扩增。
1.4 统计学处理
数据分析使用SPSS 22.0软件。计量资料用()表示组间数据比较采用单因素方差分析,数据使用多元方差分析,P<0.05 为差异具有统计学意义。图表使用GraphPad Prism 8.0.2 软件绘制。
2 结果
2.1 核酸提取试剂盒的基本情况
6种新冠病毒核酸提取试剂盒的基本情况见表1。
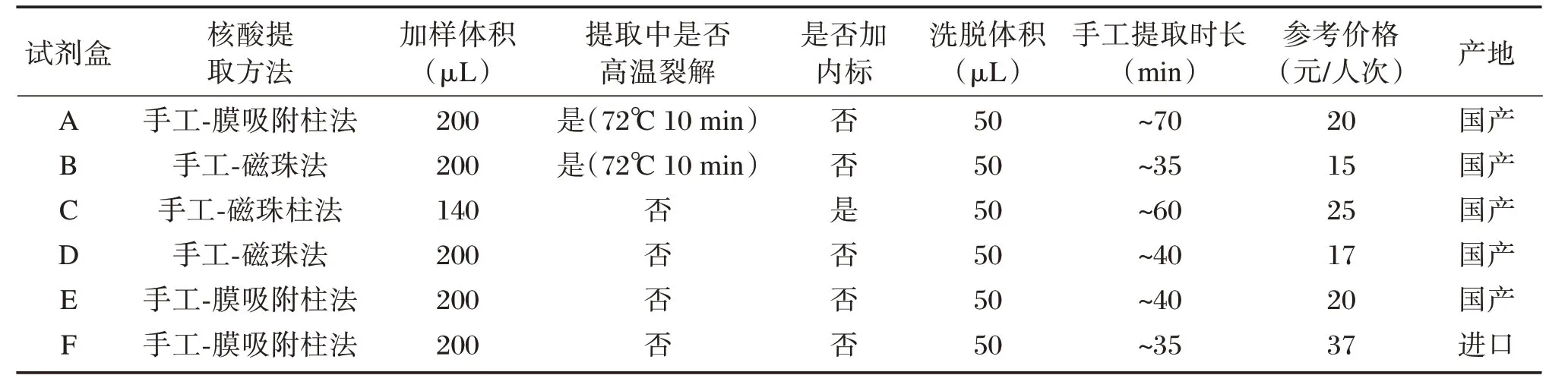
表1 核酸提取试剂盒基本情况表Table1 Baseline data of 2019-nCoV extraction kits
2.2 核酸浓度及纯度的比较
不同试剂盒所提取的核酸在浓度方面比较,差异有统计学意义(P<0.05),结果为A>F>D>B>E>C。核酸纯度中最高检测值为A试剂盒,剩下依次为E、D、F、C、B,6种试剂盒之间比较,差异有统计学意义(P<0.001)。见表2。
表2 核酸浓度及纯度的比较(±s)Table2 Comparison of total RNA concentration and purity(±s)

表2 核酸浓度及纯度的比较(±s)Table2 Comparison of total RNA concentration and purity(±s)
试剂盒ABCDEF P值n 20 20 20 20 20 20核酸浓度(ng/μL)75.499±13.565 6.827±1.925 2.252±0.965 15.912±3.038 6.548±2.151 46.666±13.404<0.001核酸纯度2.802±0.244 1.815±0.108 1.826±0.446 2.347±0.405 2.705±0.414 1.978±0.214<0.001
2.3 扩增结果分析
RT-qPCR扩增结果显示,6种试剂盒所提核酸均能检出4份标本的N基因、ORF1ab基因及IC基因(Ct值≤40),可判定为阳性。其他16份标本只有IC基因可检出,判定为阴性。
分析扩增后IC基因的Ct值及△Rn值。F试剂盒提取的总RNA 扩增后的Ct值最小,其次为D试剂、E试剂、B试剂、C试剂和A试剂(见图1A),差异有统计学意义(P<0.05)。扩增后得到的荧光曲线中,A试剂的ΔRn值最高,其次为F试剂、E试剂、D试剂、C试剂、B试剂(见图1B),差异有统计学差异(P<0.05)。
分析4个阳性标本N基因及ORF1ab基因的扩增数据。不同试剂提取的核酸扩增后,N基因中的Ct值A<D<E<F<B<C(如图2A),差异有统计学意义(P<0.05)。N基因的ΔRn值中,A试剂最高,其次为F试剂、D试剂、C试剂、E试剂及B试剂(如图2B),差异有统计学意义(P<0.05)。ORF1ab基因Ct值与ΔRn值的比较中,如图2C、2D,呈现出与N基因相同的趋势,差异有统计学意义(P<0.05)。
2.4 核酸稀释后扩增结果的比对
对4个阳性标本稀释后再扩增。F试剂提取的核酸在1∶3 200 稀释时可将4个阳性标本的IC基因、N基因、ORF1ab基因均检出。C试剂提取的核酸在1∶1 600 稀释时可以检出3个IC基因,3个N基因及1个ORF1ab基因。其他几种试剂盒在1∶1 600 稀释时均有未检出的基因。统计各试剂所提核酸经稀释后检出的阳性样本数目,如图3A。4个阳性样本在不同的稀释后,3次重复实验中,F试剂可检出各稀释度下所有的阳性样本,在1∶1 600 的稀释时C试剂检出2个阳性样本,其他几种试剂均未检出阳性样本,差异有统计学意义(P=0.002<0.05,F=12.82)。分析不同稀释度扩增后3个基因的Ct值,见如图3B、3C、3D,F试剂的提取效率最好,扩增曲线的Ct值在1∶800、1∶1 600和1∶3 200 的稀释度时,均低于其他几种试剂。
3 讨论
RT-qPCR因其灵敏度高、特异性强、操作简单且耗时短[10],成为新型冠状病毒核酸检测的主要方法。但使用RT-qPCR 检测新冠病毒出现假阴性率高、检测结果与临床症状不吻合等报道,备受关注[5-6]。在影响新冠病毒核酸检测结果的众多因素中,高质量、高纯度核酸是检测成功的必备条件。本次所选核酸提取试剂盒均为手工提取,包括膜吸附柱法、磁珠柱法和磁珠法。膜吸附柱法耗时长,但稳定性好,重复性高。磁珠法操作方便,用时少,价格低廉[11],二者相比各有所长。对提取出的总RNA 分析发现,F试剂盒提取出的核酸品质最高。C试剂盒提取出的核酸纯度虽符合要求,但浓度偏低,分析可能与其标本起始量过低相关。试剂盒A 提取的核酸虽然浓度高,但其核酸纯度不理想。质量较好的RNA 纯度A260/A280 比值应在1.8~2.0 之间,比值小于1.8 时,提示溶液中可能存在蛋白质或酚类的污染;大于2.0 时,或因RNA或已水解成单核苷酸导致,另一方面现有核酸提取试剂多使用异硫氰酸胍,其残留也会增加A260/A280 的比值。
Ct值为荧光信号达到阈值时所需的循环数,它与起始模板的浓度负相关,可以代表PCR 的扩增效率。ΔRn值是荧光PCR 在扣除背景信号后的荧光值,能反映扩增产物的数量。Ct值与ΔRn值的差异显示不同核酸提取试剂盒对新冠病毒核酸检测结果会产生影响。按比例对阳性标本的核酸进行稀释,并进行扩增分析,F试剂检出阳性样本数量最多,其次为C试剂,6种试剂盒相比差异明显。由此可见,核酸的浓度及纯度对新型冠状病毒核酸检测的结果有直接且显著的影响。
在新冠肺炎核酸检测方面各家实验室对试剂盒的评价不一致[12-13],一方面可能是各试剂盒上市仓促,质量和性能有待优化,另一方面也与实验室条件、操作人员检测经验、操作水平相关。本实验通过检测20例标本结果比对认为,市售的6种核酸提取试剂盒中,F试剂盒在提取效果及阳性标本的检出率方面均优于其他5种试剂盒,但其成本较高,常规实验室可能无法使用。其他5种试剂成本接近,因此各实验室可根据实验目的,样本量多少以及实验室经费等情况,选择适合的新冠病毒核酸提取试剂盒。

