骨密度T值与老年冠心病的相关性
王园园 崔建国 齐 洁 常冀杨 张清潭
滨州医学院附属医院老年医学科 山东 滨州 256603
《中国心血管病报告(2018)》显示,心血管病死亡率居首位,高于肿瘤及其他疾病,占居民疾病死亡构成的40%以上,其中冠心病是最为常见的心血管疾病之一,推算冠心病现患人数为1 100万[1]。尽管近11年来冠心病患者住院死亡率呈下降趋势,但其冠状动脉病变日益严重,长期死亡风险较高。分析其原因,可能是因为同时有更多的危险因素及合并症暴露[2]。吸烟、高血压、高血脂、糖尿病和肥胖等均被公认为其“经典”危险因素,通常被用于一般人群心血管疾病绝对风险评估[3]。低骨密度与冠心病均为与增龄相关的疾病,常同时存在于老年人群中,且低骨密度多同时伴有血压、血脂异常与冠心病等疾病。目前大多数类似研究直接进行二分类Logistic回归分析骨密度T值与冠心病的关系[4-5],极少对骨密度T值的危险因素进行严格的条件控制。本研究通过进行单因素、多因素、严格条件控制的多因素Logistic回归分析以评估骨密度T值与老年冠心病发病的相关性,旨在为老年冠心病的早期防治提供依据。
1 资料与方法
1.1 研究对象 收集2017年1月至2019年6月于某院行冠脉造影检查并行骨密度检查的512例老年患者(年龄≥60岁)的临床资料,冠心病诊断符合1979年WHO诊断标准,根据冠状动脉造影结果分为冠心病和非冠心病组。冠心病组273例,其中男128例,女145例,女性患者均绝经5年以上,平均年龄为(72.98±8.2)岁,有高血压者169例,糖尿病者131例,目前吸烟者96例;非冠心病组239例,其中男120例,女119例,女性患者均绝经5年以上,平均年龄为(68.60±7.5)岁,有高血压者133例,糖尿病者69例,目前吸烟者81例。非冠心病排除标准为先天性心脏病、心脏瓣膜病、结缔组织病、恶性肿瘤。根据双能X线吸收法(DXA)检查骨密度,中高血压患者近 3 个月未使用 ACEI 或ARB 类药物[18],未服用影响骨代谢药物(如激素、维生素D、钙、双磷酸盐等),骨密度T值≥-1.0 SD为骨密度正常组,骨密度T值<-1.0 SD为低骨密度组。骨密度正常组210例,其中男126例,女84例,平均年龄为(68.78±7.75)岁,有高血压者124例,糖尿病者65例,目前吸烟者76例。低骨密度组302例,其中男122例,女180例,平均年龄为(72.44±8.12)岁,有高血压者178例,糖尿病者134例,目前吸烟者101例。所有参与本研究的患者在研究前对本次实验目的及过程均有充分的了解,患者表示自愿参与本次研究,并签署知情同意书,符合医学伦理学要求并经本院伦理委员会审批通过。
1.2 资料收集 收集所有入选患者的姓名、性别、年龄、体重指数、高血压病史、糖尿病史、目前吸烟情况、实验室检查指标【Ca、碱性磷酸酶(alkaline phosphatase, ALP)、空腹血糖(fasting blood glucose, FBG)、甘油三酯(triglyceride, TG)、低密度脂蛋白(low density lipoprotein, LDL)、尿酸(uric acid, UA)】、骨密度T值、冠状动脉造影结果。
1.3 统计学方法 采用SPSS 22.0软件对数据进行处理。两组比较采用独立样本t检验。计数资料以例(%)表示,组间比较采用χ2检验。以各相关因素为自变量,骨密度T值为因变量,进行多元线性回归分析。多因素Logistic回归分析以评估低骨密度发生的独立危险因素。应用单因素、多因素、调整了骨密度T值的自变量因素后Logistic回归分析以评估冠心病的发生与骨密度T值的相关性。取双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 研究人群的基线特征 所有受试者的主要特征见表1。与非冠心病组相比,冠心病组年龄较大、糖尿病的比例较高,骨密度T值较低(P<0.05或<0.01)。与骨密度正常组相比,低骨密度组年龄较大、女性、糖尿病的比例较高,骨密度T值较低,UA较高(P<0.05或<0.01)。
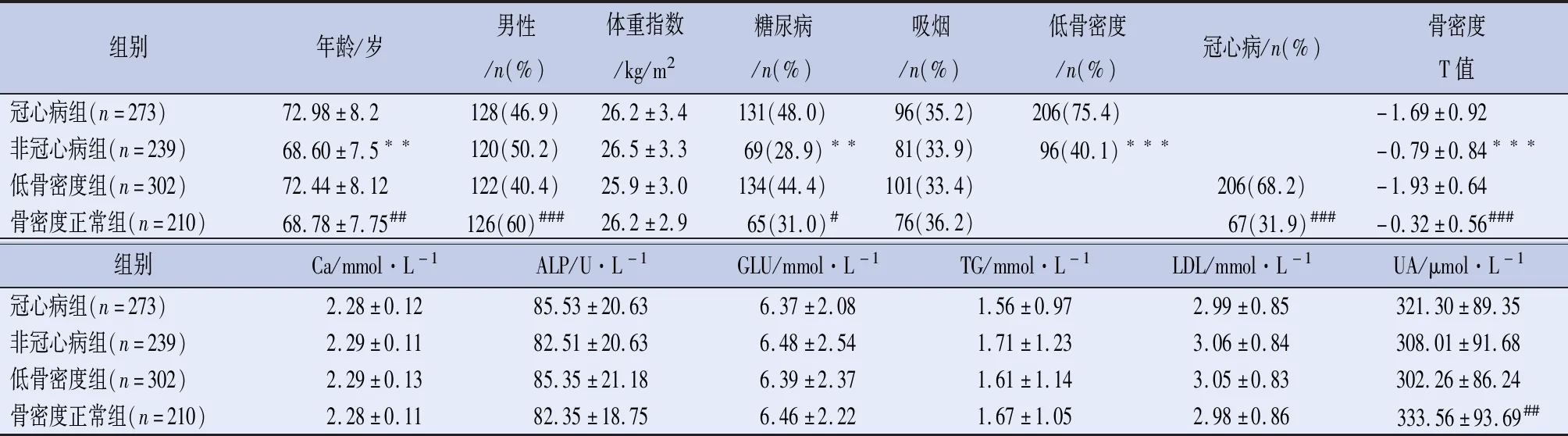
表1 临床基线资料
注:冠心病组与非冠心病组比较,**P<0.01,***P<0.001;低骨密度组与骨密度正常组比较,#P<0.05,##P<0.01,###P<0.001。
2.2 骨密度T值的相关性及回归分析 相关性分析见表2。以骨密度T值为因变量,以年龄、ALP、UA等为自变量进行多元线性回归分析,骨密度T值与年龄、ALP、FBG(β系数=-0.043、-0.007、-0.604,P<0.01)均呈负相关;骨密度T值与UA(β系数=0.002,P<0.001)呈正相关。容忍度(tolerance)均远大于0.1,VIF均介于1和10之间,各自变量之间不存在多重共线性。进一步以是否低骨密度为因变量,各风险因素为自变量,进行多因素Logistic回归分析,见表3。年龄、糖尿病为低骨密度发生的危险因素。
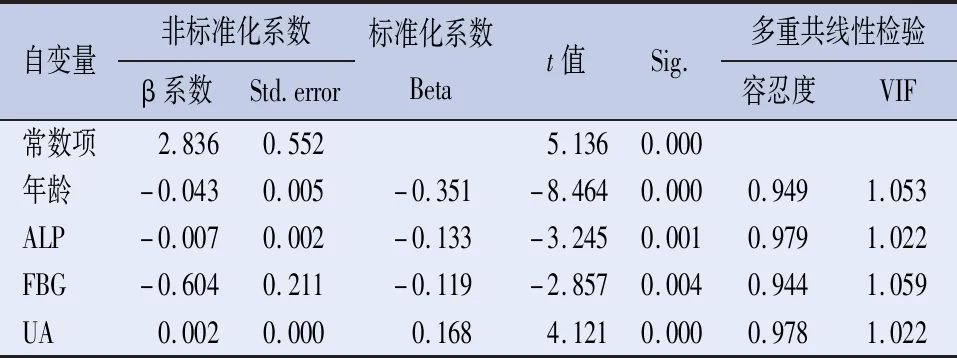
表2 骨密度T值的相关性分析
注:统计检验指标为:R=0.415,R2=0.172,F=21.086。
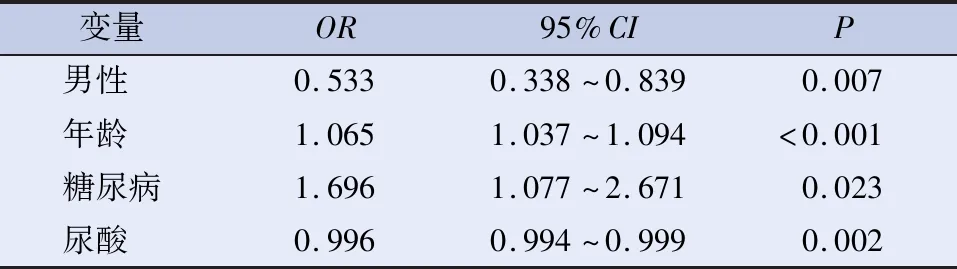
表3 骨密度T值的多因素Logistic回归分析
2.3 冠心病发病因素的Logistic回归分析 以是否发生冠心病为因变量,各相关因素为自变量,应用单因素和多因素Logistic回归分析,评估预测冠心病发生的影响因子见表4。单因素、多因素Logistic 回归分析结果均显示,骨密度T值高是老年冠心病发病的危险因素(P均<0.05);调整骨密度T值自相关因素(男性、年龄、糖尿病、尿酸)后,骨密度T值高(P<0.05)仍是冠心病的独立危险因素。

表4 冠心病发病因素的Logistic回归分析
3 讨论
冠心病的发病是由于多种危险因素作用于冠脉病变不同环节所致,主要影响因素包括年龄、性别、血脂异常、高血压、吸烟、糖尿病和糖耐量异常等。近年来,冠心病的一些“新型”危险因素如骨密度逐渐受到关注。Ahmadi等[7]对5 590例无冠心病的受试者随访8年,测量冠状动脉钙化(Agatston评分)和胸骨骨密度,研究显示其与年龄、性别、种族和传统危险因素无关,骨密度随冠状动脉钙化严重程度的增加呈下降趋势,在绝经后妇女中尤为明显。本研究亦发现,与非冠心病相比,冠心病组更易合并高龄、糖尿病、低骨密度,患低骨密度的风险升高。与骨密度正常组相比,低骨密度组更易合并高龄、糖尿病等高危临床因素,患冠心病的风险升高。这表明,低骨密度与冠心病存在共同的病因,而控制共同高危临床因素后,骨密度T值本身亦为冠心病的危险因素。
尽管目前尚未完全阐明低骨密度与冠心病之间的确切机制,但这种关系可能由低骨密度和冠心病的一些共同途径来解释。血管钙化的存在可能是解释这一关系的最重要因素,低骨密度的人比骨密度正常的人有更高的血管钙化发生率[17],钙化是动脉粥样硬化病变中普遍存在的炎症和修复过程的一部分,冠脉钙化是冠心病的典型病理改变之一,多由血管平滑肌向成骨或软骨细胞转化引起,主要表现为血管内膜钙化[10],并且其几乎只发生在动脉粥样硬化的动脉,在正常的血管壁中不存在[6]。因此,冠状动脉钙化常被应用于冠心病风险评估。冠状动脉中钙沉积可以减弱血管舒缩功能,改变动脉粥样硬化斑块的稳定性,而斑块的稳定性很大程度取决于非钙化斑块或软斑。不稳定型心绞痛或心肌梗死患者的病变往往包括多个小的钙沉积,而稳定型心绞痛患者的病变往往伴有少量面积大的钙沉积[11]。动脉钙化很容易被CT检测到,钙化评分可用于临床研究,以评估未来心血管事件的风险[12]。Guan等[8]研究显示在低骨密度组,冠心病多支病变的风险增加,冠状动脉斑块负荷增加,骨密度T值与改良Gensini评分呈负相关。Xuan等[9]应用亚洲骨质疏松自我评估工具调查发现,骨质疏松症与动脉硬化呈负相关。随着骨骼生物学研究的不断发展,目前发现有几种基质蛋白,如胶原蛋白-1、蛋白聚糖、骨桥蛋白(OPN)、骨连接蛋白以及骨骼形成蛋白,既在骨骼中发现,也在动脉粥样斑块的钙化过程中起到重要作用[14]。骨质疏松和动脉粥样硬化的发展有着共同的病理生理联系。促炎细胞因子,如IL-6和TNF-α,不仅有致动脉粥样硬化作用,而且会增强破骨细胞的增殖和活性,导致骨骼分解代谢增加[16]。因此,骨骼发育和代谢与动脉钙化过程具有相似性,动脉钙化与骨质丢失相互促进[7]。
治疗骨质疏松的药物对心血管疾病的治疗有一定的影响,这进一步表明低骨密度与心血管疾病之间有相似的病理生理机制[19]。钙补充剂可增加心肌梗死的风险, 其广泛使用,这可能在一定程度上增加了心血管疾病的风险[20]。Gonnelli等[13]研究显示,60名绝经骨质疏松女性静脉注射伊班磷酸盐和唑来磷酸盐后,高密度脂蛋白胆固醇水平和高密度脂蛋白胆固醇/低密度脂蛋白胆固醇比值均明显增加。与注射伊班磷酸盐的女性相比,注射唑来磷酸盐会导致12个月后颈动脉内膜-中膜厚度明显减少和更有效地降低低密度脂蛋白胆固醇水平。
目前全球人口老龄化,低骨密度和冠心病患病率高,并且在老年人中经常同时发生[15]。老年冠心病患者合并低骨密度易出现严重并发症如脆性骨折,降低患者生活质量,甚至导致长期残疾,死亡风险增加。因此,在临床工作中,医护人员应当对老年冠心病合并低骨密度患者高度关注,实施早期治疗干预,可能会延缓冠状动脉病变的进展,综合控制各种危险因素,对于冠心病的预防和改善预后极为重要。本研究存在一定局限性:本研究为单中心回顾性研究,可能存在研究对象的偏移;本研究为冠心病与骨密度相关性的初步研究,未考虑绝经等其他因素的影响,且样本量偏少,上述结果还需大样本量的随机对照试验研究进一步验证;本研究未能对冠心病种类进行细分;本研究未考虑冠心病用药(如他汀类)对化验指标的影响。

